- 2021-07-05 发布 |
- 37.5 KB |
- 22页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版 化工生产过程中的基本问题 课时作业
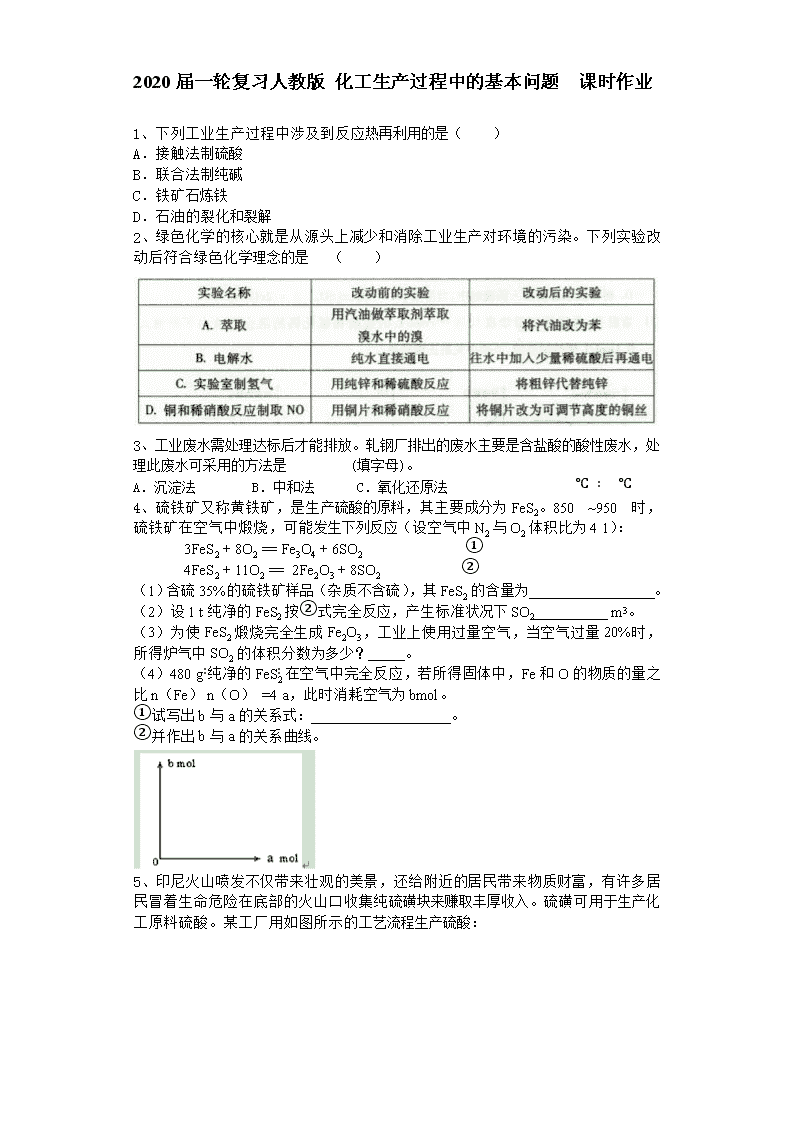
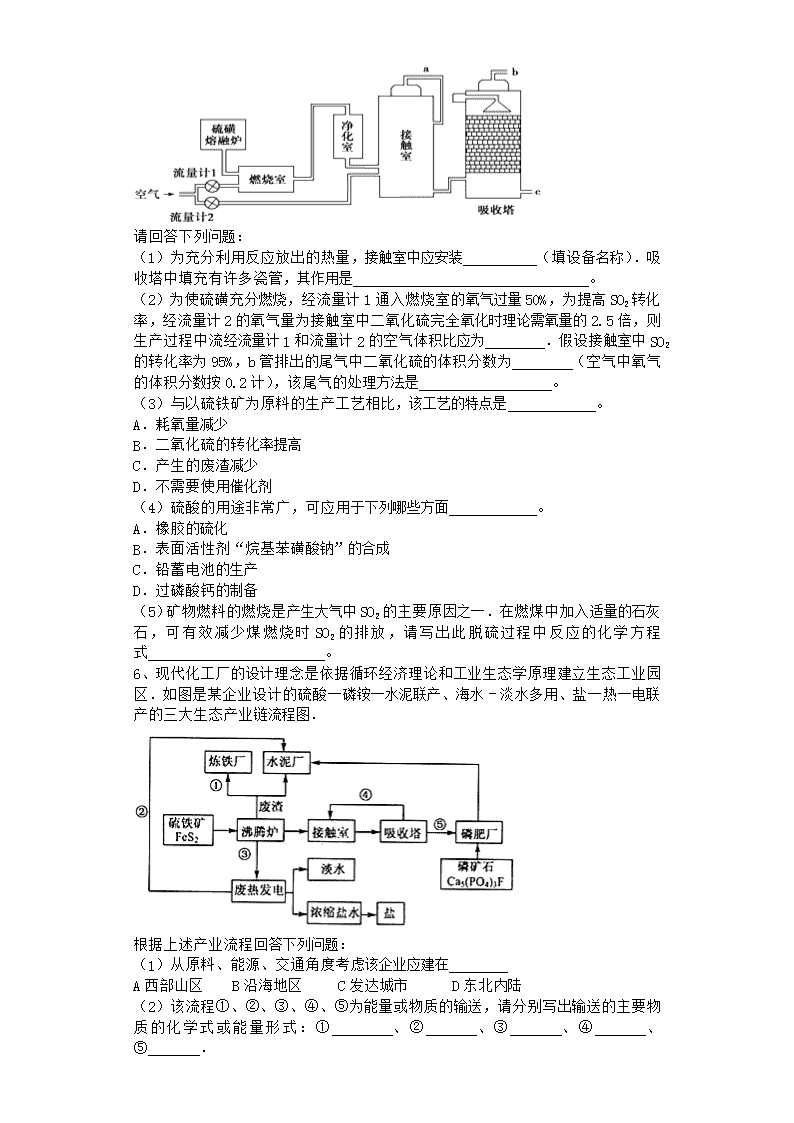
2020届一轮复习人教版 化工生产过程中的基本问题 课时作业 1、下列工业生产过程中涉及到反应热再利用的是( ) A.接触法制硫酸 B.联合法制纯碱 C.铁矿石炼铁 D.石油的裂化和裂解 2、绿色化学的核心就是从源头上减少和消除工业生产对环境的污染。下列实验改动后符合绿色化学理念的是 ( ) 3、工业废水需处理达标后才能排放。轧钢厂排出的废水主要是含盐酸的酸性废水,处理此废水可采用的方法是 (填字母)。 A.沉淀法 B.中和法 C.氧化还原法 4、硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4∶1): 3FeS2 + 8O2 = Fe3O4 + 6SO2 ① 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 ② (1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为_________________。 (2)设1 t纯净的FeS2按②式完全反应,产生标准状况下SO2__________ m3。 (3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少? 。 (4)480 g纯净的FeS2在空气中完全反应,若所得固体中,Fe和O的物质的量之比n(Fe)∶n(O) =4∶a,此时消耗空气为bmol。 ①试写出b与a的关系式:___________________。 ②并作出b与a的关系曲线。 5、印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用如图所示的工艺流程生产硫酸: 请回答下列问题: (1)为充分利用反应放出的热量,接触室中应安装 (填设备名称).吸收塔中填充有许多瓷管,其作用是 。 (2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 .假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 。 (3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 。 A.耗氧量减少 B.二氧化硫的转化率提高 C.产生的废渣减少 D.不需要使用催化剂 (4)硫酸的用途非常广,可应用于下列哪些方面 。 A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成 C.铅蓄电池的生产 D.过磷酸钙的制备 (5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。 6、现代化工厂的设计理念是依据循环经济理论和工业生态学原理建立生态工业园区.如图是某企业设计的硫酸一磷铵一水泥联产、海水﹣淡水多用、盐一热一电联产的三大生态产业链流程图. 根据上述产业流程回答下列问题: (1)从原料、能源、交通角度考虑该企业应建在 A西部山区 B沿海地区 C发达城市 D东北内陆 (2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:① 、② 、③ 、④ 、⑤ . (3)沸腾炉发生反应的化学方程式: ;磷肥厂的主要产品是普钙,其主要成分是 (填化学式). (4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可). (5)根据现代化工厂没计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想. , (写出两点即可). 7、以黄铁矿为原料,采用接触法生产硫酸的流程可简示如图1: 请回答下列问题: (1)在炉气制造中,生成SO2的化学方程式为 ; (2)炉气精制的作用是将含SO2的炉气 、 和干燥,如果炉气不经过精制,对SO2催化氧化的影响是 ; (3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图2所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 、 ; (4)在SO2催化氧化设备中设置热交换器的目的是 、 ,从而充分利用能源. 8、KI可用于制造染料、感光材料、食品添加剂等,其工业生产过程如下: (1)“歧化”产物之一是碘酸钾(KIO3),该反应的离子方程式是 。 (2)“还原”过程中使用的铁屑需用碱溶液清洗,其目的是 。 (3)“调pH”的具体实验操作是 (限用试剂:KOH溶液、pH试纸)。 (4)“操作X”的名称是 ,Y的化学式是 。 (5)在“操作X”后,为得到KI固体,还需要进行的实验操作是 。 (6)在测定产品中KI含量时,测得其含量为101.5%,其原因可能是产品中混有I2。检验产品中含I2的方法是 。 9、以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如图: (1)依据工艺流程图判断下列说法不正确的是(选填序号字母) . A.为使黄铁矿充分燃烧,需将其粉碎 B.过量空气能提高SO2的转化率 C.排出的矿渣可供炼铁 D.使用催化剂能提高SO2的化学反应速率和转化率 E.设备I生成的气体经净化的主要目的是防止催化剂中毒 F.热交换器的目的是使SO2的热量传递给SO3,有利于SO2的氧化和SO3的吸收 (2)设备Ⅰ的名称为沸腾炉,燃烧黄铁矿的化学方程式为 . (3)设备Ⅱ为接触室,采用常压而不采用高压的原因是 .在生产中,为提高催化剂效率采取的措施有 . (4)设备Ⅲ为吸收塔,从顶部喷淋 吸收SO3,得到 ,不用水吸收SO3是为了 .吸收塔中填充有许多瓷管,其作用是 . (5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是 . 10、火山喷发所产生的硫黄可用于生产重要的化工原料硫酸.某企业用如图1所示的工艺流程生产硫酸: 请回答下列问题: (1)硫酸的用途非常广泛,可应用于下列哪些方面 (可多选) A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成 C.铅蓄电池的生产 D.过磷酸钙的制备 (2)为充分利用反应放出的热量,接触室中应安装 (填设备名称).吸收塔中填充有许多瓷管,其作用是 . (3)如果进入接触室的混合气(含SO2体积分数为7%、O2为ll%、N2为82%)中SO2平衡转化率与温度及压强的关系如图2所示.在实际生产中,SO2催化氧化反应的条件选择常压和450℃,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 . (4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为 .假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计), (5)工业对硫酸厂尾气的处理方法一般是 . 11、磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质.工业上以磷矿石为原料制备H3PO4,一种生产流程如下: 已知:Ca5F(PO4)3+7H3PO4→5Ca(H2PO4)2+HF (1)写出有关操作的名称:Ⅰ 、Ⅲ .工艺流程中设计操作Ⅱ与Ⅲ的目的是 . (2)若在实验室里采用此种方法溶解磷矿石,请写出必须的实验注意事项,并说明理由: . (3)磷矿石也可直接用硫酸溶解,两种工艺相比,该工艺的优点是 . (4)测定产品磷酸的浓度可采用滴定法.准确量取10.00mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103mol/L标准NaOH溶液滴定;当观察到溶液恰好变色,且在半分钟内不变色,即为滴定终点(生成NaH2PO4),消耗标准溶液20.16mL.该实验过程中需要的定量仪器有 (写名称). (5)若理论上滴定应耗用标准溶液20.20mL,则相对误差为 (按近似计算法则).该产品中磷酸的质量分数为 (保留3位小数). 12、亚氯酸钠是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀毒.以下是过氧化氢法生产亚氯酸钠的工艺流程图: 已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出NaClO2?3H2O. ②纯ClO2为气态,易分解爆炸,一般用稀有气体或空气稀释到10%以下安全. (1)ClO2发生器中发生反应的离子方程式为 . (2)发生器中鼓入空气的作用可能是 (选填序号). a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防爆炸 c.将NaClO3氧化为ClO2 (3)吸收塔内的反应的离子方程式为 .吸收塔的温度不能超过20℃,其目的是 . 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是 . (4)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是 、冷却结晶、过滤(选填序号). a.蒸馏 b.蒸发 c.灼烧 (5)要得到更纯的NaClO2?3H2O晶体必须进行的操作是 (填操作名称)。 13、钡盐行业生产中排出大量的钡泥,主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下(已知溶液中Fe3+沉淀完全的pH=3.7): (1)酸溶后溶液中,Ba(FeO2)2与HNO3的反应化学方程式为 。 (2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是 。 (3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽)。 14、印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸: 请回答下列问题: (1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。 (2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。 假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________ (空气中氧气的体积分数按0.2计),该尾气的处理方法是________。 (3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。 A.耗氧量减少 B.二氧化硫的转化率提高 C.产生的废渣减少 D.不需要使用催化剂 (4)硫酸的用途非常广,可应用于下列哪些方面__________________________。 A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成 C.铅蓄电池的生产 D.过磷酸钙的制备 (5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式________________________________。 15、硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。 I尾气的吸收和综合利用。 以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: (1)反应III中氧化剂与还原剂的物质的量之比为 。 (2)反应Ⅳ的化学方程式为 。 (3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为 。 Ⅱ催化剂的回收利用。 SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下: (4)若反萃取使用的硫酸用量过大,进一步处理时会增加____ 的用量。 (5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为 。 氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为 。 16、以黄铁矿为原料,采用接触法生产硫酸的流程可简示如图1: 请回答下列问题: (1)在炉气制造中,生成SO2的化学方程式为 ; (2)炉气精制的作用是将含SO2的炉气 、 和干燥,如果炉气不经过精制,对SO2催化氧化的影响是 ; (3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图2所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 ; (4)在SO2催化氧化设备中设置热交换器的目的是 ,从而充分利用能源. 17、粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。 一种利用粉煤灰制取氧化铝的工艺流程如下: (1)粉煤灰研磨的目的_______。 (2)第1次过滤时滤渣的主要成分有 (填化学式,下同)和 ,第3次过滤时滤渣的成分是 (3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例)。 (4)流程中循环使用的物质有________和________。(填化学式) (5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13·6H20,该过程能够发生的原因是 (6)用粉煤灰制取含铝化合物的主要意义是 18、高温裂解法处理工业废硫酸工艺流程图如图: 废硫酸高温裂解的基本原理可用下列方程按两个阶段进行 H2SO4(l)SO3(g)+H2O(g) ΔH1=+176 kJ·mol-1① 2SO3(g) 2SO2(g)+ O2(g) ΔH2=+196 kJ·mol-1② 为研究废硫酸的雾化和裂解情况,有关实验数据如下: 雾化后废硫酸液滴直径 废硫酸完全裂解所需时间 普通雾化器 800μm~1 200μm 10 s以上 旋转式雾化器 600μm~850μm 8 s~10 s 压缩风雾化器 400μm~650μm 6 s~7 s 超声波雾化器 100μm~300μm 3.5 s~5 s (1)由上表数据可得出的结论是 ; (2)废硫酸裂解成SO2总反应的热化学方程式为 ; (3)在催化氧化室中发生反应: 2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1 ①某温度时,该反应的平衡常数K=3.5,平衡后再充入一定量气体测得100 L的恒容密闭容器中含有3.0 mol SO2,16.0 mol O2和3.0 mol SO3(g),此时平衡 (填“向正反应方向”“向逆反应方向”或“不”)移动; ②上述反应达到平衡后,改变下列条件,能使SO2的物质的量比原来减小的是 (填字母); A.保持温度和容器体积不变,充入1.0 mol O2 B.保持温度和容器内压强不变,充入3.0 mol N2 C.降低温度 D.在其他条件不变时,缩小容器的容积 (4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为 ; (5)科学家研究出如图所示装置,用电化学原理生产硫酸的新工艺,其阳极的电极反应式为 ,总反应的化学方程式为 。 19、目前,我国采用“接触法”制硫酸,设备如图所示: (1)图中设备A的名称是 ,该设备中主要反应的化学方程式 为 。 (2)有关接触法制硫酸的下列说法中,不正确的是 。 A.二氧化硫的接触氧化在接触室中发生 B.吸收塔用浓度为98.3%的浓硫酸吸收三氧化硫 C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 (3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图。为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为 。 20、LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下: 已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。 (1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。 (2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式: 。 (3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。 (4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。 参考答案 1、答案:A A、接触法制硫酸分三步,4FeS2+11O22Fe2O3+8SO2; SO2+O2═SO3 SO3+H2O═H2SO4,每一步都要发热,所以为了节约能源,可以将接触法制硫酸放出的热量进行再利用,故A正确; B、联合法制纯碱分二步,主要是先向饱和氯化钠溶液中通氨气、二氧化碳生成碳酸氢钠晶体,过滤得碳酸氢钠在加热分解生成纯碱,主要是需要吸热,所以不涉及到反应热再利用,故B错误; C、在炼铁过程中,焦炭先跟热空气中的氧气发生反应,生成二氧化碳,二氧化碳再与炽热的焦炭反应,生成一氧化碳,一氧化碳在还原氧化铁,主要是需要吸热,所以不涉及到反应热再利用,故C错误; D、石油的裂化裂解是在高温下使含碳个数多的烃分解的过程,需要吸热,所以不涉及到反应热再利用,故D错误. 故选:A. 2、答案:D 3、答案:B 4、答案:(1)65.6% (2)373.3 (3)12.7% (4)①b=0.5a+8 ② (1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为64:35%=120:x,解得x=65.6% (2) 4FeS2 +11O2=2Fe2O3 +8SO2 480g 8×22.4L 1×103 V V= (8×22.4L×1×103)÷480=373.3×103L=373.3; (3) 假设氧气消耗20体积则11/8=20/x 解得x=14.54 二氧化硫体积分数 14.54/(120-20+14.54)=12.7% (4)①3FeS2 +8O2 = Fe3O4 +6SO2 ② 4FeS2 +11O2 = 2Fe2O3 +8SO2 3x 8x x 2y 5.5y y 根据Fe元素守恒可得:3x+2y=4;固体中O元素的质量为:4x+3y=a;由方程式中消耗氧气的物质的量为:8x+5.5y=b;解这三个方程式可求得b与a的关系式:b=0.5a+8; 5、答案:(1)热交换器 ; 使浓H2SO4与SO3充分接触 (2)6:5. 0.41% 用氨水吸收 (3) AC (4)BCD (5)CaCO3CaO+CO2↑、SO2+CaO═CaSO3、2CaSO3+O2═2CaSO4 (1)①接触室中进行的反应为SO2的催化氧化,为放热反应,使用热交换器可以充分利用反应放出的热量,对原料气进行预热。吸收塔中填充瓷管的作用是增加接触面积。 (2)S+O2=SO2参加反应的硫黄为1 mol,则经流量计1通入的氧气为1.5 mol,反应后气体总量为1.5 mol×5=7.5 mol,根据反应的方程式2SO2+O2 2SO3 可知物质的量之差为0.5 mol,经流量计2通入的氧气为0.5 mol×2.5=1.25 mol,则 ==。反应后气体总量为7.5 mol+1.25 mol×5-1 mol×95%×=13.275 mol,则尾气中SO2的体积分数为=0.41%。硫酸工业中,尾气SO2用氨水吸收,再用硫酸处理:SO2+2NH3+H2O=(NH4)2SO3,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。生成的(NH4)2SO4可作肥料。 (3)硫铁矿的含硫成分为FeS2,硫元素被氧化生成SO2的同时,铁元素也被氧化生成Fe2O3(废渣),与硫黄直接燃烧相比,耗氧量增加,产生的废渣也增加。答案选AC; (4)橡胶的硫化是采用硫黄;合成烷基苯磺酸钠需要先合成烷基苯磺酸,而烷基苯磺酸通过烷基苯与浓硫酸的磺化反应生成;铅蓄电池用硫酸作为电解质溶液;过磷酸钙通过磷酸钙与硫酸反应制得。答案选BCD; (5)CaCO3CaO+CO2↑;SO2+CaOCaSO3;CaSO3不稳定,在空气中容易被氧化成CaSO4。2CaSO3+O2=2CaSO4。 6、答案:(1)B; (2)①Fe2O3 ②电能 ③热能 ④SO2 ⑤浓H2SO4; (3)4FeS2+1102 2Fe2O3+8SO2;Ca(H2PO4)2、CaSO4; (4)海水;镁或溴; (5)废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料. 解:(1)该产业链需要大量的水、NaCl等所以应建在沿海地区,故答案为:B; (2)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③沸腾炉中FeS2与氧气反应放出大量的热,④制硫酸时接触室中二氧化硫被氧化,⑤硫酸工业中生成的硫酸,可用于制磷肥,故答案为:①Fe2O3 ②电能 ③热能 ④SO2 ⑤浓H2SO4; (3)沸腾炉中FeS2与氧气反应生成Fe2O3和SO2,其反应方程式为:4FeS2+1102 2Fe2O3+8SO2;用硫酸与磷酸钙反应生成磷酸,磷酸与磷酸钙反应生成磷酸二氢钙,故答案为:4FeS2+1102 2Fe2O3+8SO2;Ca(H2PO4)2、CaSO4; (4)沿海地区有丰富的海水资源;海水中含有丰富的Mg元素、溴元素等可以制取Mg或溴,故答案为:海水;镁或溴; (5)根据工厂的废气、废渣的成分可知,废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料,故答案为:废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料. 7、答案:(1)4FeS2+11O24Fe2O3+8SO2; (2)除尘、水洗;砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响; (3)不选择B点,因为压强越大对设备的投资大,消耗的动能大,SO2原料的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压; 不选择C点,因为温度越低,SO2转化率虽然更高,但催化作用受影响,450℃时,催化剂的催化效率最高,故不选C点; (4)利用反应放出的热量预热原料气;上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全. 解:(1)黄铁矿的主要成分是FeS2,在高温条件下与氧气反应,其反应的化学方程式为:4FeS2+11O24Fe2O3+8SO2; 故答案为:4FeS2+11O24Fe2O3+8SO2; 在催化氧化时必须进行除尘、洗涤、干燥,以达到除去砷、硒等化合物的效果,这些物质会使催化剂中毒,并且水蒸气在高温下与铁反应,对设备和生产有不良影响, 故答案为:除尘、水洗;砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响; (3)在反应2SO2+O22SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高. 故答案为:不选择B点,因为压强越大对设备的投资大,消耗的动能大,SO2原料的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压;不选择C点,因为温度越低,SO2转化率虽然更高,但催化作用受影响,450℃时,催化剂的催化效率最高,故不选C点; (4)在S02催化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,冷却生成气体,可起到充分利用能源的目的, 故答案为:利用反应放出的热量预热原料气;上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全. 8、答案:(1) I2+6OH-=I-+IO+3H2O (2)去除铁屑表面的油污 (3)向“还原”所得混合物中滴加KOH溶液,用洁净的玻璃棒蘸取少量溶液,点在pH试纸上,再与标准比色卡比照,测出pH;重复操作,直至pH≈9 (4)过滤; Fe(OH)2或Fe(OH)3 (5)蒸发浓缩、冷却结晶、过滤、洗涤 (6)取少许产品于试管中,用少量水溶解;再滴入淀粉溶液,若溶液呈蓝色,说明产品中混有I2 (1)I2在KOH中发生歧化生成KIO3,碘元素化合价升高生成KIO3,化合价降低生成KI,配平时采用逆向配平。 (2)油脂在碱性条件下可发生水解。 (3)用pH试纸测定溶液的pH值,需要用玻璃棒蘸溶液,不可将试纸润湿或将试纸直接放到溶液中去。 (4)调节pH=9的目的是除去Fe2+,生成Y为Fe(OH)2沉淀,故操作X为过滤。 (5)由KI溶液获得KI固体,需要蒸发浓缩,冷却结晶,过滤,洗涤。 (6)I2遇淀粉溶液变蓝色,而I-遇淀粉溶液不变色,利用这一性质检验I2的存在。 9、答案:(1)DF; (2)沸腾炉;4FeS2+11O22Fe2O3+8SO2; (3)常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多却会大大增加设备成本;净化气体、控制温度在400~500℃;增大催化剂与反应气体的接触面积等; (4)98.3%的硫酸;发烟硫酸(或浓硫酸);避免产生酸雾降低吸收效率;增加SO3与浓硫酸的接触面,有利于SO3的吸收; (5)SO2+Br2+2H2O=4H++2Br﹣+SO42﹣. (1)A.在沸腾炉中,原料黄铁矿是固体、空气是气体,为了加快反应速率,所以要将黄铁矿粉碎,增大接触面,提高反应速率,故A正确; B、转化率=已转化的原料的量/原料的总量×100%,接触室中反应2SO2+O22SO3,为可逆反应,采用空气过量目的是增大氧气浓度,促使平衡正向移动,导致SO2更多的转化成SO3,所以SO2转化率提高,故B正确; C.沸腾炉排出的矿渣为F2O3,F2O3可供炼铁,故C正确; D.催化剂只能改变反应速率,不能影响转化率,故D错误; E.设备I生成的气体经净化的主要目的是防止催化剂中毒,故E正确; F.热交换器的目的是使SO2的热量传递给SO3,有利于SO2的氧化,但不利于SO3的吸收,故F错误; 故答案为:DF; (2)设备Ⅰ的名称为沸腾炉,反应方程式为:4FeS2+11O22Fe2O3+8SO2,故答案为:沸腾炉;4FeS2+11O22Fe2O3+8SO2; (3)采用常压而不采用高压的原因是常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多,却会大大增加设备成本;在生产中,为提高催化剂效率采取的措施有通过净化气体、控制温度在400~500℃、增大催化剂与反应气体的接触面积可以提高催化剂效率; 故答案为:常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多却会大大增加设备成本;净化气体、控制温度在400~500℃;增大催化剂与反应气体的接触面积等; (4)吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒98.3%的硫酸作吸收液,最终得到“发烟”硫酸;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收; 故答案为:98.3%的硫酸;发烟硫酸(或浓硫酸);避免产生酸雾降低吸收效率;增加SO3与浓硫酸的接触面,有利于SO3的吸收; (5)SO2吸收Br2 的反应中二氧化硫被氧化为硫酸,溴单质被还原为溴化氢,离子方程式为SO2+Br2+2H2O=4H++2Br﹣+SO42﹣,故答案为:SO2+Br2+2H2O=4H++2Br﹣+SO42﹣. 10、答案:(1)BCD; (2)热交换器;增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收; (3) 不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点; (4)6:5;0.39%; (5)用氨水来吸收; (1)A、橡胶硫化所用到的为单质硫,故A错误; B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,磺化反应就是与硫酸发生的取代反应,故B正确; C、铅蓄电池中需要用到硫酸作电解质溶液,故C正确; D、过磷酸钙的制取过程中需要浓硫酸和磷矿石,故D正确; 故选:BCD; (2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收, 故答案为:热交换器;增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收; (3)由图2可知,不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点; 故答案为:不选B点,压强越大对设备的投资越大,消耗的动能大,SO2的转化率在1个大气压时,已经很高了,再提高压强SO2的转化率提高不大;不选C点,因为C点温度低,SO2的转化率虽然很高,但是催化剂的催化效率降低,450℃时催化剂的催化效率最高,所以选择A点,不选择C点; (4)燃烧室中的反应为S+O2SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2?2SO3,则流量计2中通入氧气的体积为2.5×0.5x=1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5; 燃烧室剩余空气6.5x,接触室剩余空气6.25x﹣0.5×0.95x=5.775x,剩余SO20.05x,故b管尾气中SO2的体积分数为=0.39%; 故答案为:6:5;0.39%; (5)硫酸工业的尾气中含有二氧化硫,二氧化硫是酸性氧化物,可用碱性物质氨水来处理,故答案为:用氨水来吸收; 11、答案:(1)过滤;萃取;除去磷酸粗品中的杂质Mg2+、Fe3+等; (2)不能使用玻璃器皿,因为HF会腐蚀玻璃或要在密闭系统中进行,因为HF有剧毒; (3)避免生成的石膏沉积在磷矿石表面; (4)滴定管、1000mL容量瓶; (5)﹣0.2%;66.7%. (1)操作Ⅰ通过过滤分离出石膏,根据图示,磷酸粗品中含有H+、Ca2+、Mg2+、Fe3+离子,操作Ⅱ、Ⅲ 是萃取和反萃取,萃取时,必须满足萃取剂与水互不相溶、萃取的物质在水中的溶解度较小,工艺流程中设计操作Ⅱ与Ⅲ的目的是用来除去磷酸粗品中的杂质Mg2+、Fe3+等; 故答案为:过滤;萃取;除去磷酸粗品中的杂质Mg2+、Fe3+等; (2)若在实验室里采用此种方法溶解磷矿石,由于HF具有腐蚀性,能够腐蚀玻璃,所以不能使用玻璃仪器,或要在密闭系统中进行,因为HF有剧毒, 故答案为:不能使用玻璃器皿,因为HF会腐蚀玻璃或要在密闭系统中进行,因为HF有剧毒; (3)如果直接用硫酸溶解磷矿石,生成的石膏会沉积在磷矿石表面,该工艺避免了生成的石膏沉积在磷矿石表面, 故答案为:避免生成的石膏沉积在磷矿石表面; (4)准确量取10.00mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103mol/L标准NaOH溶液滴定,该实验过程中需要的定量仪器有准确量取溶液的滴定管,配制溶液所需的1000mL的容量瓶; 故答案为:滴定管、1000mL容量瓶; (5)相对误差=×100%=×100%=﹣0.2%, 磷酸产品的质量是:10.00mL×1.526g/cm3=15.26g,1L磷酸产品配成的溶液消耗0.103mol/L标准NaOH溶液的体积为:20.16mL×=1.008L, 磷酸与氢氧化钠反应的关系式为:H3PO4~NaH2PO4~NaOH,n(H3PO4)=n(NaOH)=0.103mol/L×1.008L≈0.1040mol, 所以该磷酸产品的质量分数为:×100%≈66.7%, 故答案为:﹣0.2%;66.7%. 12、答案:(1)2SO2+ClO3﹣=C1O2+2SO42﹣; (2)b; (3)2OH﹣+2ClO2+H2O2═2ClO2﹣+O2↑+2H2O;防止H2O2受热分解,有利于NaClO2?3H2O的析出;酚酞. (4)b; (5)重结晶. (1)由流程图可知C1O2发生器中目的是产生C1O2,二氧化硫具有还原性,将ClO3﹣还原为C1O2,自身被氧化为SO42﹣,反应离子方程式为2SO2+ClO3﹣=C1O2+2SO42﹣; 故答案为:2SO2+ClO3﹣=C1O2+2SO42﹣; (2)由信息②可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸,故选b; (3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是酚酞,过量时,显示红色,反之不会显示红色. 故答案为:2OH﹣+2ClO2+H2O2═2ClO2﹣+O2↑+2H2O;防止H2O2受热分解,有利于NaClO2?3H2O的析出;酚酞. (4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,故答案为:b; (5)得到的粗晶体经过重结晶可得到纯度更高的晶体. 故答案为:重结晶. 13、答案:(1) Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O (2) 防止反应速度过快; 浓HNO3易挥发、分解 (3) BaCO3 ; Fe3+ H+ (1) Ba(FeO2)2中铁的化合价是+3,与HNO3的反应不涉及氧化还原,化学方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O (2) 酸溶时通常控制反应温度不超过70℃,是因为温度高时反应速度过快 ,不使用浓硝酸是因为浓HNO3易挥发,受热或见光易分解 。 (3) X的作用是与氢离子反应使溶液的PH调高到4-5,根据制备的产品是Ba(NO3)2,用BaCO3不会引入杂质。 加入X消耗氢离子,溶液的PH调高到4-5,铁离子沉淀完全,所以溶液中 Fe3+ H+的浓度减少。 14、答案:(1)热交换器 增加SO3与浓硫酸的接触面积,有利于SO3的吸收 (2)1.2:1(或6:5) 0.004 用氨水吸收 (3)AC (4)BCD (5)CaCO3=CaO+CO2↑;2SO2+2CaO+O2=2CaSO4(或2SO2+2CaCO3+O2=2CaSO4+2CO2) (1)接触室中进行的反应为SO2的催化氧化,为放热反应,使用热交换器可以充分利用反应放出的热量,对原料气进行预热;吸收塔中填充瓷管的作用是增加接触面积;燃烧室S+O2SO2,若参加反应的硫磺为1mol,则经流量计1通入的氧气为V1=1.5mol,反应后气体总量为1.5mol×5=7.5mol,接触室2SO2+O22SO3,1molSO2转化需要0.5molO2,经流量计2通入的氧气为V2=0.5mol×2.5=1.25 mol,则=1.2;反应后气体总量为7.5mol+1.25mol×5-1mol×95%×1/2=13.275mol,则尾气中SO2的体积分数为=0.004;硫酸工业中,尾气SO2用氨水吸收,再用硫酸处理:SO2+2NH3+H2O=(NH4)2SO3,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O,生成的(NH4)2SO4可作肥料; (3)硫铁矿的含硫成分为FeS2,硫元素氧化生成SO2的同时,铁元素也被氧化生成Fe2O3(废渣),与硫磺直接燃烧相比,耗氧量增加,产生的废渣也增加; (4)橡胶的硫化是采用硫磺;合成烷基苯磺酸钠需要先合成苯磺酸,而苯磺酸通过苯与浓硫酸的磺化反应生成;铅蓄电池用硫酸作为电解液;过磷酸钙通过磷酸钙与硫酸反应得到; (5)碳酸钙先分解,生成CaO结合SO2转化为CaSO3,CaSO3不稳定,在空气中容易被氧化成CaSO4。 15、答案:(1)1︰4 (2)NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4 (3)K2SO4在40%的乙二醇溶液中溶解度更小 (4)NH3?H2O (5)Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O , 2︰3。 (1)反应III的化学方程式为:CaSO4+4C高温 = CaS+4CO↑.在该反应中CaSO4作氧化剂,C作还原剂,它们的物质的量的比为1︰4 。(2)由框图中的信息可知反应Ⅳ的化学方程式为NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4。(3)反应V在25℃ 、40%的乙二醇溶液中进行,该反应能顺利进行的原因为K2SO4在40%的乙二醇溶液中溶解度更小。(4)若反萃取使用的硫酸用量过大,为中和硫酸消耗的氨水就会增多。所以进一步处理时会增加NH3?H2O的用量。(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O。氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为12:(7×6-12×2)=2:3. 16、答案:(1)4FeS2+11O24Fe2O3+8SO2; (2)除尘、水洗;砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响; (3)不选择B点,因为压强越大对设备的投资大,消耗的动能大,SO2原料的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压;不选择C点,因为温度越低,SO2转化率虽然更高,但催化作用受影响,450℃时,催化剂的催化效率最高,故不选C点; (4)利用反应放出的热量预热原料气;上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全. 解:(1)黄铁矿的主要成分是FeS2,在高温条件下与氧气反应,其反应的化学方程式为:4FeS2+11O24Fe2O3+8SO2; 故答案为:4FeS2+11O24Fe2O3+8SO2; (2)在催化氧化时必须进行除尘、洗涤、干燥,以达到除去砷、硒等化合物的效果,这些物质会使催化剂中毒,并且水蒸气在高温下与铁反应,对设备和生产有不良影响, 故答案为:除尘、水洗;砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响; (3)在反应2SO2+O2?2SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高. 故答案为:不选择B点,因为压强越大对设备的投资大,消耗的动能大,SO2原料的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压;不选择C点,因为温度越低,SO2转化率虽然更高,但催化作用受影响,450℃时,催化剂的催化效率最高,故不选C点; (4)在S02催化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,冷却生成气体,可起到充分利用能源的目的, 故答案为:利用反应放出的热量预热原料气;上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全. 17、答案:(1)增大反应物的接触面积,提高浸取速率和浸取率;(2)SiO2;CaSO4;Al(OH)3;(3)2;NH4F;生产过程中会产生污染环境的HF及NH3等;;(4)H2SO4;NH4Cl;(5)通入HCl使AlCl3.6H2O达到饱和,而Al2(SO4)3不饱和;(6) 使废弃固体资源化利用。 (1)粉煤灰研磨的目的增大反应物的接触面积,提高浸取速率和浸取率;(2)Al2O3能溶于酸生成硫酸铝,CaO与硫酸反应得到CaSO4,而SiO2不溶于酸,所以第1次过滤时滤渣的主要成分是SiO2和CaSO4;第3次过滤的滤渣是铝盐与氨气反应生成的Al(OH)3;(3)由图1知2小时时铝的浸取率最大,适宜的浸取时间为2h;由图2知 浸取率最高的是用NH4F作浸取剂时;用含氟的化合物作这种助溶剂的缺点是生产过程中会产生污染环境的HF及NH3等;(4)观察流程图流程中循环使用的物质有H2SO4和NH4Cl;(5)通入HCl使AlCl3.6H2O达到饱和,而Al2(SO4)3不饱和;(6) 用粉煤灰制取含铝化合物的主要意义是使废弃固体资源化利用。 18、答案:(1)废硫酸液滴直径越小裂解速率越快(其他合理答案也可) (2)2H2SO4(l)====2SO2(g)+O2(g)+2H2O(g) ΔH=+548 kJ·mol-1 (3)①向逆反应方向 ②A、C、D (4)SO2+H2O+Na2SO3====2NaHSO3 (5)SO2-2e-+2H2O====+ 4H+ 2SO2+O2+2H2O====2H2SO4 (1)由表中数据得出,废硫酸液滴直径越小,完全裂解所需时间越短,即裂解速率越快。 (2)由题目中H2SO4(l)SO3(g)+H2O(g) ΔH1=+176 kJ·mol-1① 2SO3(g) 2SO2(g)+ O2(g) ΔH2=+196 kJ·mol-1② ①×2+②得 2H2SO4(l)====2SO2(g)+O2(g)+2H2O(g) ΔH=ΔH1×2+ΔH2=+548 kJ·mol-1 (3)①再充入一定量气体时,c(SO2)=0.030 mol·L-1, c(O2)=0.160 mol·L-1,c(SO3)=0.030 mol·L-1, 则Q===L·mol-1>K, 故平衡向逆反应方向移动。 ②A项,平衡右移,SO2的物质的量减小;B项,保持温度和压强不变,再充入 3.0 mol N2,需要增大体积,SO2、O2、SO3的浓度均降低,相当于减压,故平衡左移; C项,平衡右移;D项,加压,平衡右移。 (4)化学反应方程式为:SO2+H2O+Na2SO3====2NaHSO3。 (5)阳极反应失去电子,故电极反应式为:SO2+2H2O-2e-====+4H+ 阴极反应得到电子,电极反应式为:O2+2H2O+4e-====4OH-,由此得出总反应。 19、答案:(1)沸腾炉 4FeS2+11O22Fe2O3+8SO2 (2)D、E (3)16∶29 (1)“接触法”制硫酸的设备有沸腾炉、接触室和吸收塔。沸腾炉中发生的反应方程式为4FeS2+11O28SO2+2Fe2O3,接触室中的反应方程式为2SO2+O22SO3,吸收塔中的方程式为SO3+H2O====H2SO4。 (2)由于SO3与水反应时易形成酸雾,所以常用98.3%的浓硫酸作吸收剂。由于SO2氧化成SO3为放热反应,升高温度有利于提高化学反应速率,不利于提高SO2转化率,接触室中的热交换器是将SO2氧化成SO3放出的热量来预热SO2,实现能量的充分利用。 (3)发生反应的方程式为2SO2+O2+2H2O====2H2SO4,设通入SO2与水的质量比为x∶y,则反应后生成的H2SO4与H2O的质量比一定为1∶1,则,整理得。 20、答案:(1)反应物 溶剂 SiO2+4HF=SiF4↑+2H2O NaHCO3 (2)PF5+4H2O=H3PO4+5HF (3)过滤 冷凝 (4) (本题部分小题属于开放试题,合理答案均可) (1)根据题目中的流程可以看出,固体+液体反应新物质+饱和溶液,所以无水HF的作用是反应物和溶剂;玻璃的主要成分中含有二氧化硅,能和HF发生反应,反应的方程式为SiO2+4HF=SiF4↑+2H2O;HF属于弱酸,必须用弱碱性溶液来除去(比如2%的NaHCO3溶液); (2)根据题目中的信息“PF5极易水解,其产物为两种酸”,则根据元素组成可知,两种酸分别是H3PO4和HF,所以反应的方程式为PF5+4H2O=H3PO4+5HF; (3)第④步分离的是固体(LiPF4(s))和液体(HF(l)),所以采用过滤的方法;分离尾气中HF、HCl,可以利用二者沸点的差异(HF分子之间存在氢键)进行分离,所以采用冷凝法; (4)根据守恒可以得到;设LiPF6为xmol,LiF为ymol;根据Li守恒,有x+y=n,根据质量守恒有152x+26y=w,解得x=mol。 查看更多