- 2021-07-05 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年广东省揭阳市第三中学高二上学期第一次月考化学试题 解析版
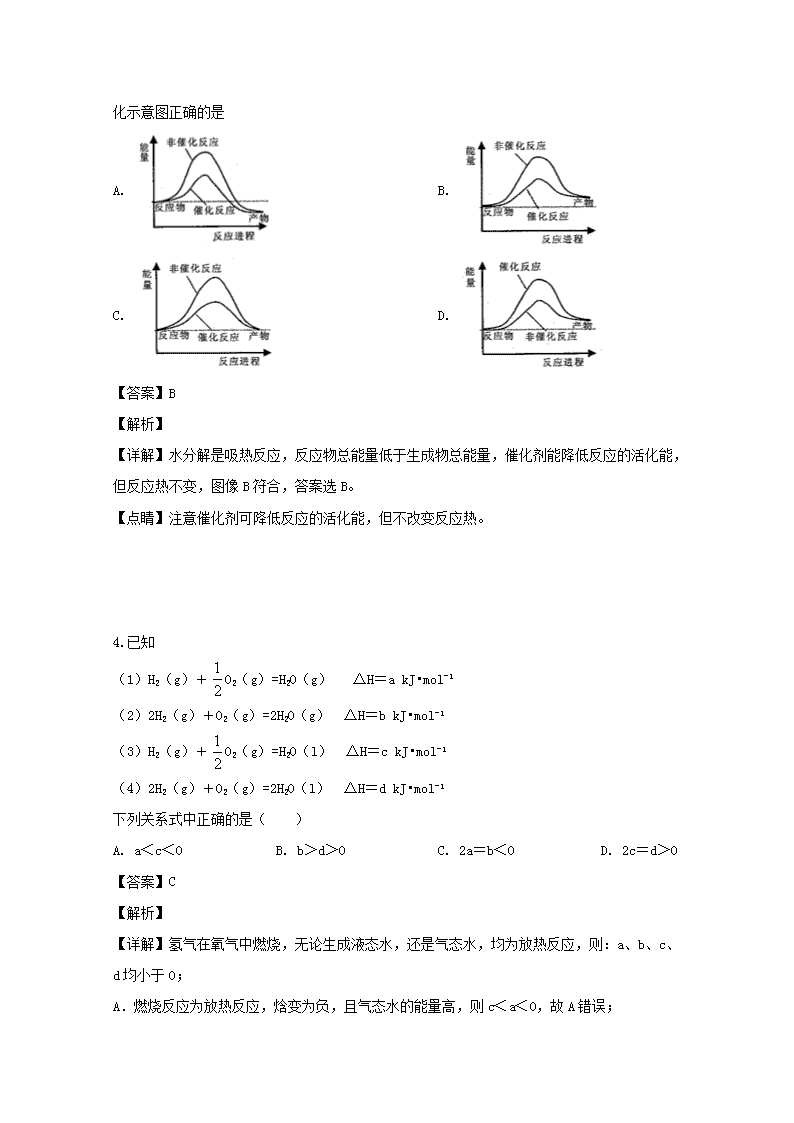
揭阳三中2019―2020学年度第一学期高二级第1次月考化学试题 可能用到的相对原子质量:O 16 H 1 S 32 C 12 一、选择题:(42分)本题共14小题,每小题3分。在每小题给出的四个选项中,只有一个选项符合题目要求。 1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是 ①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦氢能 A. ①②③④ B. ②③⑥⑦ C. ①②⑤⑥⑦ D. ③④⑤⑥⑦ 【答案】B 【解析】 【分析】 新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且可以再生。 【详解】天然气、石油、煤是不可再生能源,能引起严重的空气污染,不是新能源;太阳能、风能、生物质能、氢能对环境污染小,属于对环境友好型的新能源,故选B。 【点睛】本题考查了新能源,注意新能源的特征及开发利用是解答关键。 2. 下列变化属于吸热反应的是( ) ①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰 A. ①④⑤ B. ①②④ C. ②③ D. ②④ 【答案】D 【解析】 试题分析:①液态水气化属于物理变化,属于吸热过程,故错误;②此反应是吸热反应,故正确;③浓硫酸稀释,是放热过程,故错误;④氯酸钾分解属于分解反应,属于吸热反应,故正确;⑤生石灰与水反应生成熟石灰,是放热反应,故错误;综上所述,选项D正确。 考点:考查吸热反应和放热反应等知识。 3.据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 A. B. C. D. 【答案】B 【解析】 【详解】水分解是吸热反应,反应物总能量低于生成物总能量,催化剂能降低反应的活化能,但反应热不变,图像B符合,答案选B。 【点睛】注意催化剂可降低反应的活化能,但不改变反应热。 4.已知 (1)H2(g)+O2(g)=H2O(g) ΔH=a kJ•mol-1 (2)2H2(g)+O2(g)=2H2O(g) ΔH=b kJ•mol-1 (3)H2(g)+O2(g)=H2O(l) ΔH=c kJ•mol-1 (4)2H2(g)+O2(g)=2H2O(l) ΔH=d kJ•mol-1 下列关系式中正确的是( ) A. a<c<0 B. b>d>0 C. 2a=b<0 D. 2c=d>0 【答案】C 【解析】 【详解】氢气在氧气中燃烧,无论生成液态水,还是气态水,均为放热反应,则:a、b、c、d均小于0; A.燃烧反应为放热反应,焓变为负,且气态水的能量高,则c<a<0,故A错误; B.反应物相同,生成物中气态水的能量高,则d<b<0,故B错误; C.物质的量与热量成正比,则2a=b<0,故C正确; D.物质的量与热量成正比,且燃烧反应的焓变为负,则2c=d<0,故D错误; 故答案为C。 5.升高温度能使反应速率加快,下列叙述正确的是( ) A. 降低反应所需的活化能 B. 对于吸热反应、放热反应,反应速率同等程度加大 C. 体系中活化分子总数不变 D. 使反应体系的活化分子百分数增大 【答案】D 【解析】 【详解】升高温度,增大活化分子的百分数,体系内活化分子总数增多,有效碰撞次数增多,反应速率增大,对于吸热反应、放热反应,升高温度,正逆反应速率都增大,但正逆反应增大的程度不同,故答案为D。 6.已知化学反应A2(g)+B2(g)=2AB(s)的能量变化如图所示,下列叙述正确的是 A. 该反应为放热反应 B. A—B的键能为bkJ•mol-1 C. 加催化剂能降低该反应焓变 D. 该反应的反应热为△H=(a-b)kJ•mol-1 【答案】D 【解析】 A.由图像可以看出,生成物的总能量大于反应物的总能量,该反应为吸热反应,故A错误;B.键能是指断裂或形成1mol化学键吸收或放出的能量,则A-B的键能为kJ•mol-1,故B错误;C.加入催化剂只能改变化学反应速率,不能改变平衡,即该反应焓变不变,故C错误;D.该反应的反应热△H=断裂化学键吸收的能量—形成化学键所放出的能量,所以反应热为△H=+(a-b)kJ/mol,故D正确;故选D。 7.在2A(g)+B(g)3C(g)+4D(g)反应中,表示该反应速率最快的是 A. v(A)=0.5mol/(L·s) B. v(B)=0.3mol/(L·s) C. v(C)=0.8mol/(L·s) D. v(D)=1.0mol/(L·s) 【答案】B 【解析】 【分析】 用不同物质的反应速率比较反应的快慢时,把反应速率的单位变成相同,再把各物质的反应速率除以本身的化学计量数,得到的速率越大反应就越快。 【详解】A、v(B)=v(A)==0.25mol/(L·s); B、v(B)=0.3mol/(L·s); C、v(B)=v(C)==0.27mol/(L·s); D、v(B)=v(D)==0.25mol/(L·s); 可以看出B中的数据最大,反应也速率就最快,选B。 8.下列反应既属于离子反应,又属于氧化还原反应的放热反应是( ) A. 铝片与稀盐酸反应 B. 灼热的碳与CO2反应 C. Ba(OH)2·8H2O与NH4Cl固体反应 D. 甲烷在氧气中的燃烧反应 【答案】A 【解析】 离子反应是有离子参加或生成的反应,A、C为离子反应;有化合价变化的反应为氧化还原反应,A、B、D为氧化还原反应,灼热的碳与CO2反应和Ba(OH)2·8H2O与NH4 Cl固体反应是吸热反应,综合分析符合题意的是A选项。A正确。 9.已知4NH3+5O2=4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) 表示。则正确的关系是( ) A. 4/5υ(NH3)=υ(O2) B. 5/6υ(O2)=υ(H2O) C. 2/3υ(NH3)=υ(H2O) D. 4/5υ(O2)=υ(NO) 【答案】D 【解析】 【详解】化学计量数之比等于化学反应速率之比,则υ(NH3):υ(O2):υ(NO):υ(H2O)=4:5:4:6,即υ(NH3)=υ(O2)、υ(O2)=υ(H2O)、υ(NH3)=υ(H2O)、υ(O2)=υ(NO),故答案为D。 10.反应4A(s)+3B(g)2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是 A. 用A表示的反应速率是0.4 mol/(L·min) B. 分别用B、C、D表示反应速率其比值是3:2:1 C. 在2min末的反应速率,用B表示是0.3mol/(L·min) D. 在这2min内用B和C表示的反应速率的值都是逐渐减小的 【答案】BD 【解析】 【详解】A.A是固体,不能利用浓度变化量表示反应速率,A错误; B.速率之比等于化学计量数之比,故υ(B):υ(C):υ(D)=3:2:1,B正确; C.2min内,B的浓度减少0.6mol/L,υ(B)==0.3mol/(L·min),但化学反应速率是2min内的平均速率,不是瞬时速率,C错误; D.由于反应物的浓度随着反应的进行逐渐减小,物质的浓度降低,反应速率减小,所以反应速率的值都是随时间逐渐减小的,D正确; 故合理选项是BD。 11.用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是 A. EF段,用盐酸表示该反应平均反应速率为0.4 mol·(L·min) -1 B. OE段表示的平均速率最快 C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 D. F点收集到的CO2的量最多 【答案】A 【解析】 A、EF段产生的CO2共0.02 mol,由于反应中n(HCl)∶n(CO2)=2∶1,所以该段消耗HCl=0.04 mol,时间1 min,所以用盐酸表示的EF段平均化学速率是0.4 mol·L-1·min-1,A正确;B、单位时间内反应生成的多或反应物消耗的多,则速率快。由于横坐标都是1个单位,EF段产生的CO2多,所以该段反应速率最快,不是OE段,B错误;C、由于时间都是1 min,所以三段的速率之比就等于产生CO2的体积之比,即224∶(672-224)∶(784-672)=2∶4∶1,C错误;D、收集的CO2是看总量的,F点只有672 mL,应该是G点的体积最多,D错误,答案选A。 12.一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是 ①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 A. ①②⑤ B. ①③⑤ C. ③④⑤ D. ①③④ 【答案】B 【解析】 考查外界条件对反应速率对影响。石墨能和锌构成原电池,锌是负极,加快反应速率,①正确。氧化铜溶于盐酸生成氯化铜,进而和锌发生置换反应,生成铜,也构成原电池,加快反应速率,但生成的氢气减少,②不正确,同样可知③正确。铁能和盐酸反应产生氢气,④不正确。增大氢离子浓度,反应速率增大,⑤正确,答案选B。 13.下列描述中正确的是( ) A. HCl与NaOH反应中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol C. 需要加热才能发生的反应一定是吸热反应 D. 燃烧热是指1mol物质完全燃烧时放出的热量 【答案】B 【解析】 【详解】A.中和热是指酸和碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,稀溶液中强酸与强碱反应生成1mol水时的中和热为57.3kJ/mol,且稀H2SO4和Ca(OH)2反应生成的CaSO4微溶于水,故A错误; B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,CO(g)的燃烧热是283.0kJ/mol,则CO燃烧热表示的热化学方程式为:CO(g)+O2(g)═CO2 (g)△H=-283.0 kJ/mol;所以2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol,故B正确; C.某些放热反应需要加热引发条件才能进行如铝热反应等,需要加热的反应不一定是吸热反应,故C错误; D.燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所释放的热量,故D错误; 故答案为B。 【点睛】考查燃烧热、中和热概念的理解应用,方程式书写方法,注意概念的条件和实质分析。中和热是酸与碱完全反应生成1mol水放出的热量;燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,反应焓变符号随之变化;加热发生的反应不一定是吸热反应,某些放热反应也需要引发条件。 14.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g) +B(g)2C(g),2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( ) A. 用物质A表示的反应平均速率为0.6 mol·L-1·s-1 B. 用物质B表示的反应的平均速率为0.3 mol·L-1·s-1 C. 2 s时物质A的转化率为30% D. 2 s时物质B的浓度为0.8mol·L-1 【答案】C 【解析】 【详解】A.根据方程式知,△c(A)=△c(C)=0.6mol/L,则A的平均反应速率为:=0.3mol/(L·s),故A错误; B.△c(B)=×0.6mol/L=0.3mol/L,υ(B)==0.15mol/(L·s),故B错误; C.A的起始浓度是2mol/L,根据方程式知,△c(A)=△c(C)=0.6mol/L,故A的转化率=×100%=30%,故C正确; D.B的起始浓度是1mol/L,根据方程式知,△c(B)=×0.6mol/L=0.3mol/L,2s时物质B的浓度为:1mol/L-0.3mol/L=0.7 mol/L,故D错误; 故答案为C。 二 非选择题(共58分) 15.用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题: (1)烧杯间填满碎泡沫塑料的作用是_________; (2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________ (3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”); (4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。 (5)倒入NaOH溶液的正确操作是 _________ A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入 (6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。 a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度; c.量取NaOH溶液的体积时仰视读数; d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。 【答案】 (1). 减少热量损失 (2). 不能 (3). 铁会和盐酸反应;铁导热性好,热量损失较大 (4). 为了确保盐酸完全被中和 (5). 不相等 (6). 相等 (7). NaOH(aq)+HCl(aq)= NaCl(aq)+ H2O (l) ΔH=-57.3 kJ/mol (8). C (9). abcd 【解析】 分析】 (1)中和热测定实验成败的关键是保温工作; (2)铁是热的良导体,易传热,且铁能与盐酸反应; (3)氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,结合中和热的概念和实质来回答; (4)根据稀强酸与稀强碱中和生成1mol液态水时放出57.3kJ的热量书写热化学方程式; (5)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果; (6)从对热量的影响分析即可。 【详解】(1)中和热测定实验成败的关键是保温工作,烧杯间填满碎泡沫塑料的作用是:减少实验过程中的热量损失; (2)铁是热的良导体,易传热,热量散失较大,实验测得误差较大,且铁能与盐酸反应; (3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增多,但是中和热是以强酸和强碱反应生成1mol水时放出的热为标准,与酸碱的用量无关; (4)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,盐酸和氢氧化钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O (l)△H=-57.3 kJ/mol; (5)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故答案为C; (6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a符合题意; b.温度计测定NaOH溶液起始温度后直接插入稀HCl测温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故b符合题意; c.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量不变,但温度差偏小,中和热的数值偏小,故c符合题意; d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小,故d符合题意; 故答案为:abcd。 16.I 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。 (1)由图中数据分析:该反应的化学方程式为_________________。 (2)反应开始至2min,用Z表示的平均反应速率为________。用X表示的平均反应速率为___________________ II 对于可逆反应CO(g)+H2O (g) CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题: ①恒温恒压时,向容器中充入0.5mol的He,这时反应速率___________(填“加快”、“减慢”或 “不变”),原因是____________________ ②恒温恒容时,加入0.3mol的CO,这时反应速率___________(填“加快”、“减慢”或 “不变”),原因是_______________ 【答案】 (1). 3X+Y2Z (2). 0.05mol·L-1·min-1 (3). 0.075 mol·L-1·min-1 (4). 减慢 (5). 恒温恒压时充入He,体系体积增大反应物浓度减小,反应速率减慢 (6). 加快 (7). 恒温恒容充入0.3molCO,反应物CO的浓度增大反应速率加快 【解析】 【分析】 I.(1)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断; (2)根据υ==计算;再根据同一反应、同一时间段内,各物质反应速率之比等于其计量数之比判断; II.①恒温恒压时,向容器中充入0.5mol的He,总体积增大,反应物浓度减小; ②恒温恒容时,加入0.3mol的CO,CO为反应物,且浓度增大。 【详解】I.(1)根据图象知,随着反应的进行,X、Y的物质的量减少,Z的物质的量增加,所以X、Y是反应物,Z是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0~2min时,△n(X)=(1-0.7)mol=0.3mol,△n(Y)=(1-0.9)mol=0.1mol,△n(Z)=0.2mol-0=0.2mol,△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,故该反应的化学方程式为3X+Y2Z; (2)υ(Z)====0.05mol•L-1•min-1;同一反应、同一时间段内,各物质反应速率之比等于其计量数之比,所以υ(Z):υ(X)=0.05mol•L-1•min-1:υ(X)=2:3,υ(X)=0.075mol•L-1•min-1; II.:①恒温恒压时,向容器中充入0.5mol的He,总体积增大,反应物浓度减小,则反应速率减慢; ②恒温恒容时,加入0.3mol的CO,CO为反应物,CO浓度增大,则反应速率加快。 【点睛】图象问题解题步骤:(1)看懂图象:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图象中有关量的多少;(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。 17. 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源. (1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。 (2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. 已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol, E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________ (3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知: 2Cu(s)+O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1, C(s)+O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1, 2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1 则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。 (4)如图是N2和H2反应生成2molNH3过程中能量变化示意图: ①请计算每生成1molNH3放出热量为:_________. ②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________. 【答案】(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-704kJ·mol.-1 (2)434kJ/mol (3)C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJ·mol.-1 (4)46.1kJ;18.44 【解析】 试题分析:(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=-704KJ/mol; (2)H2(g)+Cl2 (g)═2HCl(g)△H=-185kJ/mol,E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol,△H=反应物键能总和-生成物键能总和得到:-185kJ/mol=436KJ/mol+243KJ/mol-2E(H-Cl),则E(H-Cl)=432kJ/mol;故答案为:432kJ/mol; (3)①2Cu(s)+O2(g)═Cu2O(s)△H=-169kJ•mol-1, ②C(s)+O2(g)═CO(g)△H=-110.5kJ•mol-1, ③2Cu(s)+O2(g)═2CuO(s)△H=-314kJ•mol-1, 依据盖斯定律②+①-③得到C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol; 则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol; (4)①图象分析可知,N2和H2反应生成2molNH3过程中能量变化示意图可知反应放热427.2KJ-335KJ=92.2KJ,每生成1molNH3放出热量46.1KJ;故答案为:46.1kJ; ②如图是N2和H2反应生成2molNH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol, N2(g)+3H2(g)2NH3(g)△H=-92.2KJ/mol 1 30 0.2 0.6 0.4 生成0.4mol氨气放热=×92,2KJ=18.44KJ,故答案为:18.44。 考点:考查了热化学方程式书写方法和盖斯定律的计算的相关知识。 18.某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽。 物理量 编号 V(0.20 mol/L H2C2O4溶液)/mL V(蒸馏水)/mL V(0.010 mol/L酸性KMnO4溶液)/mL m(MnSO4)/g T/℃ 乙 ① 2.0 0 4.0 0 50 ② 2.0 0 4.0 0 25 ③ 1.5 a 4.0 0 25 ④ 2.0 0 4.0 0.1 25 回答下列问题: (1)KMnO4溶液用_______酸化(填名称);写出上述反应的离子方程式:__________; (2)上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究__________对化学反应速率的影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是__________________。 (3)已知实验①50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO4-)~t的变化曲线示意图。____________________ 【答案】 (1). 硫酸 (2). 2MnO4- + 5H2C2O4 + 6H+= 2Mn2+ + 10CO2↑ + 8H2O (3). 温度 (4). 催化剂 (5). 0.5 (6). 酸性KMnO4溶液褪色时间 (7). 【解析】 【分析】 (1)酸性的KMnO4溶液有强氧化,不能选择还原性的酸酸化;H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水; (2)实验①②是在相同浓度,不使用催化剂,不同温度下进行的实验探究;而实验②④是在相同浓度、相同温度,是否使用催化剂条件下进行的实验探究;上述实验②③是探究浓度对化学反应速率的影响,则混合液的总体积必须相同;反应速率需要通过时间的快慢来体现; (3)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图。 【详解】(1)酸性的KMnO4溶液有强氧化,不能选择还原性的酸酸化,也不能选择强氧化性的酸如硝酸酸化,只能选择稀硫酸酸化;H2C2O4溶液和酸性KMnO4溶液反应生成二氧化碳、锰离子和水,则反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。 (2)实验①②是在相同浓度,不使用催化剂的条件下进行的,但反应温度不同,则为探究温度对速率的影响;而实验②④是在相同浓度、相同温度的条件下进行的,但②不使用催化剂,而④使用催化剂,则为探究催化剂对反应速率的影响;上述实验②③是探究浓度对化学反应速率的影响,则混合液的总体积必须相同,实验②溶液总体积为6mL,则实验③中所需水的体积a=6mL-1.5mL-4.0mL=0.5mL;反应速率需要通过时间的快慢来体现,则乙中需要测量的是KMnO4溶液褪色所需时间; (3)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为:。 查看更多