- 2021-07-05 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】江西省奉新县第一中学2019-2020学年高一上学期第一次月考试题(解析版)
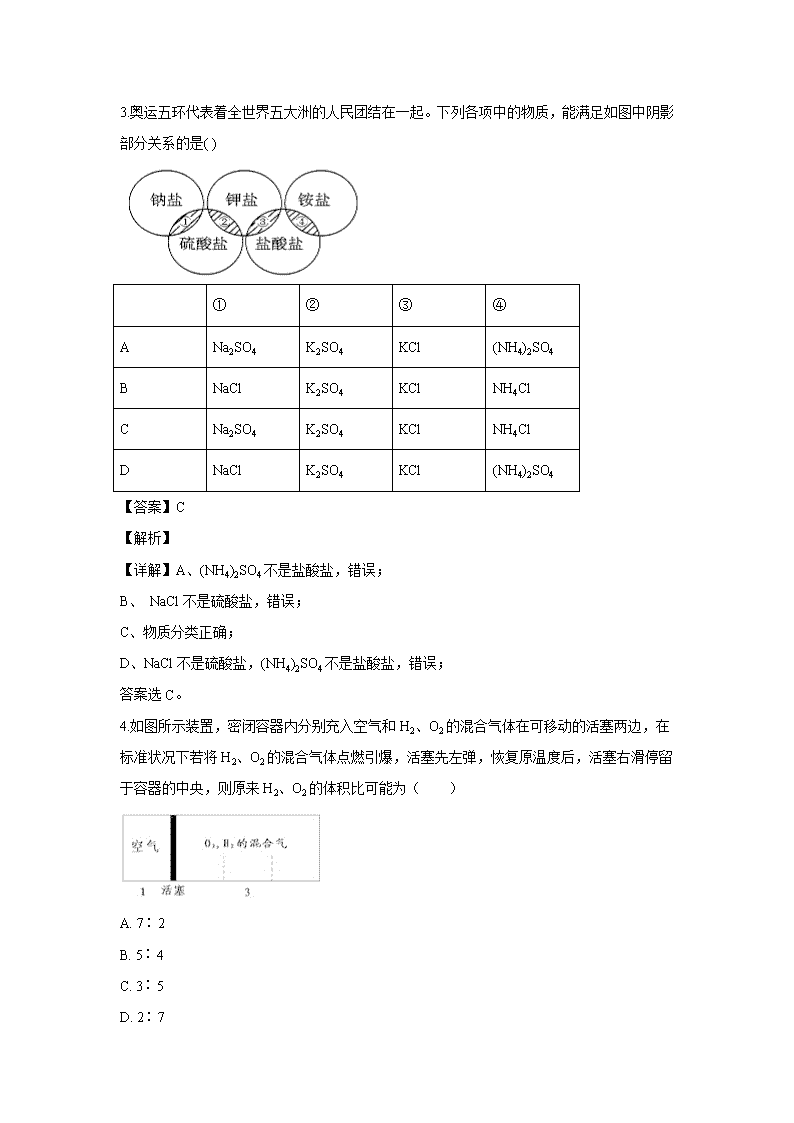
江西省奉新县第一中学2019-2020学年高一上学期第一次月考试题 1.下列叙述中正确的是( ) A. 摩尔是物质的量的单位,每摩尔物质含有6.02×1023个分子 B. 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA C. 22.4L升的O2约含1.204×1024个O原子 D. 0.5 mol He约含有6.02×1023个电子 【答案】D 【解析】 【详解】A.有的物质由分子构成如氧气等,有的物质由原子构成如二氧化硅等,有的物质由离子构成如氯化钠等,物质并不都是由分子构成,故A错误; B.没有指明气体存在的状态,不一定是标况下,CO和CO2的混合气体的总量不一定为1mol,所含的碳原子数不一定是NA,故B错误; C.没有指明气体存在的状态,不一定是标况下,22.4L升的O2的量不一定是1mol,故C错误; D.He原子的核电荷数为2,核外电子数为2,0.5 mol He约含有6.02×1023个电子,故D正确; 故答案选D。 2.在含有MgCl2、KCl、Na2SO4 3种物质的混合溶液中,已知c(Cl-)=2.5mol·L-1, c(K+)+c(Na+)=1.5mol·L-1 ,c(SO42-)=0.5mol·L-1,则c(Mg2+)应是( ) A. 1mol·L-1 B. 1.5mol·L-1 C. 2mol·L-1 D. 0.5 mol·L-1 【答案】A 【解析】 【分析】混合液呈中性,根据电荷守恒:c(Cl-)+2c(SO42-)= c(K+)+c(Na+)+2c(Mg2+),据此进行计算。 【详解】溶液中存在c(Cl-)+2c(SO42-)= c(K+)+c(Na+)+ 2c(Mg2+),2c(Mg2+)= c(Cl-)+2 c(SO42-)-c(K+)-c(Na+)=2.5mol·L-1-2×0.5mol·L-1-1.5mol·L-1=2mol·L-1,所以c(Mg2+)=1mol·L-1,故A正确; 故答案选A。 3.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( ) ① ② ③ ④ A Na2SO4 K2SO4 KCl (NH4)2SO4 B NaCl K2SO4 KCl NH4Cl C Na2SO4 K2SO4 KCl NH4Cl D NaCl K2SO4 KCl (NH4)2SO4 【答案】C 【解析】 【详解】A、(NH4)2SO4不是盐酸盐,错误; B、 NaCl不是硫酸盐,错误; C、物质分类正确; D、NaCl不是硫酸盐,(NH4)2SO4不是盐酸盐,错误; 答案选C。 4.如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( ) A. 7∶2 B. 5∶4 C. 3∶5 D. 2∶7 【答案】A 【解析】 【详解】反应前左右压强都相等,气体的物质的量之比等于体积之比,令空气的物质的量为1mol,则氢气、氧气的混合气体为3mol。反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中剩余气体为1mol;若剩余的气体为H2,参加反应气体共2mol,由可知,O2有2mol×=mol,故H2有3mol-mol=mol,故H2、O2的体积比7:2;若剩余的气体为O2,参加反应气体共2mol,H2有2mol×=mol,故O2有3mol-mol =mol,故H2、O2的体积比4:5;故答案选A。 5.两份体积相同的某植物营养液,其配方如下: 成分 含量 编号 KCl K2SO4 ZnSO4 ZnCl2 ① 0.3mol 0.2mol 0.1mol — ② 0.1mol 0.3mol — 0.1mol 两份营养液的成分( ) A. 完全不同 B. n(Cl-)相同 C. n(K+)相同 D. 完全相同 【答案】D 【解析】 【分析】根据两种溶液中各种离子的物质的量是否相等判断两种溶液的成分是否相同,如果两种溶液中各种离子的物质的量都相等,则两种溶液的成分相同。 【详解】根据表中数据可知 ①中n(K+)=0.3mol+0.2mol×2=0.7mol,n(SO42-)=0.2mol+0.1mol=0.3mol,n(Zn2+)=0.1 mol,n(Cl-)=0.3 mol; ②中n(K+)=0.1mol+0.3mol×2=0.7mol,n(SO42-)=0.3mol,n(Zn2+)=0.1 mol,n(Cl-)=0.1mol+0.1mol×2=0.3 mol。 所以①和②中各种离子的物质的量分别都相等,所以成分相同,答案选D。 6.质量相同的N2和CO,下列物理量不一定相同的是( ) A. 物质的量 B. 分子个数 C. 原子个数 D. 气体体积 【答案】D 【解析】 【详解】A、N2和CO的摩尔质量相等,则质量相同时,物质的量也相同,即不符合题意,故错误; B、物质的量和分子个数成正比,物质的量相等,则分子个数也相等,即不符合题意,故错误; C、都属于双原子分子,物质的量又相等,则原子个数也相等,即不符合题意,故错误; D、气体体积受温度和压强的影响,题目中没有说明是否是在同一条件下,因此气体体积不一定相等,符合题意,故正确。 答案选D。 7.下列实验操作中正确的是( ) A. 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释 B. 碱性氧化物一定是金属氧化物,酸性氧化物也可能是金属氧化物 C. 用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中 D. 称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘 【答案】B 【解析】 【详解】A.量筒为流量式量器,倒出来的液体体积就是所需要的体积,若洗涤量筒,会造成溶质硫酸的物质的量增大,所配溶液浓度可能偏高,故A错误; B.Mn2O7是金属氧化物,属于酸性氧化物,所有碱性氧化物一定是金属氧化物,故B正确; C.如果胶头滴管伸入试管内,胶头滴管可能接触试管壁,会造成药品的污染,故C错误; D.氢氧化钠易潮解有强腐蚀性,氢氧化钠吸水易潮解,会粘到纸上,造成氢氧化钠损失,故固体氢氧化钠时要用容器盛装才能称量,故D错误; 故答案选B。 8.实验中需0.1mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别是( ) A. 1000mL,5.85g B. 950mL,5.6g C. 1000mL,5.9g D. 500mL,2.8g 【答案】C 【解析】 【详解】容量瓶的规格有:100mL、250mL、500mL、1000 mL;容量瓶的选择原则是“近而大”,无950mL容量瓶,应选择1000mL的容量瓶;天平的精确度为0.1g,根据m=cVM可知,NaCl的质量为m=0.1mol/L×1L×58.5g/mol=5.9g;故C正确; 故答案选C。 9.若50滴水正好是1mL,水的密度为1g/mL,则1滴水所含的水分子数是( ) A. B. C. D. 【答案】C 【解析】 【分析】要求出1滴水所含的分子数,先要知道一个水分子的质量,再根据1mol水中所含的分子数和一个水分子的质量可求出1滴水所含的分子数。 【详解】1滴水的体积1/50mL,则1滴水的质量=1g/mL×1/50mL=1/50g;1滴水的物质的量n=1/50g/18g/mol=1/(50×18)mol,1滴水所含的水分子数N=nNA=6.02×1023×1/(50×18)mol=6.02×1023/(50×18),故C正确; 答案选C。 10.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( ) A. 密度比为16∶11 B. 密度比为11∶16 C. 体积比为16∶11 D. 原子数比为1∶1 【答案】A 【解析】 【详解】质量相等的二氧化硫与二氧化碳的物质的量之比是1/64:1/44=11:16,同温同压下,体积之比是11:16,所以密度之比是体积的反比是16:11,二者都是三原子分子,所以原子数之比是物质的量之比是11:16,所以答案选A。 11.将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物的量浓度是( )mol·L-1 A. 1000ab/(22400+36.5a) B. ab/(22400+36.5a) C. 1000ab/(22.4+36.5a) D. 1000ab/(22400+36.5) 【答案】A 【解析】 【分析】先根据n=V÷Vm计算HCl的物质的量,由m=n×M计算HCl的质量,溶液质量=水的质量+HCl的质量,结合溶液密度求出溶液的体积,再根据c=n÷V计算盐酸的物质的量浓度。 【详解】标准状况下a L HCl(g)的物质的量为=mol,氯化氢的质量为mol×36.5g/mol=g,则溶液的质量为1000g+g=(1000+)g,溶液的体积为=cm-3=×10-3L,所以溶液的物质的量浓度为=mol/L,故答案选A。 12.NA表示阿伏加德罗常数,下列说法不正确的是( ) A. H2SO4摩尔质量(g/mol)与NA个硫酸分子的质量(g)在数值上相等 B. 28 g氮气所含原子数目为NA C. 在常温常压下, NA个氯气分子质量为71g D. NA个氧气分子和NA个氮气分子的质量比为8∶7 【答案】B 【解析】 【详解】A.硫酸的摩尔质量为98g/mol,而NA个硫酸分子即1mol,硫酸的质量m=nM=1mol×98g/mol=98g,两者在数值上相同,故A正确; B.根据n=m/M=28g/28g/mol=1mol,而氮气由2个氮原子构成,所以1mol氮气所含原子数目为2NA,故B错误; C.在常温常压下, NA个氯气分子的物质的量为1mol,氯气的摩尔质量71g/mol,所以1mol了氯气的质量为71g,故C正确; D. NA个氧气分子和NA 个氮气分子的物质的量均为1mol,而当物质的量相同时,质量之比等于摩尔质量之比,故两者的质量之比为32:28=8:7,故D正确; 故答案选B。 13.选取萃取剂将溴水中的溴萃取出来,这种萃取剂必须具备的性质是 ( ) A. 不溶于水,但必须与溴发生反应 B. 不溶于水,但比水更容易溶解溴 C. 不溶于水,且密度必须比水大 D. 不溶于水,且密度必须比水小 【答案】B 【解析】 【分析】依据萃取剂的选择原则作答。 【详解】选取萃取剂将溴水中的溴萃取出来,这种萃取剂必须具备的性质是不溶于水,但比水更容易溶解溴,且不能发生反应,但与萃取剂的密度无关,B项正确; 答案选B。 14.在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量是( ) A. 16 B. 32 C. 64 D. 128 【答案】C 【解析】 【详解】设瓶子的质量为x,气体A的摩尔质量为y,同一瓶子的体积相等,由阿伏加德罗定律可知,在相同状况下,O2、CO2与气体A的物质的量也相等,则由n=m/M可知,(36g—x)÷32g/mol=(42g—x)÷44g/mol,解得:x=20g,故(36g—20g)÷32g/mol=(52g−20g)÷y,解得:y=64g•mol-1,摩尔质量与相对分子质量数值相等,所以气体A的相对分子质量是64,故答案为C项。 15.下列各组微粒,在溶液中能大量共存的是( ) A. K+、H+、NO3-、Cl- B. K+、H+ 、Cl-、HCO3-、SO42- C. H+、Na+、CO32-、Cl- D. Ca2+、Cl-、K+、CO32- 【答案】A 【解析】 【分析】如果离子之间结合生成水、气体、沉淀、弱电解质等,则不能共存,以此来解答。 【详解】A.该组离子之间不反应,能大量共存,故A正确; B.因H+ 与HCO3-结合生成水和气体,则不能大量共存,故B错误; C.因H+ 与CO32-结合生成水和气体,则不能大量共存,故C错误; D.因Ca2+与CO32-结合生成沉淀,则不能大量共存,故D错误; 故答案选A。 16.下列溶液中的Cl-浓度与50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是( ) A. 100 mL 1 mol·L-1 NaCl溶液 B. 75 mL 2 mol·L-1 CaCl2溶液 C. 25mL 2 mol·L-1 AlCl3溶液 D. 1500 mL 2 mol·L-1 KCl溶液 【答案】D 【解析】 【详解】50 mL 1 mol·L-1 MgCl2溶液中的c(Cl-)=1 mol·L-1×2=2 mol·L-1; A. 100 mL 1 mol·L-1 NaCl溶液中c(Cl-)=1 mol·L-1×1=1 mol·L-1,与2 mol·L-1不符,故A错误; B. 75 mL 2 mol·L-1 CaCl2溶液中c(Cl-)=2mol·L-1×2=4 mol·L-1,与2 mol·L-1不符,故B错误; C. 25mL 2 mol·L-1 AlCl3溶液中c(Cl-)=2mol·L-1×3=6mol·L-1,与2 mol·L-1不符,故C错误; D. 1500 mL 2 mol·L-1 KCl溶液中c(Cl-)=2mol·L-1×1=2mol·L-1,与题给条件相符,故D正确; 故答案选D。 17.(1)现有下列10种物质:①H2O、②空气、③Mg、④CaO、⑤KOH、⑥NH3·H2O、⑦CuSO4·5H2O、⑧碘酒、⑨C2H5OH和⑩NaHCO3。 其中,属于混合物的是______________(填序号,下同);属于碱的是______________;属于盐的是______________。 (2)标准状况下,①4 g氢气、②33.6 L CH4、③6.02×1023个水分子中,含分子数最多的是________,含原子数最多的是__________ 。 【答案】(1). ②⑧ (2). ⑤⑥ (3). ⑦⑩ (4). ① (5). ② 【解析】 【分析】(1)混合物是由两种或两种以上不同物质组成的物质;碱是电离产生的阴离子全部为氢氧根离子的化合物;盐是由金属离子和酸根离子组成的化合物;根据以上分析解答。 (2)根据n=m/M=V/Vm=N/NA进行计算。 【详解】(1)①H2O、④CaO由两种元素组成且其中一种是氧元素,属于氧化物;②空气、⑧碘酒由两种或两种以上不同物质组成的物质组成,为混合物;⑤KOH、⑥NH3·H2O电离出的阴离子全部是氢氧根离子,属于碱;⑦CuSO4·5H2O、⑩NaHCO3 在溶液中电离出的阳离子为金属离子,阴离子为酸根离子,属于盐;⑨C2H5OH是含碳化合物,属于有机物;其中,属于混合物的是②⑧;属于碱的是⑤⑥;属于盐的是⑦⑩; 故答案是:②⑧;⑤⑥; ⑦⑩; (2)①4 g氢气的物质的量=4g/2g/mol=2mol;②33.6 L CH4的物质的量=33.6 L/22.4L/mol=1.5mol;③6.02×1023个H2O分子的物质的量为1mol;根据N=nNA可以知道,物质的量越大,含有分子数目越多,故①4 g氢气含有分子数目最多;氢气分子是由2个氢原子构成,所以2mol氢气分子所含原子数为2NA;CH4分子是由5个原子构成,所以1.5mol氢气分子所含原子数为1.5mol×5×NA=7.5 NA;H2O分子是由3个原子构成,所以1molH2O分子所含原子数为3 NA;故②33.6 L CH4分子含原子数最多; 故答案是: ①;②。 18.(1)与0.5NA个CH4分子含相同氢原子的HCl,在标准状况下的体积为________L; (2)标况下,需要460mL,1mol/L的H2SO4溶液,需量取________mL 密度为1.8g/mL, 质量分数为98%的H2SO4溶液来配制; 【答案】(1). 44.8 (2). 27.8 【解析】 【分析】(1)根据氢原子的物质的量守恒:n(CH4)×4=n(HCl)×1进行计算; (2)根据溶液稀释过程中溶质的量不变:c1V1=c2V2及c=1000×ρ×ω/M进行计算;容量瓶要选择500mL。 【详解】(1)0.5NA个CH4分子的物质的量为0.5mol;1个CH4分子中有4个H;设HCl的体积为VL,则根据氢原子的物质的量守恒可知:0.5mol×4=VL/22.4L/mol×1,计算出V= 44.8L;故答案是:44.8。 (2)实验室没有460mL容量瓶,只能选用500mL容量瓶;密度为1.8g/mL、质量分数为98%的H2SO4溶液的物质的量浓度c=1000×ρ×ω/M=1000×98%×1.8g/mL/98g/mol=18mol/L;根据溶液稀释过程中溶质的量不变可知,18mol/L×V=1mol/L×500,V≈27.8 mL; 故答案是:27.8。 19.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答: (1)从氯化钾溶液中得到氯化钾固体,选择装置_____(填代表装置图的字母,下同),除去自来水中的Cl-等杂质,选择装置______。 (2)从碘水中分离出I2,选择装置______,该分离方法的名称为______。 (3)装置A中①的名称是_______。进水的方向是从______口进水。 【答案】(1). D (2). A (3). B (4). 萃取 (5). 冷凝管 (6). 下 【解析】 【分析】 物质分离的方法有:过滤、分液、蒸发和蒸馏等,据此进行分析;根据实验选择合适的仪器以及使用方法。 【详解】(1)蒸发可以实现易溶于水固体和水的分离,从氯化钾溶液中得到氯化钾固体可用蒸发,因蒸馏可以实现水中难挥发性杂质和水的分离,则除去自来水中的Cl─等杂质,可用蒸馏;故答案为:D;A; (2)碘微溶于水,碘易溶于苯、四氯化碳等有机溶剂,且苯、四氯化碳与水互不相溶,可用萃取法分离;答案:B;萃取; (3)装置A中①的名称是冷凝管,使用时下口进水上口出水;故答案为:冷凝管;下。 20.由三个原子构成的某气体分子,其摩尔质量为M g/mol,该气体的体积为V L(标准状况),设阿伏加德罗常数的值为NA,则: ①该气体的物质的量为________ mol; ②该气体中所含的原子总数为________个; ③该气体在标准状况下密度为________g/L; ④该气体的一个分子的质量为________g。 【答案】(1). (2). (3). (4). 【解析】 【分析】根据n=m/M=V/Vm=N/NA及ρ=m/V进行相关计算。 【详解】①由n==V/Vm 可以知道,该气体的物质的量为n=VL/22.4L/mol=V/22.4mol; 答案是: V/22.4; ②因为一个分子中含3个原子,所以含有的原子数为分子数的3倍,由N=nNA可以知道,该气体中所含的原子总数为N=3NA×V/22.4mol=3NAV/22.4mol; 答案是: 3NAV/22.4; ③该气体的物质的量为n=VL/22.4L/mol=V/22.4mol,质量为m=nM=V/22.4mol×M g/mol=M/22.4g;由ρ=m/V可以知道,ρ=VM/22.4/V=M/22.4 g/L; 答案是: M/22.4; ④摩尔质量为M g/mol,NA个分子质量之和为M g,所以该气体的一个分子的质量为M/ NAg; 答案是: M/ NA。 21.实验室用氢氧化钠固体配制1.0 mol·L-1的NaOH溶液460 mL,回答下列问题: (1)所需仪器为:托盘天平、量筒、烧杯、玻璃棒、药匙,还需要哪些实验仪器才能完成该实验,请写出:___________________________。 (2)需称量NaOH的质量为 ___________g (3)下列操作对所配溶液的浓度有何影响?(填写字母),偏大的有___________;无影响的有______________。 A.将NaOH放在纸张上称量 B.称量时使用了生锈并脱落的砝码 C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 D.往容量瓶中移液时,有少量液体溅出 E.未洗涤溶解NaOH的烧杯 F.容量瓶瓶底有水即用来配制溶液 G.定容时俯视刻度线 H.定容后反复摇匀,静置后,发现液面不到刻度线,没有再加水至刻度线 (4)下列操作中,容量瓶所不具备的功能有________。 A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.用来加热溶解固体溶质 (5)用18mol/L的浓硫酸配制1mol/L的稀硫酸,操作可分解成如下几步,以下正确的操作顺序是__________________ A.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次,振荡 C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中 D.根据计算,用量筒量取一定体积的浓硫酸 E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌 F.盖上容量瓶塞子,摇匀 G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切 (6)含NA个电子的NH4+,质量为________g,23gNa+与_________molOH-所含电子数相同。 【答案】(1). 500mL容量瓶、胶头滴管 (2). 20.0g (3). CG (4). FH (5). BCD (6). DECBAGF (7). 1.8 (8). 1 【解析】 【分析】(1)根据容量瓶的结构进行分析使用的方法和注意事项;配制460 mL NaOH溶液,需要选用500mL容量瓶;根据m=nM计算出所需溶质的质量;配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500mL容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1-2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶;据以上分析进行操作步骤大排序和使用的仪器; 根据c=n/V进行实验误差的分析; (2)1个NH4+含有电子10个,含NA个电子的NH4+的物质的量为0.1mol,据m=nM进行计算;1个Na+含有电子数为10个,1个OH-含电子数为10个,据电子守恒列式进行计算。 【详解】(1)配制460 mL NaOH溶液,需要选用500mL容量瓶;配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500mL容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1-2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶;用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、500mL 容量瓶、胶头滴管,根据题目提供的可以知道,还需要的实验仪器是: 500mL容量瓶、胶头滴管;答案是: 500mL容量瓶、胶头滴管; (2)配制1.0 mol·L-1的NaOH溶液460 mL ,因为无460 mL 的容量瓶,故选用500mL容量瓶,则配制的是1.0 mol·L-1的NaOH溶液500mL,需要的NaOH的物质的量n=cV=1.0 mol·L-1×0.5L=0.5mol,质量m=nM=0.5mol×40g/mol=20.0g;答案是:20.0; (3)A.NaOH固体容易潮解,故放在纸张上称量会导致其真实质量偏小,所配溶液浓度偏小; B.砝码生锈并脱落后质量变小,故称量出的药品的质量偏小,则配制出的溶液的浓度偏小; C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中并定容,待溶液冷却后体积偏小,则浓度偏大; D.往容量瓶中移液时,有少量液体溅出,会导致溶质的损失,则溶液浓度偏小; E.未洗涤溶解NaOH的烧杯,会导致溶质的损失,则溶液浓度偏小; F.只要最后定容时凹液面与刻度线相切即可,至于水是事先就有的还是后来加入的,对浓度无影响; G.定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大; H.定容后反复摇匀,静置后,发现液面不到刻度线是正常的,浓度不发生变化; 故浓度偏大的有:CG,对浓度无影响的有:FH; 答案是: CG;FH; (4)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器,不能用于稀释溶液、溶解固体、作反应容器和储存溶液,因为只有一条刻度线,也不能配制除其规格以外容积的液体; 答案是:BCD; (5)操作过程是查漏、量取、溶解、移液、洗涤、定容、摇匀、装瓶,可以知道正确的操作顺序是: DECBAGF; 答案是: DECBAGF; (6)1个NH4+含有电子10个,含NA个电子的NH4+的物质的量为0.1mol,质量为m=nM=0.1mol×18g/mol=1.8g;23gNa+的物质的量为23g/23g/mol=1mol,1个Na+含有电子数为10个,1个OH-含电子数为10个,所以1mol×10=xmol×10,x=1mol; 故答案是:1.8 ;1。 22.近几年地球发生地震灾害较多,抢救地震后被困在废墟下的伤员,首要的措施是给伤员补充能量。下图是医院给伤员输液时用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列的内容后填写: (1)葡萄糖的摩尔质量为________; (2)该溶液中含水________ g; (3)该溶液的物质的量浓度为________ mol/L(精确到小数点后面两位)。 【答案】(1). 180 g/mol (2). 237.5 (3). 0.28 【解析】 【分析】(1)葡萄糖的摩尔质量在数值上等于它的相对分子质量,单位是g/mol; (2)根据标签给出的数据可以知道,250mL葡萄糖注射液中含葡萄糖12.5g,含量为5%,根据“葡萄糖质量÷葡萄糖含量”计算出一瓶葡萄糖注射液的质量;根据溶液中含水的质量=葡萄糖注射液的质量×水的含量(1-葡萄糖质量分数); (3) 先根据葡萄糖的质量求出它的物质的量,然后代入公式c=n/V求出溶液的物质的量浓度。 【详解】(1)葡萄糖的相对分子质量为180,所以葡萄糖的摩尔质量为; 答案是: 180 g/mol; (2)因为溶液中溶质的质量分数为5%,且含有共12.5g葡萄糖,一瓶葡萄糖注射液溶液的质量=12.5g÷5%=250g,所以该溶液中含水的质量=250g×(1-5%)=237.5 g;答案是:237.5; (3) 葡萄糖物质的量为n=12.5g/180 g/mol= 0.069mol,所以溶液的物质的量浓度c=n/V=0.069mol/0.25L≈0.28 mol/L;答案是:0.28。查看更多