- 2021-07-05 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学综合探究题作业(全国通用)
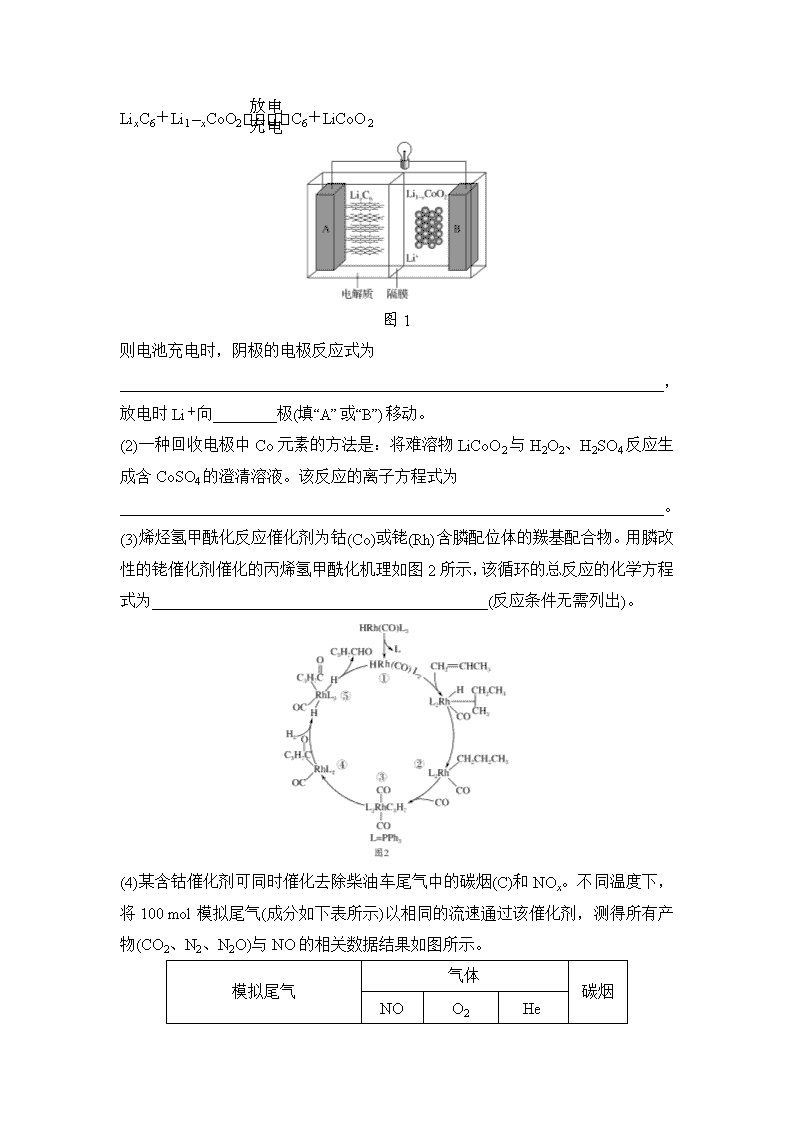
化学综合探究题 1.高铁酸钾(K2FeO4)是一种易溶于水,高效的多功能水处理剂。工业上通常先制得高铁酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从而使高铁酸钾析出。 (1)高铁酸钾中铁元素的化合价为________,推测其具有的化学性质是________。 (2)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。 ①该反应的离子方程式为__________________________________________。 ②高铁酸钾作为水处理剂起到的作用是______________________________。 (3)①在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2===2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为________,b与c的关系是________。 ②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是_____________________________________________________________________ ____________________________________________________________________。 (4)在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:_____________________________________________________________ ____________________________________________________________________。 (5)某同学配制了一瓶K2FeO4溶液,但标签丢失了,测定该瓶溶液物质的量浓度的实验步骤如下: 步骤1:准确量取V mL溶液加入锥形瓶中; 步骤2:在强碱溶液中,用过量CrO与FeO反应生成Fe(OH)3和CrO; 步骤3:加足量稀硫酸,使CrO转化为Cr2O,CrO转化为Cr3+,Fe(OH)3转化为Fe3+; 步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V1 mL。 ①滴定时发生反应的离子方程式为_______________________________________ ____________________________________________________________________。 ②原溶液中K2FeO4的物质的量浓度为________(用含字母的代数式表示)。 解析 (1)根据化合物中各元素化合价的代数和为零,可得铁元素的化合价为+6;高铁酸钾中铁元素处于最高价态,则高铁酸钾具有强氧化性。(2)①高铁酸钾与水反应生成O2,同时它本身被还原生成Fe(OH)3,反应的离子方程式为4FeO+10H2O===4Fe(OH)3(胶体)+8OH-+3O2↑。②高铁酸钾具有强氧化性,作为水处理剂能起到杀菌消毒的作用,同时其还原产物为Fe(OH)3胶体,又能起到净水的作用。(3)①根据元素守恒可知,X应是Na2O,根据钠元素守恒,有2a=8+2b,根据氧元素守恒有2a=8+b+2c,两式联立,可得b=2c。②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是该条件下高铁酸钾的溶解度小于高铁酸钠的溶解度。(4)用氯气在碱性条件下氧化氯化铁可制备高铁酸钾,根据得失电子守恒、原子守恒及电荷守恒,反应的离子方程式为2Fe3++3Cl2+16OH-===2FeO+6Cl-+8H2O。(5)根据题意,步骤2中发生反应FeO+CrO+2H2O===Fe(OH)3↓+CrO+OH-,步骤3中CrO在稀硫酸作用下发生反应2CrO+2H+Cr2O+H2O,步骤4滴定时发生反应Cr2O+6Fe2++14H+===6Fe3++2Cr3++7H2O,故可得关系式FeO~3Fe2+。原溶液中K2FeO4的物质的量浓度为 mol·L-1。 答案 (1)+6 强氧化性 (2)①4FeO+10H2O===4Fe(OH)3(胶体)+8OH-+ 3O2↑ ②杀菌消毒、净水 (3)①Na2O b=2c ②相同条件下高铁酸钾的溶解度小于高铁酸钠的溶解度 (4)2Fe3++3Cl2+16OH-===2FeO+6Cl-+8H2O (5)①Cr2O+6Fe2++14H+===6Fe3++2Cr3++7H2O ② mol·L-1 2.钴是一种人体必需的微量金属元素,在生产中也有极为广泛的用途,钴及其化合物可用作催化剂、电池、颜料与染料等的原料。 (1)特斯拉全电动汽车使用的是钴酸锂电池,其工作原理如图1所示,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式为: LixC6+Li1-xCoO2C6+LiCoO2 图1 则电池充电时,阴极的电极反应式为 ____________________________________________________________________, 放电时Li+向________极(填“A”或“B”)移动。 (2)一种回收电极中Co元素的方法是:将难溶物LiCoO2与H2O2、H2SO4反应生成含CoSO4的澄清溶液。该反应的离子方程式为 ____________________________________________________________________。 (3)烯烃氢甲酰化反应催化剂为钴(Co)或铑(Rh)含膦配位体的羰基配合物。用膦改性的铑催化剂催化的丙烯氢甲酰化机理如图2所示,该循环的总反应的化学方程式为__________________________________________(反应条件无需列出)。 (4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx。不同温度下,将100 mol模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。 模拟尾气 气体 碳烟 NO O2 He 物质的量分数 0.25% 5% 94.75% a mol 或物质的量 380 ℃时,测得排出的气体中含4.5 mol O2和0.525 mol CO2,则X的化学式为____________________________________________________________________。 (5)NOx也可用SCR法消除,反应原理如下: 4NO(g)+4NH3(g)+O2(g)===4N2(g)+6H2O(g) ΔH<0,其他条件相同,向某密闭容器中分别投入NH3、NO、O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图4所示。在催化剂甲作用下,图中Y点处(对应温度为210 ℃)NO的转化率一定不是该温度下的平衡转化率的原因_________________________________________________________ ___________________________________________________________________。 工业实际选择催化剂乙的原因是 ____________________________________________________________________。 解析 第(1)问第一空,根据总方程式判断阴极反应物与生成物,再由反应物得电子在Li+介质中生成 LixC6。第(2)问第二空,放电时为原电池,阳离子Li+移向正极。 第(2)问,氧化还原反应方程式的书写,先判断生成物再配平。 第(3)问,由图箭头进入的为反应物,箭头出来的为生成物,反应物是CH2===CH—CH3 、CO 和H2,生成物是C3H7CHO,总方程式为CH2===CH-CH3+CO+H2→C3H7CHO。 第(4)问,设NO转化为N2a mol,转化为N2O b mol,由N原子、O原子守恒列出等式:2a+2b=100×0.25%×(16%+8%) ……①,2a+2b-b=0.525×2—(5—4.5)×2……②,解得a=0.02 mol、b=0.01 mol,推知X的化学式为N2。 第(5)问第一空,理解平衡转化率即该条件下的最大转化率、催化剂不改变平衡的转化率,分析图4曲线的意义可得Y点处NO的转化率一定不是该温度下的平衡转化率。第(5)问第二空,工业生产中通常根据反应物的转化率、温度和压强的大小、催化剂的活性等因素选择条件,该问中,温度较低时,使用催化剂乙NO的转化率已很高。 答案 (1)C6+xLi++xe-===LixC6 B (2)2LiCoO2+H2O2+6H+===2Li++2Co2++O2↑+4H2O (3)CH2===CH—CH3+CO+H2―→ C3H7CHO (4)N2 (5)平衡转化率是该温度下的最大转化率,此时Y点NO的转化率明显低于同温度下乙作催化剂时NO的转化率 在低温下,使用催化剂乙,NO转化率很高。 3.硫氰酸盐、苯酚及硫代硫酸盐是HPF脱硫废液中的主要污染物(其中还含有Cl-、SO、Na+等)可用NaClO3、H2SO4作脱除的试剂。 (1)Cl2与热的NaOH溶液反应生成NaClO3,该反应的化学方程式为____________________________________________________________________。 (2)常温时,反应C6H5O-+H2OC6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。 (3)处理该废水需经预处理和再处理阶段。 ①用浓硫酸对600 mL HPF脱硫废液进行酸化预处理(反应温度100 ℃),其结果如表所示: 表1 预处理前后三种离子浓度变化情况 项目 S2O(g·L-1) SCN-(g·L-1) 苯酚(g·L-1) pH 处理前 34.28 70.11 1.3 8.55 处理后 0.91 69.76 1.35 2.4 由表1可知,该处理过程中主要被除去的污染物是________。 ②对预处理后废液进行再处理(反应温度100 ℃)时,分13次依次向废液中加入试剂情况如表所示: 表2 13次依次加入试剂情况 次数 1 2 3 4 5 6 7 8 9 10 11 12 13 NaClO3/g 16.3 0 0 0 0 0 7.6 0 5.7 0 10.9 0 7.1 浓H2SO4/mL 0 2 2 2 4 4 0 4 0 4 0 4 0 实验结果如图1所示: 前6次苯酚脱除率可达到80%左右,该过程中苯酚转化为白色沉淀(含苯环),这与溶液中ClO和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为____________________________________________________________________。 ③由表2和图1中数据得出,第7~13次操作中SCN-在较强酸性条件下被ClO(不水解)氧化的依据是______________________________________________。 此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x ,支持该推测的证据有: ____________________________________________________________________。 答案 (1)3Cl2+6NaOHNaClO3+5NaCl+3H2O (2)1×10-4 (3)①S2O(硫代硫酸盐) ② ③第7、9、11、13次加入NaClO3时,pH明显增大,SCN-脱除率相应增大(或:7~13次加入NaClO3时SCN-脱除率明显增大,而苯酚脱除率增大不明显);SCN-可被某些氧化剂(如Cu2+等)氧化为砖红色的沉淀,ClO具有较强的氧化性,沉淀中N、S物质的量之比几乎为1∶1且还含有C元素 4.辉铜矿主要成分是Cu2S,可用于制取金属铜和铜盐。 (1)已知部分反应的热化学方程式如下: C(s)+S2(g)===CS2(g) ΔH1=a kJ·mol-1 Cu2S(s)+H2(g)===2Cu(s)+H2S(g) ΔH2=b kJ·mol-1 2H2S(g)===2H2(g)+S2(g) ΔH3=c kJ·mol-1 则C(s)+2Cu2S(s)===4Cu(s)+CS2(g)的ΔH=________kJ·mol-1(用含a、b、c的代数式表示)。 (2)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。 ①反应Cu2S+4FeCl3===2CuCl2+4FeCl2+S,每生成1 mol CuCl2,反应中转移电子的数目为________,浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式是_____________________________________________________ __________________________________________________________________; ②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图甲所示,其原因是____________________________________________________________________; ③353 K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为__________________________________________, CuCl+FeCl3===CuCl2+FeCl2。 (3)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化如图乙所示。转化时正极的电极反应式为 ____________________________________________________________________。 (4)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)Cu2S(s)+ 2Cl-(aq),该反应的平衡常数K=________[已知Ksp(CuCl)=1.2×10-6,Ksp(Cu2S)=2.5×10-43]。 解析 (1)由盖斯定律知:ΔH=ΔH1+2ΔH2+ΔH3=(a+2b+c) kJ·mol-1。(2)①由反应方程式知,生成2 mol CuCl2时转移4 mol电子,根据“有氧”“Fe3+较高浓度”信息可知,有O2参加反应,生成Fe3+,从而写出正确的离子方程式。②S单质覆盖在辉铜矿表面,阻碍Cu2S与FeCl3的接触。先要想到加入的CuCl2与Cu2S参加了反应,由题目所给的另一方程式知生成了CuCl,结合总反应知生成了S,写出Cu2S+CuCl2―→CuCl+S后进行配平即可。(3)正极是得电子的还原反应,由图乙可知,CuFeS2得到电子结合H+,转化为Cu2S、H2S、Fe2+,配平即可。(4)K====5.76×1030 (mol·L-1)。 答案 (1)a+2b+c (2)①2NA(或1.204×1024) 4Fe2++O2+4H+===4Fe3++2H2O ②生成的硫覆盖在Cu2S表面,阻碍浸取 ③Cu2S+2CuCl2===4CuCl+S (3)2CuFeS2+6H++2e-===Cu2S+2Fe2++3H2S↑ (4)5.76×1030 5.氢能是一种极具发展潜力的清洁能源,硫碘循环制氢主要的热化学方程式为: Ⅰ.SO2(g)+2H2O(l)+I2(g)===H2SO4 (l)+2HI(g) ΔH=35.9 kJ/mol Ⅱ.2H2SO4(l)===2SO2(g)+O2(g)+2H2O(l) ΔH=470 kJ/mol Ⅲ.2HI(g)===H2(g)+I2(g) ΔH=14.9 kJ/mol (1)反应2H2(g)+O2(g)===2H2O(l)的ΔH=________ mol·L-1。 (2)反应Ⅰ在液相中发生称为bensun反应,向水中加入1 mol SO2和3 mol I2,在不同温度下恰好完全反应生成的n(SO)和n(I)的变化见图甲。 ①I中x=________。 ②温度达到120 ℃时,该反应不发生的原因是 ____________________________________________________________________。 (3)反应Ⅲ是在图乙中进行,其中的高分子膜只允许产物通过,高分子膜能使反应程度________(填“增大”、“减小”或“不变”),在该装置中为了进一步增大平衡时HI的分解率;不考虑温度的影响,还可以采取的措施为 ____________________________________________________________________。 (4)图丙是一种制备H2的方法,装置中的MEA为允许质子通过的电解质膜。 ①写出阳极电极的反应式: _______________________________________________。 ②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为____________________________________________________________。 解析 (1)目标反应可由-Ⅰ×2-Ⅱ-Ⅲ×2获得,计算反应热。(2)由图可知3 mol I2转化为2 mol I,由原子守恒x=3。温度达到120 ℃,此时水为气态,I2 也为气态,气态条件下三者不反应。(3)高分子膜相当于分离出产物,提高反应的转化率。提高HI的分解率,促使平衡正向移动,温度不考虑,压强不影响,所以考虑分离产物。(4)金属氢化物可能为MgH2或AlH3,两者氢的质量分数分别为0.077、0.01,所以产物为MgH2和Al。 答案 (1)-571.6 (2)①3 ②此温度下碘单质、水、二氧化硫均为气态,气相中不发生反应 (3)增大 向装置中通入氮气(或其它“惰性”气体)吹出产物 (4)①CH3OH+H2O-6e-===CO2↑+6H+ ②Mg17Al12+17H2===17MgH2+12Al 6.合成氨工业是基础化学工业的重要组成部分。 (1)以NH3与CO2为原料可合成化肥尿素。 已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH1=-159.5 kJ·mol-1; ②NH2CO2NH4(s)===CO(NH2)2+H2O(l) ΔH2=+28.5 kJ·mol-1 ③H2O(l)===H2O(g) ΔH3=+44.0 kJ·mol-1。 则NH3(g)与CO2(g)合成CO(NH2)2(s)和H2O(g)的热化学方程式为____________________________________________________________________。 (2)工业合成氨在合成塔中进行,测得合成塔入口气体体积之比V(N2)∶V(H2)∶V(NH3)=6∶18∶1,出口气体体积之比为V(N2)∶V(H2)∶V(NH3)=9∶27∶8,则H2的转化率为________。 (3)为降低合成氨工业废水的氨氮浓度,在厌氧氨氧化菌的催化作用下,使铵盐与亚硝酸盐反应生成N2,该反应的离子方程式是 ____________________________________________________________________。 (4)犹他大学化学家发明了N2/H2生物燃料电池,以质子交换膜为隔膜,在室温条件下合成了氨的同时还提供了电 能(工作原理如图甲所示)。该生物燃料电池中,正极电极反应式为____________________________________________________________________。 (5)NH3可用于烟气的脱硝,使烟气中的NO还原为N2。某研究小组研究了NH3和NO在Ag2O催化剂表面的反应活性随温度的变化关系,实验结果如图乙所示。在有氧条件下,温度580 K之后NO生成N2的转化率降低的原因可能是____________________________________________________________________。 在温度在420~580 K时,有氧条件下NO生成N2的转化率明显高于无氧条件下原因可能是_______________________________________________________。 解析 (1)由盖斯定律知:2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(g)的ΔH=ΔH1+ΔH2+ΔH3=-87.0 kJ·mol-1。(2)设入口气体量N2、H2、NH3物质的分别为6 mol、18 mol、1 mol,计算如下: N2 + 3H22NH3 n0/mol: 6 18 1 Δn/mol: x 3x 1+2x n平/mol: 6-x 18-3x 1+2x 根据题意有(6-x)∶(1+2x)=9∶8,解得x=1.5,则H2的转化率=×100%=×100%=25%。(3)先根据题意写出NH+NO―→N2↑,然后配平。(5)第一空要从温度升高对反应的影响或对催化剂的影响去考虑;第二空要从加入O2后,O2可能存在的影响去考虑。 答案 (1)2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(g) ΔH=-87.0 kJ·mol-1 (2)25% (3)NH+NON2↑+2H2O (4)N2+6e-+6H+===2NH3 (5)催化剂活性降低 NO与O2反应生成NO2,NO2更易与NH3反应 7.近几年来关于氮污染的治理倍受关注。 (1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图甲所示,化合物X可借助傅里叶红外光谱图(如图乙所示)确定。 ①在图示的转化中,被还原的元素是________,X的化学式为________。 ②SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为4∶1时,写出发生反应的化学方程式: ____________________________________________________________________。 (2)加入过量次氯酸钠可使废水中NH完全转化为N2,而本身被还原为NaCl。 ①写出上述反应的离子方程式: _____________________________________________________________________ ____________________________________________________________________。 ②若处理废水产生了0.448 L N2(标准状况下),则需消耗浓度为0.5 mol·L-1的次氯酸钠溶液的体积为____ mL。 (3)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图所示。气体甲是________(写化学式),电解池中生成N2的电极反应式为 ____________________________________________________________________。 解析 (1)①根据箭头所示,氮元素和氧元素化合价降低,被还原;化合物X可借助傅里叶红外光谱图确定,说明X中存在NO,再根据图甲可知,X中存在 Ba2+。②NOx与NH3直接反应生成N2和H2 O,根据电子得失守恒和原子个数守恒写出化学方程式。(2)①ClO-与NH反应生成N2和Cl-,根据电子得失守恒和电荷守恒写出离子方程式。②由离子方程式可得出关系式3ClO-~N2,n(N2)==0.02 mol,则n(ClO-)=0.06 mol,V(ClO-)==0.12 L=120 mL。(3)左端为CN-―→N2,氮元素被氧化,则左端为阳极,电极反应式为2CN-+12OH--10e-===2CO+N2↑+6H2O;右端为阴极,阴极为溶液中的阳离子发生放电,则气体甲为氢气。 答案 (1)①N、O Ba(NO3)2 ②8NH3+8NO+2NO2===9N2+12H2O (2)①2NH+3ClO-===N2↑+3Cl-+2H++3H2O ②120 (3)H2 2CN-+12OH--10e-===2CO+N2↑+6H2O 8.煤炭燃烧过程中会释放出大量的SO2、CO等有毒气体,工业上常用CaSO4、MnO2、海水来消除它们对大气的污染。 (1)CaSO4消除CO的反应原理如下: CaSO4(s)+4CO(g)CaS(s)+4CO2(g) ΔH1<0 CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH2>0 常压下,工业生产中为了尽可能减少有毒气体的排放,常采用的措施是 ____________________________________________________________________。 (2)在煤粉中掺入MnO2,既能脱硫又能提高燃烧效率。 ①某煤粉中含硫元素的质量分数为0.5 %,在煤粉中掺入MnO2可在燃烧过程中生成MnSO4,理论上若使硫元素恰好与MnO2完全反应,则MnO2与煤粉混合的质量比为________。实际上需要向煤粉中掺入过量的MnO2以提高煤粉的燃烧效率,经分析,燃烧后的生成物中含有Mn3O4,由此可知MnO2能提高煤粉燃烧效率的原因是__________________________________________________________。 ②用图甲电解MnSO4溶液可制备MnO2,其阳极的电极反应式为________________。酸性条件下,加热KClO3和MnCl2 混合溶液也能制备MnO2,同时产生一种黄绿色的气体,该反应的离子方程式为 ____________________________________________________________________。 (3)海水中的钠镁比(钠、镁元素的质量比)是影响吸收SO2的主要因素。某海水随水分的蒸发,钠镁比与密度关系如图乙所示,该海水中的钠镁比在密度高于 1.23 g·cm-3时急剧下降的原因是____________________________________。 已知三种海水体系的SO2吸收量随温度变化如图丙所示,工业上常采用________作为SO2的吸收剂。 丙 解析 (1)由题给的两个反应可知,适当降低温度则主要按第一个反应进行,可减少有毒气体的排放。(2)①由题意得关系式:S~SO2~MnO2,则MnO2与煤粉的质量比==。MnO2转化为Mn3O4同时放出氧气,而氧气可助燃。②电解时阳极发生氧化反应,即Mn2+转化为MnO2,电极反应式见答案。ClO也可将Mn2+氧化为MnO2,则ClO转化为黄绿色的Cl2,离子方程式见答案。(3)海水水分蒸发,海水密度增大,当密度高于1.23 g·cm-3时,有NaCl形成晶体析出,则钠镁比急剧下降。由图丙可知,常温下卤水吸收SO2的量最大,温度升高后SO2的残留量又最少,故卤水最利于SO2的吸收与富集。 答案 (1)适当降低温度 (2)①87∶6 400 MnO2分解生成Mn3O4,同时放出氧气 ②Mn2++2H2O-2e-===MnO2+4H+ 5Mn2++2ClO+4H2O===5MnO2↓+Cl2↑+8H+ (3)密度高于1.23 g·cm-3时海水中的NaCl开始析出,导致钠镁比急剧下降 卤水查看更多