- 2021-07-05 发布 |
- 37.5 KB |
- 16页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021年高考化学一轮复习第九单元 化学实验基础测试题
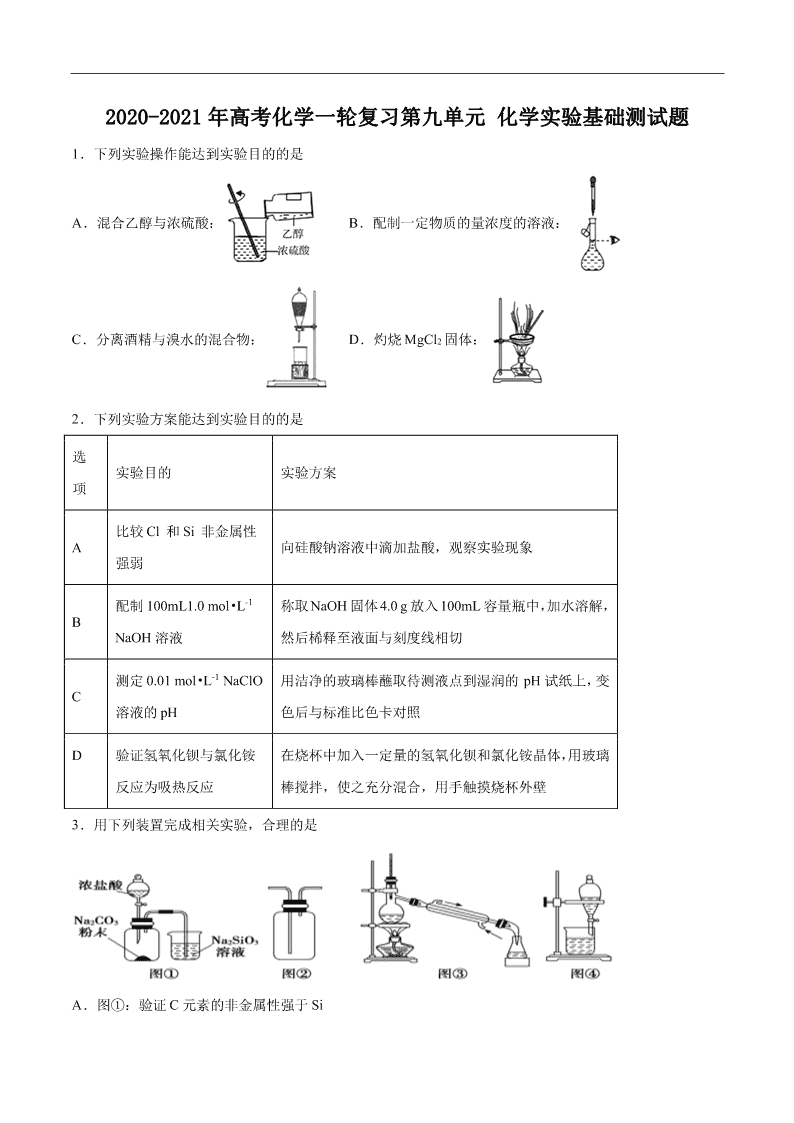
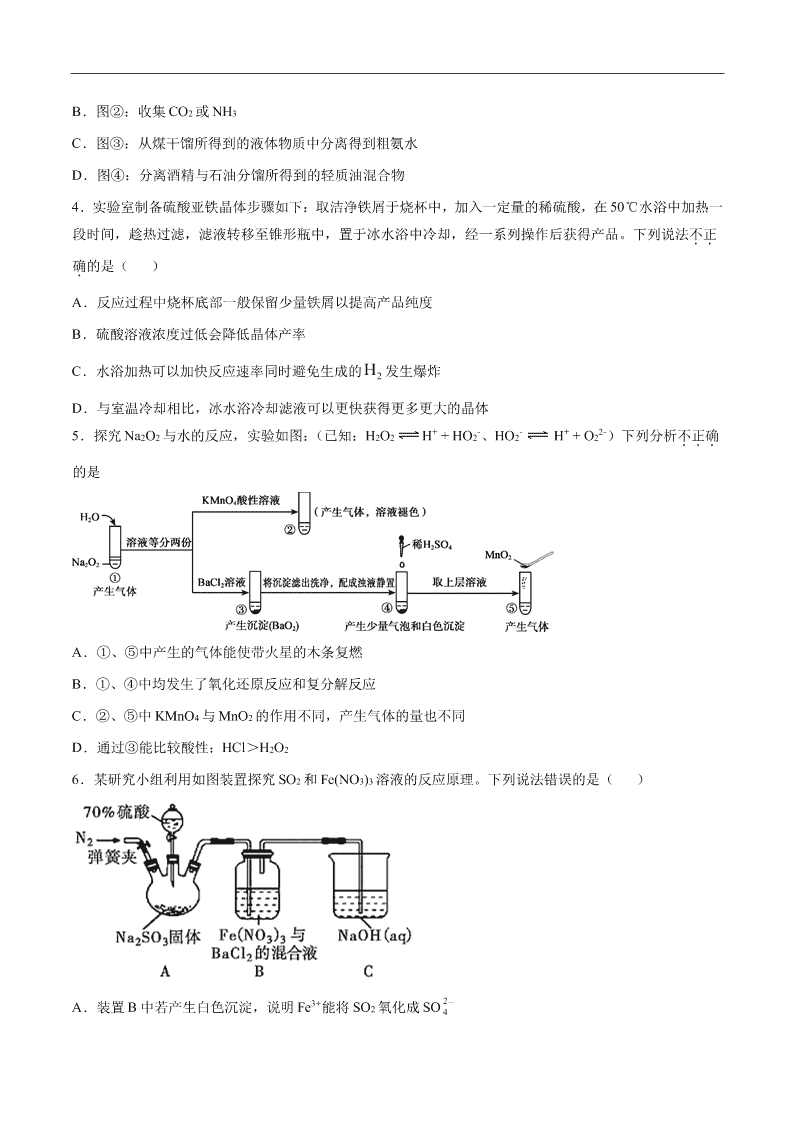
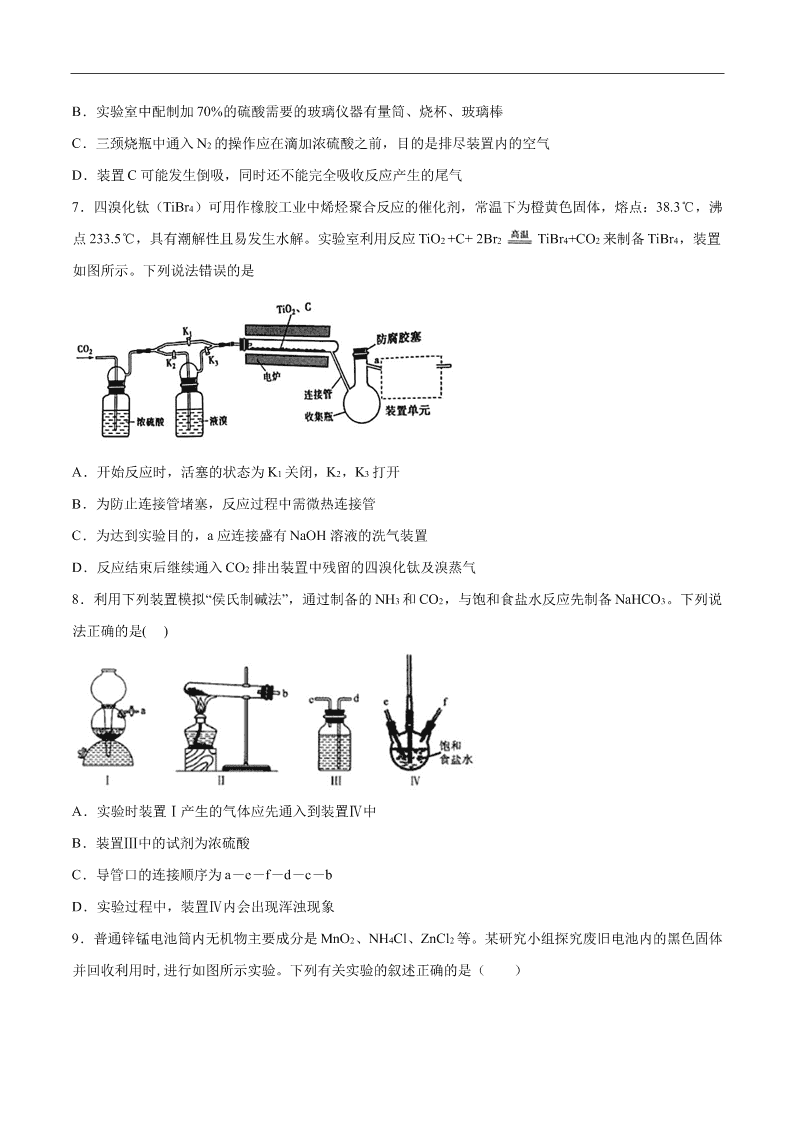
2020-2021 年高考化学一轮复习第九单元 化学实验基础测试题 1.下列实验操作能达到实验目的的是 A.混合乙醇与浓硫酸: B.配制一定物质的量浓度的溶液: C.分离酒精与溴水的混合物: D.灼烧 MgCl2 固体: 2.下列实验方案能达到实验目的的是 选 项 实验目的 实验方案 A 比较 Cl 和 Si 非金属性 强弱 向硅酸钠溶液中滴加盐酸,观察实验现象 B 配制 100mL1.0 mol•L-1 NaOH 溶液 称取 NaOH 固体 4.0 g 放入 100mL容量瓶中,加水溶解, 然后桸释至液面与刻度线相切 C 测定 0.01 mol•L-1 NaClO 溶液的 pH 用洁净的玻璃棒蘸取待测液点到湿润的 pH 试纸上,变 色后与标准比色卡对照 D 验证氢氧化钡与氯化铵 反应为吸热反应 在烧杯中加入一定量的氢氧化钡和氯化铵晶体,用玻璃 棒搅拌,使之充分混合,用手触摸烧杯外壁 3.用下列装置完成相关实验,合理的是 A.图①:验证 C 元素的非金属性强于 Si B.图②:收集 CO2 或 NH3 C.图③:从煤干馏所得到的液体物质中分离得到粗氨水 D.图④:分离酒精与石油分馏所得到的轻质油混合物 4.实验室制备硫酸亚铁晶体步骤如下:取洁净铁屑于烧杯中,加入一定量的稀硫酸,在 50℃水浴中加热一 段时间,趁热过滤,滤液转移至锥形瓶中,置于冰水浴中冷却,经一系列操作后获得产品。下列说法不正.. 确.的是( ) A.反应过程中烧杯底部一般保留少量铁屑以提高产品纯度 B.硫酸溶液浓度过低会降低晶体产率 C.水浴加热可以加快反应速率同时避免生成的 2H 发生爆炸 D.与室温冷却相比,冰水浴冷却滤液可以更快获得更多更大的晶体 5.探究 Na2O2 与水的反应,实验如图:(已知:H2O2 H+ + HO2-、HO2- H+ + O22-)下列分析不正确... 的是 A.①、⑤中产生的气体能使带火星的木条复燃 B.①、④中均发生了氧化还原反应和复分解反应 C.②、⑤中 KMnO4 与 MnO2 的作用不同,产生气体的量也不同 D.通过③能比较酸性:HCl>H2O2 6.某研究小组利用如图装置探究 SO2 和 Fe(NO3)3 溶液的反应原理。下列说法错误的是( ) A.装置 B 中若产生白色沉淀,说明 Fe3+能将 SO2 氧化成 SO 2 4 B.实验室中配制加 70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒 C.三颈烧瓶中通入 N2 的操作应在滴加浓硫酸之前,目的是排尽装置内的空气 D.装置 C 可能发生倒吸,同时还不能完全吸收反应产生的尾气 7.四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂,常温下为橙黄色固体,熔点:38.3℃,沸 点 233.5℃,具有潮解性且易发生水解。实验室利用反应 TiO2 +C+ 2Br2 TiBr4+CO2 来制备 TiBr4,装置 如图所示。下列说法错误的是 A.开始反应时,活塞的状态为 K1 关闭,K2,K3 打开 B.为防止连接管堵塞,反应过程中需微热连接管 C.为达到实验目的,a 应连接盛有 NaOH 溶液的洗气装置 D.反应结束后继续通入 CO2 排出装置中残留的四溴化钛及溴蒸气 8.利用下列装置模拟“侯氏制碱法”,通过制备的 NH3 和 CO2,与饱和食盐水反应先制备 NaHCO3。下列说 法正确的是( ) A.实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中 B.装置Ⅲ中的试剂为浓硫酸 C.导管口的连接顺序为 a-e-f-d-c-b D.实验过程中,装置Ⅳ内会出现浑浊现象 9.普通锌锰电池筒内无机物主要成分是 MnO2、NH4Cl、ZnCl2 等。某研究小组探究废旧电池内的黑色固体 并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是( ) A.操作①中玻璃棒的作用是转移固体 B.操作②为过滤,得到的滤液显碱性 C.操作③中盛放药品的仪器是坩埚 D.操作④的目的是除去滤渣中的杂质 10.Cl2O 是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与 有机物、还原剂接触或加热时会发生燃烧并爆炸。制取 Cl2O 的装置如图所示。 已知:Cl2O 的熔点为-116℃,沸点为 3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O 下列说法不正确的是( ) A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸 B.通入干燥空气的目的是将生成的 Cl2O 稀释减少爆炸危险 C.从装置⑤中逸出气体的主要成分是 Cl2O D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸 11.Y 形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究 SO2 与 BaCl2 反应生成 BaSO3 沉淀的条件。下列判断正确的是 A.e、f 两管中的试剂可以分别是浓氨水和 NaOH 固体 B.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应 C.c、d 两根导管都必须插入 BaCl2 溶液中,保证气体与 Ba2+充分接触 D.Y 形管乙中产生的为氧化性气体,将 BaSO3 氧化为 BaSO4 沉淀 12.已知草酸(H2C2O4)是一种弱酸,157℃升华,170℃以上分解可放出 CO2、CO 和 H2O;草酸具有还原性; 其钠盐易溶于水,钙盐难溶于水。现选用如下装置完成草酸分解实验,下列说法不正确...的是 A.A 与 B 组合用于检验草酸分解产生的 H2O B.AFD 组合用于检验草酸分解产生的 CO2 C.A 与 E 组合用于检验草酸分解产生的 CO D.装置 C 可用于尾气收集草酸分解产生的 CO 13.二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为 11℃,可用于处理含硫废水。 某小组在实验室中探究 ClO2 与 Na2S 的反应。回答下列问题: (1)ClO2 的制备(已知:SO2+2NaClO3+H2SO4═2ClO2+2NaHSO4。) ①整套装置正确的链接顺序为(填 A~E)A→_______________。 ②装置 D 的作用是_______________。 (2)ClO2 与 Na2S 的反应 将上述收集到的 ClO2 用 N2 稀释以增强其稳定性,并将适量的稀释后的 ClO2 通入如图所示装置中充分反应, 得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。 操作步骤 实验现象 结论 取少量Ⅰ中溶液于试管甲中,滴加品 红溶液和盐酸 品红溶液始终不褪色 ①无生成 另取少量Ⅰ中溶液于试管乙中,加入 Ba(OH)2 溶液,振荡 ② 有 2- 4SO 生成 ③继续在试管乙中滴加 Ba(OH)2 溶液 至过量,静置,取上层清液于试管丙 中,_______________ 有白色沉淀生成 有 Cl-生成 ④ClO2 与 Na2S 反应的离子方程式为_______________,用于处理含硫废水时,ClO2 相对于 Cl2 的优点是 _______________(任写一条)。 14.实验室以苯甲醛为原料制备间溴苯甲醛的反应如下: 已知:(1)间溴苯甲醛温度过高时易被氧化。 (2)溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点见下表: 物质 溴 苯甲醛 1,2-二氯乙烷 间溴苯甲醛 沸点/℃ 58.8 179 83.5 229 步骤 1:将一定配比的无水 AlCl3、1,2-二氯乙烷和苯甲醛充分混合后装入三颈烧瓶(如右图所示),缓慢滴 加经浓硫酸干燥过的足量液溴,控温反应一段时间,冷却。 步骤 2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用 10% NaHCO3 溶液洗涤。 步骤 3:经洗涤的有机层加入适量无水 MgSO4 固体,放置一段时间后过滤出 MgSO4•nH2O 晶体。 步骤 4:减压蒸馏有机层,收集相应馏分。 (1)实验装置中冷凝管的主要作用是_____,锥形瓶中应为_____(填化学式)溶液。 (2)步骤 1 反应过程中,为提高原料利用率,适宜的温度范围为(填序号)_______。 A.>229℃ B.58.8℃~179℃ C.<58.8℃ (3)步骤 2 中用 10% NaHCO3 溶液洗涤,是为了除去溶于有机层的___(填化学式)。 (4)步骤 3 中加入无水 MgSO4 固体的作用是_____。 (5)步骤 4 中采用减压蒸馏,是为了防止______。 (6)若实验中加入了 5.3 g 苯甲醛,得到 3.7 g 间溴苯甲醛。则间溴苯甲醛产率为______。 15.硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在有 机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图: 硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上 加装分馏柱 a,用电炉经水浴锅加热,回流 2 小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装 置略去,下同)。 硼酸三甲酯 B(OCH3)3 甲醇 甲醇钠 溶解性 与乙醇、甲醇混溶,能水解 与水混溶 溶于甲醇,不溶于异丙胺 沸点/℃ 68 64 450 硼酸三甲酯与甲醇混合物的共沸点为 54℃ (1)直形冷凝管冷却水应从________(填“b”或“c”)接口进入。 (2)浓硫酸的作用是_______。 (3)本实验采用水浴加热,优点是________;U 型管中试剂的作用是__________。 (4)在 240℃条件下进行,硼酸三甲酯与氢化钠反应制取 NaBH4,同时生成 CH3ONa,写出该反应的化学方程 式______。 (5)萃取时可采用索氏提取法,其装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿导管 2 上升至球形冷 凝管,冷凝后滴入滤纸套筒 1 中,进行萃取。萃取液液面达到虹吸管 3 顶端时,经虹吸管 3 返回烧瓶,从而 实现连续萃取。当萃取完全后,硼氢化钠在_______(填“圆底烧瓶”或“索氏提取器”)中。 (6)分离 NaBH4 并回收溶剂,采用的方法是_______。 (7)“有效氢含量”可用来衡量含氢还原剂的还原能力,定义是:每克含氢还原剂的还原能力相当于多少克 H2 的还原能力。NaBH4 的有效氢含量为_____________(保留两位小数)。 16.硝酸铝广泛应用在显像管生产,稀土的提炼等,工业上具体流程如下: 已知:①硝酸铝白色透明结晶。易溶于水和乙醇,极微溶于丙酮,几乎不溶于乙酸乙酯。 ②熔点 73℃,在 135℃时分解。 ③硝酸和铝反应的还原产物分布如图 1。 某兴趣小组在实验室制取硝酸铝,请回答: (1)从工业生产角度考虑稀硝酸的最佳浓度范围为________ mol·L-1。反应 2 中的离子方程式____________。 (2)下列说法合理的是________。 A 反应 1 中加入的 NaOH 溶液,除油污和氧化膜,所以要足量 B 没有真空,也可在水浴条件下蒸发,防止 Al(NO3)3 的分解 C Al(NO3)3·9H2O 干燥时,可放在如图 2 的干燥器中,隔板下放上浓硫酸吸水,由于吸附力较大,要用力 垂直拉开玻璃盖 D 制取后的 Al(NO3)3 必须密封保存 (3)Al(NO3)3·9H2O 也可以和 SOCl2 反应,除了生成 Al(NO3)3,其它产物都是酸性气体,有关的方程式是 ______________; (4)由铝制备 Al(NO3)3 的装置如图 3: ①通入水蒸气的作用是提高温度和________。 ②e中很难除尽尾气,理由是_______________, Al(NO3)3·9H2O晶体吸附HNO3,合适的洗涤剂是________。 ③有人认为 C 的冷凝管是多余的,他提供的理由可能是___________。 参考答案 1.B【解析】A.混合乙醇和浓硫酸,应先将乙醇倒入烧杯中,再沿器壁慢慢加入浓硫酸,边加边冷却或搅 拌,A 项错误; B.配制一定物质的量浓度的溶液,定容时,视线平视,用胶头滴管向容量瓶中滴加蒸馏水至凹液面最低处 正好与容量瓶的刻度线相切。B 项正确; C.溴水可溶于酒精中,用分液漏斗无法分离酒精和溴水,C 项错误; D.灼烧物质应使用的化学仪器为:坩埚、坩埚钳、酒精灯、三脚架等,题中仪器选择错误,D 项错误; 答案选 B。 2.D【解析】A.向硅酸钠溶液中滴加盐酸可生成硅酸沉淀,符合强酸制弱酸,只能证明盐酸酸性强于硅 酸,由于盐酸不是氯元素最高价氧化物对应水化物形成的酸,故不能比较 Cl 和 Si 非金属性强弱,故 A 错 误; B.配制 100mL1.0 mol•L-1NaOH 溶液时,溶质 NaOH 溶解的过程应该在烧杯中进行,不能用容量瓶溶解, 故 B 错误; C.测定 0.01 mol•L-1NaClO 溶液中的次氯酸根离子水解形成次氯酸,具有漂白性,能使 pH 试纸褪色,所以 不能用 pH 试纸测定 0.01 mol•L-1NaClO 溶液的 pH,故 C 错误; D.氢氧化钡和氯化铵晶体混合后发生反应时会吸收大量的热,使周围环境温度降低,用手触摸烧杯外壁, 能感觉到发凉,则能验证氢氧化钡与氯化铵反应为吸热反应,故 D 正确; 答案选 D。 3.B【解析】A.浓盐酸易挥发,生成的 CO2 气体中含有 HCl,HCl 也能与硅酸钠反应生成硅酸沉淀,不能 说明碳酸的酸性强于硅酸,进而验证 C 元素的非金属性强于 Si,A 不合理; B.CO2 和 NH3 均能用排空气法收集,CO2 的密度比空气大,则导管长进短处收集 CO2,NH3 的密度比空气 小,则导管短进长出收集 NH3,B 合理; C.煤的干馏是隔绝空气加强热得到焦炭、煤焦油、焦炉气、粗氨水、粗笨等的过程,采用分液的方法可得 到粗氨水,C 不合理; D.酒精与石油分馏所得到的轻质油混合物互溶,不能用分液的方法,D 不合理; 答案选 B。 4.D【解析】A.反应过程中烧杯底部一般保留少量铁屑,防止亚铁离子被氧化成铁离子,以提高产品纯 度,故 A 正确; B. 硫酸溶液过稀会导致反应速率慢,不利于晶体析出,硫酸溶液过浓,会将亚铁离子氧化为铁离子,影响 产率,故 B 正确; C.温度升高,化学反应速率加快,故水浴加热可加快反应速率,同时避免生产的氢气发生爆炸,故 C 正确; D.自然冷却,可使晶粒生长,得到较大颗粒的晶体,冰水浴冷却比室温冷却得到的晶体颗粒小,故 D 错误; 答案选 D。 5.D【解析】根据实验探究可以看出,试管①过氧化钠与水反应生成氢氧化钠与氧气,试管②中高锰酸钾 具有氧化性,产生气体,溶液褪色,则体现了过氧化氢的还原性;试管③中过氧化氢与氯化钡发复分解反 应生成过氧化钡沉淀与稀盐酸,试管④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,试管⑤中 探究过氧化氢在二氧化锰催化剂作用下分解生成水和氧气,据此分析作答。 A. 试管①中过氧化钠与水反应最终生成氢氧化钠与氧气,试管⑤中过氧化氢在二氧化锰催化剂作用下分解 生成水和氧气,因此产生的气体均能是带火星的木条复燃,A 项正确; B. ①中的反应机理可以认为过氧化钠与水反应生成过氧化氢与氢氧化钠,过氧化氢分解生成水和氧气,发 生的反应为复分解与氧化还原反应,④中过氧化钡再与稀硫酸反应生成过氧化氢与硫酸钡沉淀,过氧化氢 分解产生了氧气,因此两个试管中均发生了氧化还原反应和复分解反应,B 项正确; C. ②中 KMnO4 与过氧化氢反应生成氧气,KMnO4 体现氧化性,而⑤中 MnO2 则起催化作用,两个试管中产 生氧气的量均由过氧化氢的量决定,因溶液是等分的,但②中过氧化氢全部被氧化⑤中的过氧化氢发生歧 化反应,所以产生气体的量不相同,C 项正确; D. 根据已知条件可以看出过氧化氢属于二元弱酸,而盐酸属于一元强酸。试管③因为生成了过氧化钡沉淀, 不是可溶性的盐溶液,则不能证明盐酸与过氧化氢的酸性强弱,D 项错误; 答案选 D。 6.A【解析】A. 3+Fe 具有氧化性,可将二氧化硫氧化成硫酸根,本身被还原成二价铁,反应的离子方程式 是 3+2+2++ 224SO+2Fe+Ba+2H O=BaSO+2Fe+4H ,在酸性条件下 2SO 与 - 3NO 反应生成硫酸钡沉淀, 出现白色沉淀,装置 B 中若产生白色沉淀,不能说明 能将 氧化成 2- 4SO ,故 A 错误; B.配制 70% 硫酸溶液是浓硫酸加入水中稀释,需要的玻璃仪器有量筒、烧杯、玻璃棒,故 B 正确; C.为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,目的是排尽装置内的空气,故 C 正确; D.导气管直接插入溶液可能会引起装置中的压强变化较大发生倒吸,反应生成的气体可能会生成 NO,不能 被氢氧化钠溶液吸收,故 D 正确; 答案选 A。 7.C【解析】A.反应开始时,将活塞 K1 关闭,打开 K2、K3,可以将 CO2 通入到液溴中将 Br2 单质带出, A 正确; B.四溴化钛的熔点为 38.3℃,反应过程中导管温度过低,四溴化钛容易凝固,堵塞导管,B 正确; C.为了达到实验目的,不让生成的四溴化钛水解,a 应该连接四氯化碳吸收多余的 Br2,C 错误; D.反应结束后将活塞 K2、K3 关闭,打开 K1,继续通入一定时间的 CO2,有助于将装置中的四溴化钛和溴 单质排出,D 正确; 故选 C。 8.D【解析】利用装置Ⅰ(碳酸钙和稀盐酸反应)产生的气体是 CO2,用饱和碳酸氢钠溶液除去 CO2 气体 中混有 HCl 杂质;利用装置 II(石灰与氯化铵反应)产生氨气,氨气极易溶于水(注意防倒吸),且水溶液 显碱性,利于二氧化碳气体的吸收,因此实验过程先通氨气,后通二氧化碳。 A,实验时装置Ⅰ产生的气体是 CO2,应最后通入到装置Ⅳ中,故 A 错误; B.装置Ⅲ中的试剂为饱和碳酸氢钠,主要吸收 CO2 中 HCl 杂质,故 B 错误; C.实验室制得的氨气先通入到饱和食盐水中,再把已经除杂的 CO2 气体通入到饱和食盐水中,因此导管口 的连接顺序为 a-d-c-e-f-b,故 C 错误; D.实验过程中,二氧化碳、氨气和饱和食盐水共同作用生成碳酸氢钠晶体,装置Ⅳ内会出现浑浊现象,故 D 正确。 综上所述,答案为 D。 9.C【解析】A.操作①中玻璃棒起到搅拌加速溶解的作用,A 错误; B.普通锌锰电池筒内无机物质主要成分为 MnO2、NH4Cl、ZnCl2 等物质,NH4Cl、ZnCl2 易溶于水,水解显 酸性,MnO2 难溶于水,操作②是把固体与溶液分离,应是过滤,得到的滤液显酸性,B 错误; C.由图可知操作③是在坩埚内灼烧滤渣,通常把泥三角放在三角架上,再把坩埚放在泥三角上,C 正确; D.二氧化锰是黑色固体,能作双氧水的催化剂,灼烧后的滤渣能加快双氧水分解产生氧气,能证明黑色固 体是二氧化锰,所以该实验的目的不是除去滤渣中杂质,D 错误; 正确选项 C。 10.C【解析】由制备装置可知,①中浓盐酸与高锰酸钾发生氧化还原反应生成 Cl2,②为饱和食盐水可除 去 Cl2 中的 HCl,③中浓硫酸干燥 Cl2,通干燥空气可将 Cl2 排入④中,④中发生 HgO+2Cl2=HgCl2+Cl2O,因 Cl2O 与有机物或还原剂接触会发生燃烧并爆炸,则④⑤之间不用橡皮管连接,由沸点可知⑤中冷却分离, 最后出来的气体为空气及过量的 Cl2,以此来解答。 A. 制取 Cl2O 需要干燥纯净的氯气,所以②③中盛装的试剂依次是饱和食盐水和浓硫酸,以保证进入④的 Cl2 中无水,A 正确; B. 高浓度的 Cl2O 易爆炸,所以通入干燥空气可以将生成的 Cl2O 进行稀释,以减少爆炸危险,B 正确; C. 由物质的沸点可知,装置⑤用液氨降温冷却分离出 Cl2O,逸出的气体是空气及过量 Cl2,C 错误; D. Cl2O 与有机物接触会发生燃烧并爆炸,则装置④与⑤之间不能用橡皮管连接,是为了防止橡皮管燃烧和 爆炸,D 正确; 故合理选项是 C。 11.A【解析】SO2 与 BaCl2 反应产生沉淀,溶液中必存在大量的 SO32-或 SO42-,右侧 Y 型管中应能生成碱 性气体或氧化性气体,如是碱性气体,溶液中存在大量的 SO32-,则生成的沉淀可能为 BaSO3;如是氧化性 气体,溶液中可生成 SO42-,则生成的沉淀可能为 BaSO4;容器内压强增大,溶液倒吸,气体不容易导入,所 以导气管 A 的作用是保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入,由此分析解答。 A、如是碱性气体,溶液中存在大量的 SO32-,所以 e、f 两管中的试剂可以分别是浓氨水和 NaOH,产生碱 性气体氨气,故 A 正确; B、玻璃管的作用是连通大气,平衡压强,以便左右两边产生的气体顺利导入,故 B 错误; C、如果产生氨气,氨气极易溶于水,易产生倒吸,为防止倒吸,所以不能插人 BaCl2 溶液中,故 C 错误; D. SO2 与 BaCl2 不反应,氧化性气体将溶液中的亚硫酸根离子氧化成硫酸根离子,而不是将 BaSO3 氧化为 BaSO4 沉淀,故 D 错误; 综上所述,本题选 A。 12.C【解析】A.在装置 A 中加热分解草酸,B 中装有无水硫酸铜,无水硫酸铜变蓝可以证明草酸分解产 生水,故 A 正确; B.在装置 A 中加热分解草酸,装置 F 中盛水吸收升华出的草酸,若装置 D 中澄清石灰水变浑浊可以证明 产生二氧化碳,故 B 正确; C.在装置 A 中加热分解草酸,草酸易升华,且具有还原性,所以即便装置 E 中氧化铜固体变色也无法证明 是 CO 将其还原,故 C 错误; D.CO 难溶于水也不与水反应,可以用排水法收集 CO,故 D 正确; 综上所述答案为 C。 13.(1)①a→gh→bc→ef→d②冷凝并收集 ClO2(2)①SO2②生成白色沉淀③加入足量稀硝酸酸化的硝酸银溶液 ④8ClO2+5S2-+4H2O=8Cl-+5 2- 4SO +8H+;ClO2 在水中的溶解度大;剩余的 ClO2 不会产生二次污染;均被还 原为 Cl-时,二氧化氯得到的电子数是等物质的量的氯气的 2.5 倍,故二氧化氯的氧化能力强。(任写一条即 可) 【解析】 (1)①二氧化硫从 a 进入装置 B 中反应,为防止倒吸,故应在之前有安全瓶,则 a→g→h,为反应 充分,故再连接 B 装置中的 b,二氧化氯沸点较低,故在 D 中冰水浴收集,为充分冷却,便于收集,故连 接 e,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:; ②装置 D 的作用为冷凝并收集 ClO2; (2)将适量的稀释后的 ClO2 通入如图所示装置中充分反应,得到无色澄清溶液, ①取少量 I 中溶液于试管甲中,滴加品红溶液和盐酸,品红始终不褪色,说明溶液中无 SO2(或 - 3H S O 或 2- 3SO ) 生成; ②另取少量 I 中溶液于试管乙中,加入 Ba(OH)2 溶液,振荡,有 生成,硫酸根与钡离子反应生成硫酸 钡白色沉淀; ③结论为有 Cl-生成,现象为有白色沉淀生成,氯化银为不溶于酸的白色沉淀,检验氯离子,故操作为:继 续在试管乙中滴加 Ba(OH)2 溶液至过量,静置,取上层清液于试管丙内加入足量稀硝酸酸化的硝酸银溶液; ④由上述分析可知 ClO2 与 Na2S 反应有氯离子、硫酸根离子的生成,故发生的离子方程式为: 8ClO2+5S2-+4H2O=8Cl-+5 +8H+;用于处理含硫废水时,ClO2 相对于 Cl2 的优点有:ClO2 除硫效果彻底, 氧化产物硫酸根更稳定、ClO2 在水中的溶解度大、剩余的 ClO2 不会产生二次污染、均被还原为氯离子时, ClO2 得到的电子数是氯气的 2.5 倍; 14.(1)冷凝回流;NaOH(2)C(3)Br2 (4)除去有机层的水(5)间溴苯甲醛因温度过高被氧化(6) 40% 【解析】(1)冷凝管的作用是:冷凝回流,以提高原料的利用率;生成物中溴化氢为有毒气体,锥形瓶中 盛放的是 NaOH 溶液,用来吸收溴化氢;本题答案为:冷凝回流 、NaOH。 (2)步骤 1 反应过程中,为提高原料利用率,应控制温度低于溴和苯甲醛的沸点,所以温度应低于 58.8℃; 本题答案为:C。 (3)步骤 2,有机层中含有未完全反应的溴,其能与 NaHCO3 溶液反应生成可溶于水的盐,所以有机层用 10% NaHCO3 溶液洗涤,,是为了除去溴;本题答案为:溴 (4)经洗涤的有机层加入适量无水 MgSO4 固体,放置一段时间后过滤出 MgSO4•nH2O 晶体,所以步骤 3 中加 入无水 MgSO4 固体,是为了除去有机物中的水;本题答案为:除去有机层的水。 (5)采用减压蒸馏,可以降低馏出物的沸点,因此可以在较低的温度下分离出馏分,防止间溴苯甲醛因温 度过高被氧化;本题答案为:间溴苯甲醛因温度过高被氧化。 (6)依据 ,设 5.3 g 苯甲醛完全反应生成 x g 间溴 苯甲醛,则有:106:185=5.3:x,解得 x=9.25g,所以间溴苯甲醛产率 3 . 7 9 . 2 5 g g 100 % =40 ;本题答案为:40 。 15.(1)b(2)催化剂、吸水剂(3)受热均匀,便于控制温度;防止空气中水蒸气进入锥形瓶,使硼酸三 甲酯水解(4)B(OCH3)3+4NaH 240 ℃ NaBH4+3CH3ONa(5)圆底烧瓶(6)蒸馏(7)0.21 【解析】将硼酸与甲醇在圆底烧瓶中混合,然后缓慢地加入浓硫酸,振荡后加热,通过蒸馏得到硼酸三甲 酯 B(OCH3)3 和水,此时完成实验Ⅰ;将制得的硼酸三甲酯 B(OCH3)3 和 NaH 混合并加热至 240℃,生成 NaBH4 和 CH3ONa,完成实验Ⅱ;将反应所得的混合物(NaBH4 和 CH3ONa)放入索氏提取器中,用异丙胺进行萃取, 经过连续萃取,NaBH4 的异丙胺溶液进入圆底烧瓶内,CH3ONa 因不溶于异丙胺而留在索氏提取器中,然后 将圆底烧瓶内的混合液进行蒸馏,便可获得硼氢化钠,从而完成实验Ⅲ。 (1)在冷凝管中,冷却水流向都是下进上出,所以直形冷凝管冷却水应从 b 接口进入。答案为:b; (2)硼酸与甲醇在浓硫酸作用下发生取代反应,类似于酸与醇的酯化反应,所以浓硫酸的作用是催化剂、吸 水剂。答案为:催化剂、吸水剂; (3)水浴具有控温和使被加热物受热均匀的优点,所以本实验采用水浴加热,优点是受热均匀,便于控制温 度;因为硼酸三甲酯 B(OCH3)3 具有易水解的性质,所以 U 型管中试剂的作用是防止空气中水蒸气进入锥形 瓶,使硼酸三甲酯水解。答案为:受热均匀,便于控制温度;防止空气中水蒸气进入锥形瓶,使硼酸三甲 酯水解; (4)在 240℃条件下,硼酸三甲酯与氢化钠反应制取 NaBH4,同时生成 CH3ONa,该反应的化学方程式为 B(OCH3)3+4NaH 240 ℃ NaBH4+3CH3ONa。答案为:B(OCH3)3+4NaH NaBH4+3CH3ONa; (5)硼氢化钠与甲醇钠的混合液放入索氏提取器中,用异丙胺进行萃取,经过连续萃取,NaBH4 的异丙胺溶 液进入圆底烧瓶内,CH3ONa 因不溶于异丙胺而留在索氏提取器中。当萃取完全后,硼氢化钠在圆底烧瓶中。 答案为:圆底烧瓶; (6)可利用沸点的差异,实现 NaBH4 与溶剂异丙胺的分离,所以采用的方法是蒸馏。答案为:蒸馏; (7)在 NaBH4 中,H 元素显-1 价,作还原剂后,H 元素化合价由-1 价升高到+1 价,所以 1mol NaBH4 相当于 4molH2 的还原能力,从而得出 NaBH4 的有效氢含量为 4mol 2 1mol 38g/mol =0.21。答案为:0.21。 16.(1)8~8.5;4Al+18H++6NO3-=4Al3++3NO↑+3NO2↑+9H2O(2)D(3)Al(NO3)3·9H2O+9SOCl2=Al(NO3)3 +9SO2↑+18HCl↑(4)①搅拌 由于 HNO3 在反应过程中浓度不断变化,NO 和 NO2 物质的量之比不一 定是 1∶1②冷水③通入的水蒸气,冷凝回流会使浓度迅速下降,反应速率迅速变小 【解析】(1)从硝酸和铝反应的还原产物分布图来看,在 8~8.5 mo l·L-1 时,NO∶NO2=1∶1,最容易被 NaOH 吸收,对应的方程式为 NO+NO2+2NaOH===2NaNO2。对应的反应 2 的离子方程式是 4Al+18H++ 6NO ==4Al3++3NO↑+3NO2↑+9H2O。答案为:8~8.5;4Al+18H++6NO3-=4Al3++3NO↑+3NO2↑+9H2O; (2)A.NaOH 溶液,除油污和氧化膜,也要和 Al 反应,所以应适量,A 不正确; B.没有真空,也可在水浴条件下蒸发,既要防止 Al(NO3)3 的分解,也要防止发生水解,B 不正确; C.干燥器隔板下一般放硅胶吸水,打开时,要用力平推玻璃盖,C 不正确; D.制取后的 Al(NO3)3 必须密封保存,防水解,D 正确。答案为:D; (3)此反应实际是水和 SOCl2 反应,从化合价考虑,只能生成 SO2 和 HCl,反应的方程式为 Al(NO3)3·9H2O +9SOCl2=Al(NO3)3+9SO2↑+18HCl↑。答案为:Al(NO3)3·9H2O+9SOCl2=Al(NO3)3+9SO2↑+18HCl↑; (4)①通入水蒸气,不仅提高温度还起到搅拌作用;答案为:搅拌; ②由于水蒸气通入和反应,HNO3 的浓度不断变化,NO 和 NO2 的物质的量之比不是 1∶1,很难被 NaOH 吸 收干净;答案为:由于 HNO3 在反应过程中浓度不断变化,NO 和 NO2 物质的量之比不一定是 1∶1; Al(NO3)3·9H2O 晶体吸附 HNO3,合适的洗涤剂是冷水,不用有机物,有机物不能除去吸附的 HNO3;答案 为:冷水; ③从分析冷凝管是多余的方向考虑,通入水蒸气,冷凝回流会使浓度迅速下降,反应速率迅速变小。答案 为:通入水蒸气,冷凝回流会使浓度迅速下降,反应速率迅速变小。查看更多