- 2021-07-05 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】广东省清远市方圆培训学校2020届高三模拟试题精练(二十七)(解析版)
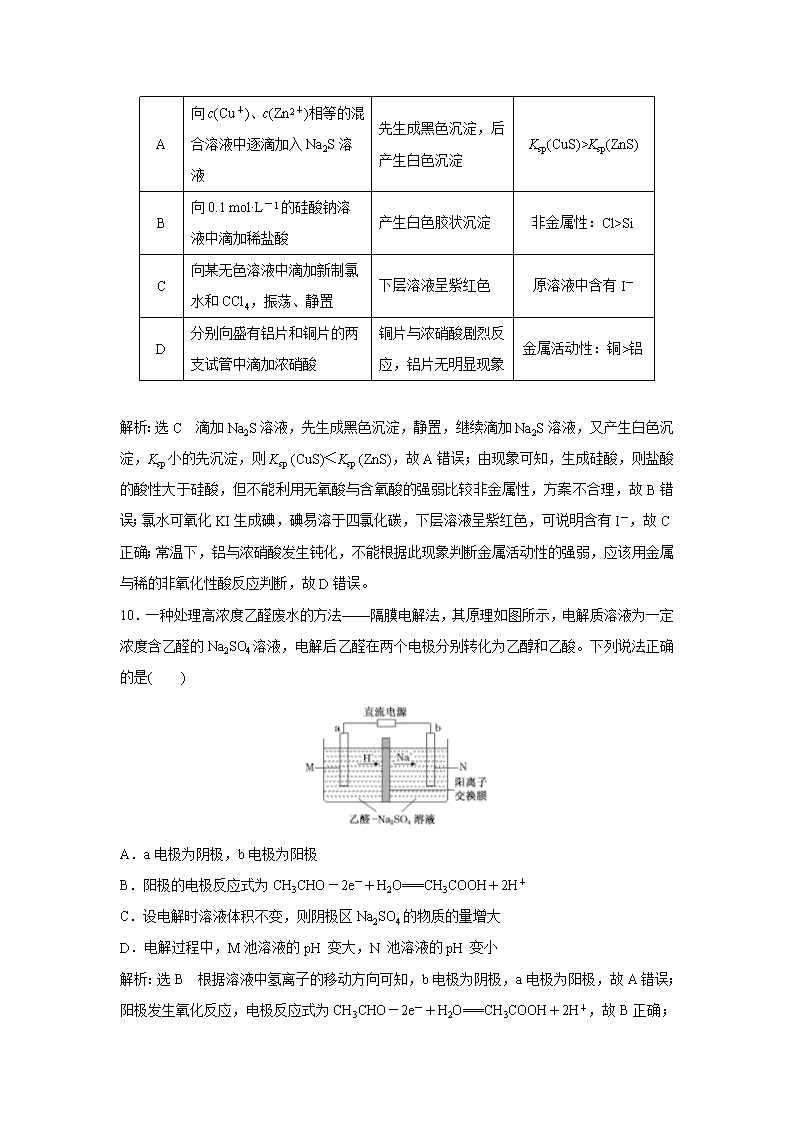
广东省清远市方圆培训学校2020届高三模拟试题精练(二十七) 可能用到的相对原子质量:C 12 O 15 V51 Fe 56 一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。) 7.化学与生活、科技、医药、工业生产均密切相关,下列有关叙述正确的是( ) A.浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品 B.我国预计在2020年发射首颗火星探测器,其重要部件太阳能电池帆板的材料是二氧化硅 C.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“强烧之,紫青烟起……云是真硝石也”,该方法应用了焰色反应 D. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒 解析:选C 浓硫酸具有强腐蚀性,但不能用于刻蚀石英制艺术品,刻蚀石英制艺术品应用氢氟酸,A项错误;太阳能电池帆板的材料是单质硅,B项错误;“强烧之,紫青烟起”,说明灼烧时焰色为紫色,该鉴别方法应用了钾元素的焰色反应,C项正确;误食重金属盐引起的人体中毒,可服用鸡蛋清或豆浆解毒,食盐水不能解毒,D项错误。 8.异丙苯()和异丙烯苯()是两种重要的化工原料,下列关于它们的说法中正确的是( ) A.两种物质都能使溴的四氯化碳溶液褪色 B.异丙苯转化为异丙烯苯的反应属于加成反应 C.两种分子中,所有的碳原子都可能共平面 D.不考虑立体异构,异丙苯的一溴代物有5 种 解析:选D 异丙苯()中没有碳碳双键,不能使溴的四氯化碳溶液褪色,故A错误;异丙苯转化为异丙烯苯的反应形成了碳碳双键,一定不属于加成反应,故B错误;异丙苯()中含有饱和碳原子,其中侧链的四个碳原子一定不在同一平面上,故C错误;异丙苯有5种不同类型的氢,故一溴代物有5种,故D正确。 9.根据下列实验操作和现象,得出的结论正确的是( ) 选项 实验操作 现象 结论 A 向c(Cu+)、c(Zn2+)相等的混合溶液中逐滴加入Na2S溶液 先生成黑色沉淀,后产生白色沉淀 Ksp(CuS)>Ksp(ZnS) B 向0.1 mol·L-1的硅酸钠溶液中滴加稀盐酸 产生白色胶状沉淀 非金属性:Cl>Si C 向某无色溶液中滴加新制氯水和CCl4,振荡、静置 下层溶液呈紫红色 原溶液中含有I- D 分别向盛有铝片和铜片的两支试管中滴加浓硝酸 铜片与浓硝酸剧烈反应,铝片无明显现象 金属活动性:铜>铝 解析:选C 滴加Na2S溶液,先生成黑色沉淀,静置,继续滴加Na2S溶液,又产生白色沉淀,Ksp小的先沉淀,则Ksp (CuS)<Ksp (ZnS),故A错误;由现象可知,生成硅酸,则盐酸的酸性大于硅酸,但不能利用无氧酸与含氧酸的强弱比较非金属性,方案不合理,故B错误;氯水可氧化KI生成碘,碘易溶于四氯化碳,下层溶液呈紫红色,可说明含有I-,故C正确;常温下,铝与浓硝酸发生钝化,不能根据此现象判断金属活动性的强弱,应该用金属与稀的非氧化性酸反应判断,故D错误。 10.一种处理高浓度乙醛废水的方法——隔膜电解法,其原理如图所示,电解质溶液为一定浓度含乙醛的Na2SO4溶液,电解后乙醛在两个电极分别转化为乙醇和乙酸。下列说法正确的是( ) A.a电极为阴极,b电极为阳极 B.阳极的电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+ C.设电解时溶液体积不变,则阴极区Na2SO4的物质的量增大 D.电解过程中,M池溶液的pH 变大,N 池溶液的pH 变小 解析:选B 根据溶液中氢离子的移动方向可知,b电极为阴极,a电极为阳极,故A错误;阳极发生氧化反应,电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+ ,故B正确;阴极发生还原反应,电解时溶液体积不变,溶液中SO的物质的量不变,则阴极区Na2SO4的物质的量不变,故C错误;电解过程中,M 池中a为阳极,电极反应式为CH3CHO-2e-+H2O===CH3COOH+2H+,溶液的pH 减小,故D错误。 11.设NA表示阿伏加德罗常数的值,下列说法错误的是( ) A.11 g DO所含的电子数为5NA B.常温下,5.6 g铁与浓硝酸反应转移的电子数为0.3NA C.甲烷燃料电池正极消耗标准状况下11.2 L O2时,电路中通过的电子数为2NA D.3H2(g)+N2(g)2NH3(g) ΔH=-92 kJ·mol-1,当放出热量为92 kJ时,转移电子数为6NA 解析:选B DO的摩尔质量为22 g·mol-1,故11 g DO的物质的量为0.5 mol,而1个DO中含10个电子,故0.5 mol DO所含的电子数为5NA,故A正确;常温下,铁与浓硝酸发生钝化,所以5.6 g铁与足量浓硝酸反应转移的电子数不是0.3NA,故B错误; 标准状况下11.2 L O2的物质的量为0.5 mol,电池工作时,1 mol O2 得4 mol电子,则电路中通过的电子数为0.5×4NA=2NA,故C正确;放出92 kJ的热量,说明有1 mol N2反应,转移电子数为6NA,故D正确。 12.X、Y、Z、M 是原子序数依次增大的四种短周期元素,已知X 原子的核外电子数等于其所在周期数,Y 原子的最外层电子数是内层电子数的2倍,M 是地壳中含量最高的金属元素,Z 和M 形成的化合物在盐酸和氢氧化钠溶液中均能溶解。下列说法中正确的是( ) A.金属M 制品具有较强的抗腐蚀能力,说明M 的金属活动性较差 B.X、Y、Z 三种元素可以形成X2YZ、X2YZ2、X2YZ3等多种化合物 C.X、Z 可以形成原子个数之比为1∶1和2∶1的两种离子化合物 D.X 和Y 形成化合物的熔、沸点一定低于Y 和Z 形成的化合物 解析:选B X、Y、Z、M 是原子序数依次增大的四种短周期元素,已知X 原子的核外电子数等于其所在周期数,X为H元素;Y 原子的最外层电子数是内层电子数的2倍,Y为C元素;M 是地壳中含量最高的金属元素,M为Al元素;Z 和M 形成的化合物在盐酸和氢氧化钠溶液中均能溶解,说明该化合物为氧化铝,则Z为O元素。铝制品具有较强的抗腐蚀能力,是因为铝表面容易形成致密的氧化物薄膜,故A错误;H、C、O 三种元素可以形成H2CO为甲醛、H2CO2为甲酸、H2CO3等多种化合物,故B正确;水和双氧水均为共价化合物,故C错误;H和C形成化合物的熔、沸点不一定低于C 和O形成的化合物,如碳原子数较多的烃可能为液体或固体,熔沸点比二氧化碳高,故D错误。 13.25 ℃时,将浓度均为0.1 mol·L-1、体积不同的HA溶液与BOH 溶液混合,保持溶液的总体积为100 mL,溶液的体积与混合液pH 的关系如图所示。下列说法正确的是( ) A.V1表示HA 溶液的体积,V2表示BOH 溶液的体积 B.Ka(HA)和Kb(BOH) 的数量级相等,均为10-6 C.y点时,c(B+)=c(A-)=c(OH-)=c(H+) D.x、y、z 所示三点对应水的电离程度:y>x=z 解析:选D 根据图像,当HA溶液与BOH 溶液等体积混合时,溶液的pH=7,随着V1的增大,溶液的pH逐渐增大,说明V1表示BOH溶液的体积,则V2表示HA 溶液的体积,故A错误;根据图像,当HA溶液与BOH 溶液等体积混合时,溶液的pH=7,说明溶液显中性,说明Ka(HA)和Kb(BOH)相等,0.1 mol·L-1 HA溶液pH=3,则Ka(HA)=≈10-5,故B错误;y点时,溶液的pH=7,说明溶液显中性,是因为阴阳离子的水解程度相同,因此c(B+)=c(A-)>c(OH-)=c(H+),故C错误;x、z 点酸或碱的浓度相等,因为Ka(HA)和Kb(BOH) 相等,对水的电离的抑制程度相等,y点盐的浓度最大,对水的电离的促进程度最大,三点对应水的电离程度:y>x=z,故D正确。 二、非选择题(共58分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。) (一)必考题:共43分。 26.从工业废钒中回收金属钒既避免污染环境又有利于资源综合利用。某工业废钒的主要成分为V2O5、VOSO4和SiO2等,下图是从废钒中回收钒的一种工艺流程: (1)为了提高“酸浸”效率,可以采取的措施有________________________________(填两种)。 (2)“还原”工序中反应的离子方程式为_____________________________________________。 (3)“沉钒”得到NH4VO3沉淀,需对沉淀进行洗涤,检验沉淀完全洗净的方法是____________ ___________________________________________________________________。 (4)写出流程中铝热反应的化学方程式_____________________________________________。 (5)电解精炼时,以熔融NaCl、CaCl2和VCl2为电解液(其中VCl2以分子形式存在),粗钒应与电源的________(填“正”或“负”)极相连,阴极的电极反应式为________________________。 (6)为预估“还原”工序加入H2C2O4的量,需测定“酸浸”液中VO的浓度。每次取25.00 mL“酸浸”液于锥形瓶用a mol·L-1(NH4)2Fe(SO4)2标准溶液和苯代邻氨基苯甲酸为指示剂进行滴定(其中VO→VO2+),若三次滴定消耗标准液的体积平均为b mL,则VO的浓度为________g·L-1(用含a、b的代数式表示)。 解析:(1)增大浸出效率的方法:将工业废钒粉碎,充分搅拌,适当提高温度;(2)“还原”工序中加入草酸为典型还原剂,可将V从+5价还原为+4价,对应的离子方程式为2VO+H2C2O4+2H+===2VO2++2CO2↑+2H2O;(3)KClO3反应后被还原为Cl-,对沉淀进行洗涤即是为了除去Cl-等离子;(4)由铝热反应原理知10Al+3V2O56V+5Al2O3;(5)类比电解精炼铜,粗钒应作为阳极电解,即与正极相连;阴极上发生还原反应,电极反应式为VCl2+2e-===V+2Cl-;(6)由得失电子关系可知:VO ~(NH4)2Fe(SO4)2,故n(VO)=n[(NH4)2Fe(SO4)2]=ab×10-3mol,所以VO的浓度为= g·L-1。 答案:(1) 将工业废钒粉碎;充分搅拌;适当提高温度 (2)2VO+H2C2O4+2H+===2VO2++2CO2↑+2H2O (3)取最后一次洗涤液,加入用稀硝酸酸化的AgNO3溶液,若无沉淀,则已洗净 (4)10Al+3V2O56V+5Al2O3 (5)正 VCl2+2e-===V+2Cl- (6) 27.碳酸亚铁可用于治疗缺铁性贫血。实验室里先制得硫酸亚铁,后将硫酸亚铁与碳酸氢铵反应制得碳酸亚铁(Fe2++2HCO===FeCO3↓+CO2↑+H2O)。实验装置如图所示(部分夹持仪器略去)。回答下列问题: (1)配制溶液所用的蒸馏水必须先除去溶解的氧气,具体方法是________________________ __________________________________________。 (2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是____________________。 (3)装置B中的NH4HCO3需过量的原因______(填字母)。 a.除去FeSO4溶液中残留的硫酸 b.Fe2+充分转化为FeCO3 c.NH4HCO3溶解度比较大 d.NH4HCO3受热分解损失 (4)碳酸亚铁在潮湿的空气中逐渐被氧化生成氢氧化铁和一种气体,反应的化学方程式为____________________________________________________________________。 (5)有同学提出该实验可用FeSO4与Na2CO3反应制取FeCO3,经查阅:0.1 mol·L-1Na2CO3溶液pH约为11.6;25 ℃时,Ksp(FeCO3)=3.1×10-11,Ksp[Fe(OH)2]=4.9×10-17,向10 mL 0.1 mol·L-1Na2CO3溶液中滴加0.1 mol·L-1 FeSO4溶液,先析出的沉淀是________。 (6)NaHCO3与NH4HCO3均可作为Fe2+的沉淀剂,但更常用NH4HCO3,理由是________________________________________。(写出一点即可) 解析:(1)除去水中溶解的氧气方法为将蒸馏水煮沸后迅速冷却;(2)A中Fe与稀硫酸反应生成FeSO4和H2,关闭K3,打开K2,利用压强差使其与NH4HCO3溶液混合;(3)装置B中的NH4HCO3需过量,既可除去FeSO4溶液中残留的硫酸,也可让Fe2+充分反应,同时NH4HCO3受热易分解,过量可防止其损失;(4)由题可知生成的气体为CO2,故化学方程式为4FeCO3+6H2O+O2===4Fe(OH)3+4CO2;(5)析出FeCO3沉淀时c(Fe2+)===3.1×10-10 mol·L-1,Na2CO3溶液pH约为11.6,则c(OH-)=10-2.4 mol·L-1,析出Fe(OH)2沉淀时c(Fe2+)===4.9×10-12.2 mol·L-1<3.1×10-10 mol·L-1,故Fe(OH)2先沉淀;(6)比较两者区别,NH能水解显酸性,H+存在可减少副产物Fe(OH)2产生。 答案:(1)将蒸馏水煮沸后迅速冷却 (2)关闭K3,打开K2 (3)abd (4)4FeCO3+6H2O+O2===4Fe(OH)3+4CO2 (5)Fe(OH)2 (6)NH能水解产生H+,降低溶液pH,可减少副产物Fe(OH)2产生 28.烟气(主要成分为NOx、SO2、CO2、CO)的排放对环境的影响很大,工业上常用以下方法处理烟气。 (1)NO可以经O3预处理后用CaSO3悬浊液吸收。O3 氧化NO的主要反应的热化学方程式如下: NO(g)+O3(g)NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1 NO(g)+O2(g)NO2(g) ΔH=-58.2 kJ·mol-1 依据以上热化学方程式,可知3NO(g)+O3(g)3NO2(g) ΔH=________kJ·mol-1。 (2)工业上常用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液。室温下,某NaHSO3溶液的pH=5,该溶液中由水电离出来的H+浓度为________;通过计算和必要文字解释NaHSO3溶液呈酸性的原因(已知H2SO3的Ka1=1.54×10-2,Ka2=1.02×107)_______________________ ____________________________________________________________________。 (3)用氨水可以吸收CO2,经可逆反应生成NH4HCO3。相同条件下CO2的脱除率随温度变化的关系如图所示。应用平衡移动原理分析CO2在40~45 ℃脱除率降低的原因可能是_____________________________________________。 (4)利用活性炭还原法可处理NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1 ℃时,不同时间测得各物质的浓度如表所示: 时间/min 浓度/(mol·L-1) 物质 0 10 20 30 40 50 NO 1.00 0.68 0.50 0.50 0.60 0.60 N2 0 0.16 0.25 0.25 0.30 0.30 CO2 0 0.16 0.25 0.25 0.30 0.30 ①10~20 min内,NO的平均反应速率v(NO)=________;该温度下反应的平衡常数K=________。 ②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_____________________________________________________。 解析:(1)将已知热化学方程式依次编号为①、②,根据盖斯定律,由①+2×②得3NO(g)+O3(g)===3NO2(g) ΔH=-317.3 kJ·mol-1。(2)NaHSO3溶液的pH=5,氢离子浓度为10-5mol·L-1,该溶液中由水电离出来的H+浓度为 mol·L-1=1.0×10-9mol·L-1。(4)①10~20 min内,NO的平均反应速率v(NO)=(0.68-0.50)mol·L-1÷10 min=0.018 mol·L-1·min-1;在该温度下,反应的平衡常数K===0.25。②30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是缩小容器的体积或增大反应物浓度等。 答案:(1)-317.3 (2)1.0×10-9mol·L-1 HSOH++SO,Ka2=1.02×10-7;HSO+H2OH2SO3+OH-,Kh==,可见Ka2大于Kh,即HSO的电离程度大于其水解程度,NaHSO3溶液呈酸性 (3)氨水吸收CO2的反应为放热反应,在40~45 ℃时升高温度,平衡逆向移动,使CO2脱除率降低 (4)①0.018 mol·L-1·min-1 0.25 ②缩小容器的体积(或其他合理答案) (二)选考题:共15分。请考生从2道化学题中任选一题作答。如果多做则按所做的第一题计分。 35.磷及其化合物与人们的健康和生产生活密切相关。请回答下列问题: (1)基态磷原子价电子轨道表示式为________,其第一电离能比硫的________(填“大”或“小”)。 (2)羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为________,PO的空间构型为________,该化合物所含元素电负性最大的是________。 (3)P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键数目是________。 (4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为________,其为________元酸,原因是____________________________。 (5)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如下图所示: 由图推知该多磷酸钙盐的通式为________。 (6)磷化硼是一种超硬耐磨涂层材料,晶胞如图所示,其密度为ρ g·cm-3,设NA是阿伏加德罗常数的值,则磷原子的配位数为________,晶胞参数为________pm。 解析:(2)—OH中氧原子的价层电子对数为=4,所以氧原子按sp3方式杂化;PO中P原子孤电子对数==0,没有孤电子对,故PO为正四面体结构;根据元素的非金属性越强,元素的电负性越大,Ca、P、O、H四种元素中O的非金属性最强,O元素的电负性最大;(3)P原子最外层有5个电子,能够与3个O原子形成3对共用电子对,O原子最外层有6个电子,可以与2个P原子形成2对共用电子对,要使分子中每个原子都达到8电子稳定结构,其结构式为,可见分子中含有的共价键为12个;(4)亚磷酸与NaOH溶液发生酸碱中和反应只生成Na2HPO3和NaH2PO3两种盐,羟基H原子能电离产生H+,说明H3PO3分子中含有2个—OH,它属于二元酸,由于P最外层有5个电子,则H3PO3的结构式为;(5)由图推知该多磷酸钙盐最小的重复单元是CaP2O6,所以该多磷酸钙盐的通式为(CaP2O6)n;(6)根据晶体结构可知每个B原子被四个距离相等且最近的P原子包围,每个P原子被四个距离相等且最近的B原子包围,所以P原子的配位数是4;在一个晶胞中含有的P原子数目:8×+6×=4,在一个晶胞中含有的B原子数目:4×1=4,即1个晶胞中含有4个BP,晶胞的质量m== g,由于晶胞密度为ρ g·cm-3,所以晶胞的体积为== cm3,所以晶胞参数为 cm=×1010 pm。 答案:(1) 大 (2)sp3 正四面体形 O(或氧元素) (3)12 (4) 二 一个H3PO3分子中只有两个羟基,含氧酸羟基上的氢易电离 (5)(CaP2O6)n (6)4 ×1010 36.有机物F是一种香料,其合成路线如图所示: (1)A的名称为________,步骤Ⅵ的反应类型为________,试剂X的结构简式为____________________________________________________________________。 (2)步骤Ⅰ的反应试剂和条件分别为________________、_______________。 (3)步骤Ⅱ反应的化学方程式为_____________________________________。 (4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有________种,其中核磁共振氢谱峰面积比为6∶2∶2∶1∶1的分子的结构简式为___________________________________。 (5)依据题中信息,完成以为原料制取的合成路线图。___________________________________________________________________________ 合成路线图示例:CH2===CH2CH3CH2BrCH3CH2OH 解析:结合流程图和A的分子式可知A为,由B→C的反应条件可知C中含有羟基,又C与E在浓H2SO4、加热条件下生成F,由F的结构简式可确定C和E分别为;由C的结构简式可逆推出B为卤代烃,如B为。结合信息ⅱ和E的结构简式可知D和X分别为和。(4)根据题中限定条件可知苯环上含有两个取代基,其中一个为酚羟基,另一个取代基可以为—CH2CH2CH2OOCH或或,每组中的2个取代基在苯环上均有邻位、间位和对位3种位置关系,故共有15种满足条件的同分异构体。其中核磁共振氢谱峰面积比为6∶2∶2∶1∶1的同分异构体的结构简式为。 (5) 先发生催化氧化反应生成醛,再进一步氧化生成羧酸,结合信息ⅰ,再与Cl2、红磷在加热条件下作用即可生成,据此可完成合成路线的设计。 答案:(1)甲苯(或甲基苯) 取代(或酯化)反应 CH3CHClCOOH (2)Cl2(或Br2) 光照 (3)C6H5—CH2Cl+NaOHC6H5—CH2OH+NaCl查看更多