- 2021-07-05 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年吉林省长春市第五中学、田家炳实验中学高二上学期期初联考化学试题(无答案)
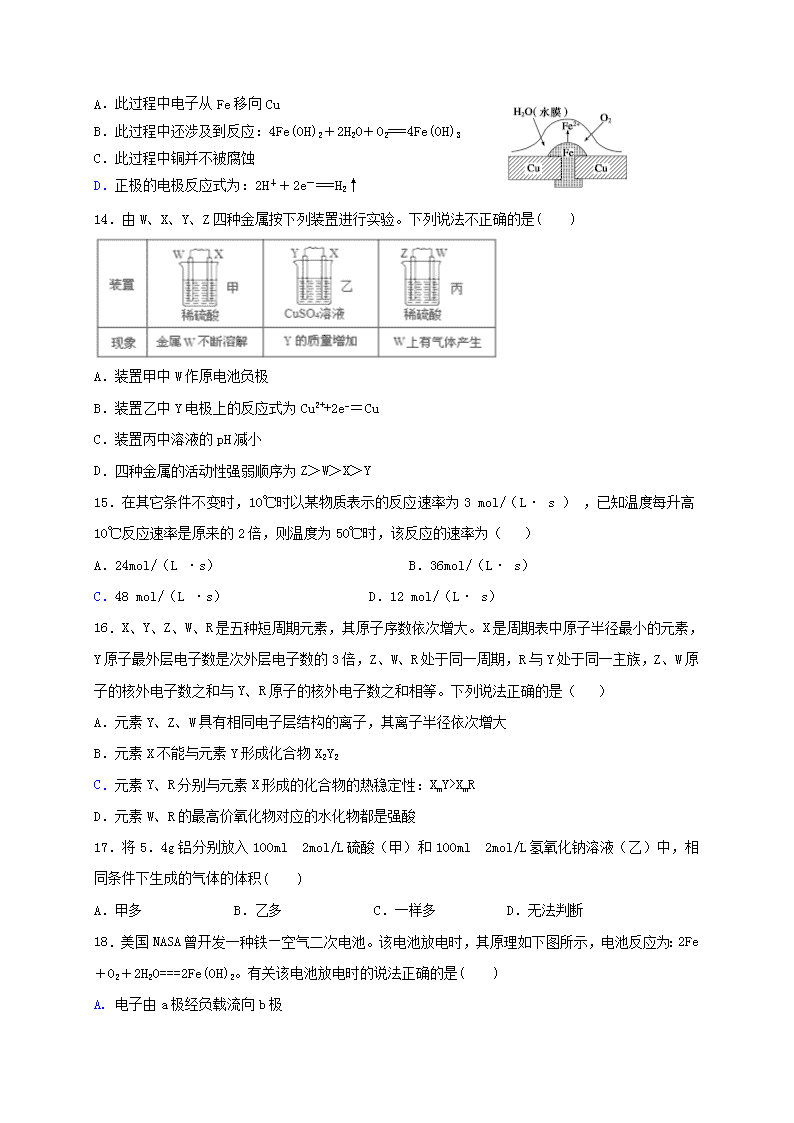
2017—2018学年度上学期高二年级期初考试 长 春 市 第 五 中 学 长春市田家炳实验中学 化 学 试 卷 命题人:战鹰 审题人: 李雪 考试时间: 90分钟 满分: 100分 可能用到的相对原子质量: H-1 C-12 N- 14 O-16 S-32 Cl-35.5 Na-23 Mg-24 Al-27 Zn-65 第I卷(选择题,共50分) 一、选择题(每题只有一个正确选项,1-10每题2分,11-20每题3分,共50分) 1.紫薯中含有被誉为“抗癌大王”的硒元素.已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( ) A. 10 B. 34 C. 44 D. 78 2.100mL 6 mol / L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的 ( ) A.硫酸钾溶液 B.醋酸 C.氯化钠(固体) D.盐酸 3.下列事实能用同一原理解释的是( ) A.S与Fe、Cu反应均生成低价态硫化物 B.NH4HCO3晶体、固体I2受热均能变成气体 C.SO2、Cl2均能使品红溶液褪色 D.ClO- 、S2-、H+均不能大量共存于同一溶液 4.某元素最高价含氧酸的化学式是H2RO4,则该元素的气态氢化物化学式可表示为( ) A. HR B. H2R C. RH4 D. 不确定 5.为除去括号内的少量杂质,所选用的试剂或方法不正确的是( ) A.Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 B.NaHCO3溶液(Na2CO3),通入过量的CO2气体 C.CO2气体(HCl气体),通过饱和的Na2CO3溶液 D.SiO2(H2SiO3),加热 6.下列说法正确的是( ) A.往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+ B.用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 C.浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性 D.SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 7.为了检验某FeCl2溶液是否变质,可向溶液中加入( ) A.NaOH溶液 B.铁片 C.KSCN溶液 D.石蕊溶液 8.下列关于物质性质变化的比较,不正确的是( ) A.原子半径大小: Na > S > O B.还原性强弱: F- > Cl- > Br- > I- C.碱性强弱: KOH > NaOH > LiOH D.气态氢化物稳定性: HBr < HCl < HF 9.某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( ) A.正极为Cu,负极为Fe,电解质溶液为FeCl3 B.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)3 C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 10.某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“ · ”代表一种元素,其中O点代表氢元素.下列说法中错误的是( ) A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 C. B元素是图中金属性最强的元素 D. B、C最高价氧化物的水化物可以相互反应 11.在一定温度下,2A(s)+2B(g)⇌C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( ) A.混和气体的密度不随时间而变化 B.容器内的压强不随时间而变化 C.A的质量不再变化 D.平衡混和气体的平均相对分子质量不再改变 12.由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如图所示,下列说法正确的是( ) A.纳米碳管是一种无机化合物 B.纳米碳管与石墨互为同位素 C.纳米碳管中碳原子间以共价键结合 D.0.12 g纳米碳管中含有6.02×l022个碳原子 13.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( ) A.此过程中电子从Fe移向Cu B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3 C.此过程中铜并不被腐蚀 D.正极的电极反应式为:2H++2e-===H2↑ 14.由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是( ) A.装置甲中W作原电池负极 B.装置乙中Y电极上的反应式为Cu2++2e−=Cu C.装置丙中溶液的pH减小 D.四种金属的活动性强弱顺序为Z>W>X>Y 15.在其它条件不变时,10℃时以某物质表示的反应速率为3 mol/(L· s ) ,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为( ) A.24mol/(L ·s) B.36mol/(L· s) C.48 mol/(L ·s) D.12 mol/(L· s) 16.X、Y、Z、W、R是五种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一主族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( ) A.元素Y、Z、W具有相同电子层结构的离子,其离子半径依次增大 B.元素X不能与元素Y形成化合物X2Y2 C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR D.元素W、R的最高价氧化物对应的水化物都是强酸 17.将5.4g铝分别放入100ml 2mol/L硫酸(甲)和100ml 2mol/L氢氧化钠溶液(乙)中,相同条件下生成的气体的体积( ) A.甲多 B.乙多 C.一样多 D.无法判断 18.美国NASA曾开发一种铁—空气二次电池。该电池放电时,其原理如下图所示,电池反应为:2Fe+O2+2H2O===2Fe(OH)2。有关该电池放电时的说法正确的是( ) A. 电子由a极经负载流向b极 B. b极为电池负极 C. a极质量不变 D. 由电能转变为化学能 19.向盛有100mLNH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下: 下列说法正确的是( ) A.NH4Al(SO4)2的电离方程式为:NH4Al(SO4)2NH4++Al3++2SO42﹣ B.反应过程中SO42﹣的浓度始终保持不变 C.m点反应的离子方程式:NH4++OH﹣═NH3•H2O D.由图象可知所滴NaOH溶液的浓度为0.1mol•L﹣1 20.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是CH4+10OH--8e-===CO+7H2O;通入O2的另一极,其电极反应式是2O2+4H2O+8e-===8OH-。下列叙述不正确的是( ) A.通入CH4的电极为负极 B.燃料电池工作时,溶液中的OH-向负极移动 C.正极发生氧化反应 D.该电池使用一段时间后应补充KOH 第II卷(非选择题,共50分) 二、填空题 21.(10分)如图水槽中试管内有一枚铁钉,放置数天观察。 (1) 若试管内液面下降,则发生________腐蚀,电极反应: 负极:__________________________________________; 正极:___________________________________________。 (2)若试管内液面上升,则发生________腐蚀,电极反应: 负极:__________________________________________; 正极:__________________________________________。 22.(10分)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。 (1)等量金刚石和石墨完全燃烧 (填“金刚石”或“石墨”)放出热量更多,表示石墨燃烧热的热化学方程式 。 (2)在通常状况下,金刚石和石墨 (填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式 。 (3)12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量 。 23.(14分) A、B、C、D四种短周期元素的原子序数依次增大。A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子数之比为4:1。由A、C组成两种化合物乙和丙均为液态,乙中A、C原子数之比为1:1,丙中为2:1;由D、C组成的两种化合物丁和戊均为固态,丁中原子数比为1:1,戊中2:1。 (1)写出化学式:丙 丁 二者属于什么类型的化合物:丙 丁 (共价化合物、离子化合物) (2)用电子式表示化合物“甲”的形成过程 甲 (3) 写出B元素的最高价氧化物跟丁反应的化学方程式 (4)写出丙和丁反应的离子方程式: _______________________________________________________ 24.(16分)为探究足量锌与浓硫酸的反应,某研究小组进行如下实验。取足量锌与浓H2SO4充分反应,对于制得的气体,有同学认为可能混有杂质。 (1)研究小组所制得的气体中混有的主要杂质气体可能是:__________(填分子式)。产生这种结果的主要原因是: (用化学方程式和必要的文字加以说明) (2)为证实相关分析,该化学小组的同学设计实验,组装了如图装置,对所制了的气体进行探究. [] ①装置C中加入的试剂是:__________;装置D中加入的试剂是:__________. ②装置F中加入的试剂是:__________;U型管G的作用为:______________. ③有同学认为A、B间应增加图中的甲装置,该装置的作用为:______________. ④证明反应生成SO2和H2的实验现象是_________________________________ ____________________________________________________________________。 查看更多