- 2021-07-05 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省太和中学2019-2020学年高二下学期期末考试化学试题 Word版含答案
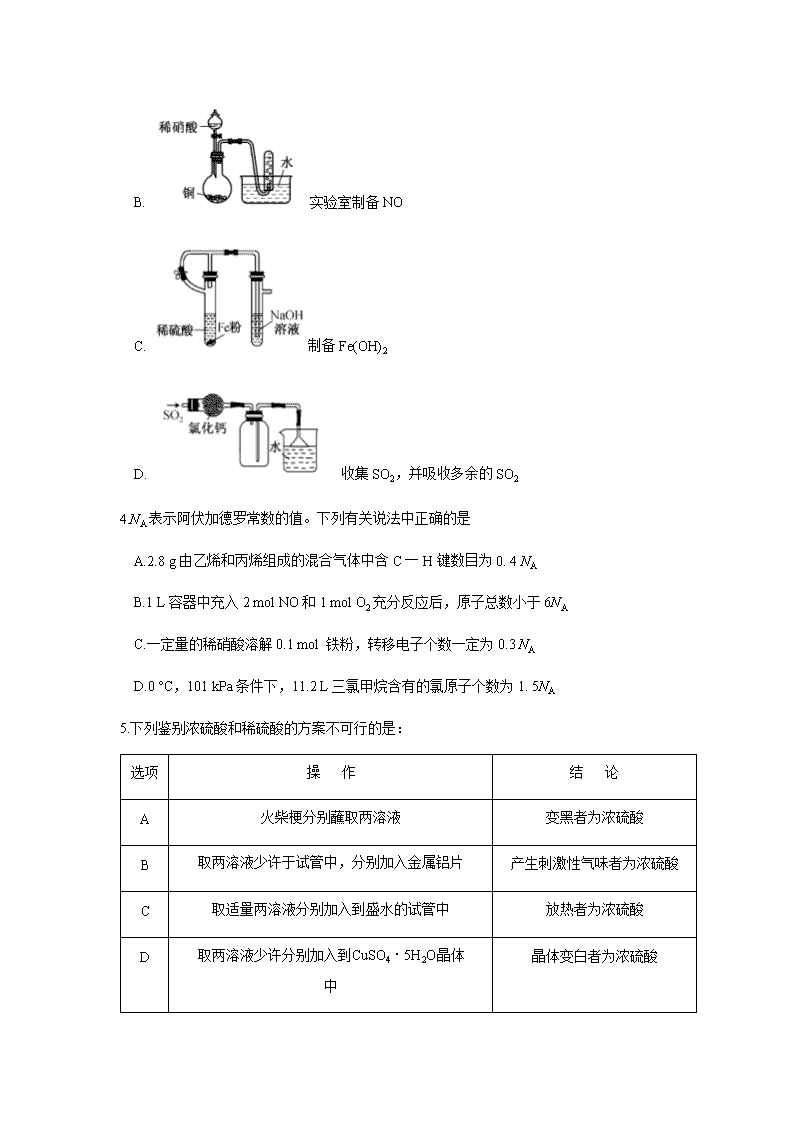
太和中学2018级高二年级期末考试 化学试题 考生注意: 1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。 2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。 3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。 4.本卷命题范围:高考范围。 5.可能用到的相对原子质量:H 1 C12 O 16 S32 Mn 55 Zn 65 一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.早在西汉时期的《淮南万毕术》中描述了“曾青得铁,则化为铜”,该语句涉及的化学反应类型是 A.化合反应. B.置换反应 C.分解反应 D.复分解反应 2.下列有关物质应用的说法中不正确的是 A.利用纯碱可清洗油污 B.应用镁粉制造照明弹 C.石油分馏可得到乙烯、丙烯 D.75%的乙醇溶液可作消毒剂 3.下列图示实验正确的是 A. 溶液配制时进行定容 B. 实验室制备NO C. 制备Fe(OH)2 D. 收集SO2,并吸收多余的SO2 4.NA表示阿伏加德罗常数的值。下列有关说法中正确的是 A.2.8 g由乙烯和丙烯组成的混合气体中含C一H键数目为0. 4 NA B.1 L容器中充入2 mol NO和1 mol O2充分反应后,原子总数小于6NA C.一定量的稀硝酸溶解0.1 mol 铁粉,转移电子个数一定为0.3 NA D.0 °C,101 kPa条件下,11.2 L三氯甲烷含有的氯原子个数为1. 5NA 5.下列鉴别浓硫酸和稀硫酸的方案不可行的是: 选项 操 作 结 论 A 火柴梗分别蘸取两溶液 变黑者为浓硫酸 B 取两溶液少许于试管中,分别加入金属铝片 产生刺激性气味者为浓硫酸 C 取适量两溶液分别加入到盛水的试管中 放热者为浓硫酸 D 取两溶液少许分别加入到CuSO4·5H2O晶体中 晶体变白者为浓硫酸 6.下列说法正确的是 A.煤的气化液化、海水制溴等过程中都包含化学变化 B.可通过电解熔融MgCl2来制取金属镁,也能通过电解熔融AlCl3来制取金属铝 C.铝热剂、胆矾、水玻璃、双氧水、明矾均为混合物 D. Na2O2、MgCl2、NaOH、SiO2 均为含共价键的离子化合物 7.下列关于有机物的说法中正确的是 A.甲烷、三氯甲烷在光照条件下均可与Cl2发生取代反应 B.乙烯、聚乙烯.乙醇均能使酸性KMnO4溶液褪色 C.氨基酸、淀粉和纤维素都属于天然高分子化合物 D.分子式为C8H10的芳香烃有3种同分异构体(不含立体异构) 8.氯化碘(ICl)是一种卤素互化物,与氢气存在如下反应:2ICl(s)+ H2(g)=2HCl(g)+ I2(s) ΔH=-218 kJ·mol -1,该反应实际上分两步进行: ①H2(g)+ ICl(g)=HI(g)十HCl(g)(慢反应) ②HI(g)+ ICl(s)=I2(s)+ HCl( g)(快反应) 下列说法中正确的是 A. ICl与水发生非氧化还原反应生成HI B.两步反应的活化能之和等于-218 kJ·mol 1 C.总反应速率的快慢由反应①决定 D.加入催化剂将影响最终总反应的反应热 9.下列实验设计正确,且能达到预期目的的是 选项 实验内容 实验目的 A 常温下用洁净的玻璃棒蘸取次氯酸钠溶液,滴在pH 试纸上,测定次氯酸钠溶液pH 值 验证次氯酸是弱酸 B 加热 NaHCO3和 NH4C1固体的混合物 除去混合物中的 NH4C1 C 将Fe(NO3)2 溶于适量硝酸中,然后加水稀释 配制一定浓度的Fe(NO3)2溶液 D 向二氧化硫的水溶液中滴入几滴石蕊试液 检验二氧化硫水溶液具有酸性 10.下列反应的离子方程式书写正确的是 A.盐酸中滴加少量碳酸钠溶液:CO32-+2H+= H2O+CO2 ↑ B.氯化铝溶液中加入过量的氨水:A13+ +4NH3·H2O=AlO2- +4NH4++2H2O C. NH4 HSO4和少量的氢氧化钠溶液反应:NH4+ +OH-=NH3·H2O D.向H2O2溶液中加入MnO2:2H2O2 +4H+ +MnO2=O2↑+Mn2+ +4H2O 11.下列叙述中正确的是 A.石蕊、酚酞、甲基橙均能用作中和滴定的指示剂 B.25°C时,pH=12的溶液一定是碱溶液 C.等温下,AgCl在浓度均为0.1 mol·L-1的NaCl溶液、MgCl2溶液中Ksp相等 D.等温下,饱和溶液的导电能力, BaCO3强于BaSO4,则Ksp(BaCO3)查看更多