- 2021-07-05 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年西藏自治区拉萨中学高二第一次月考化学试题(Word版)
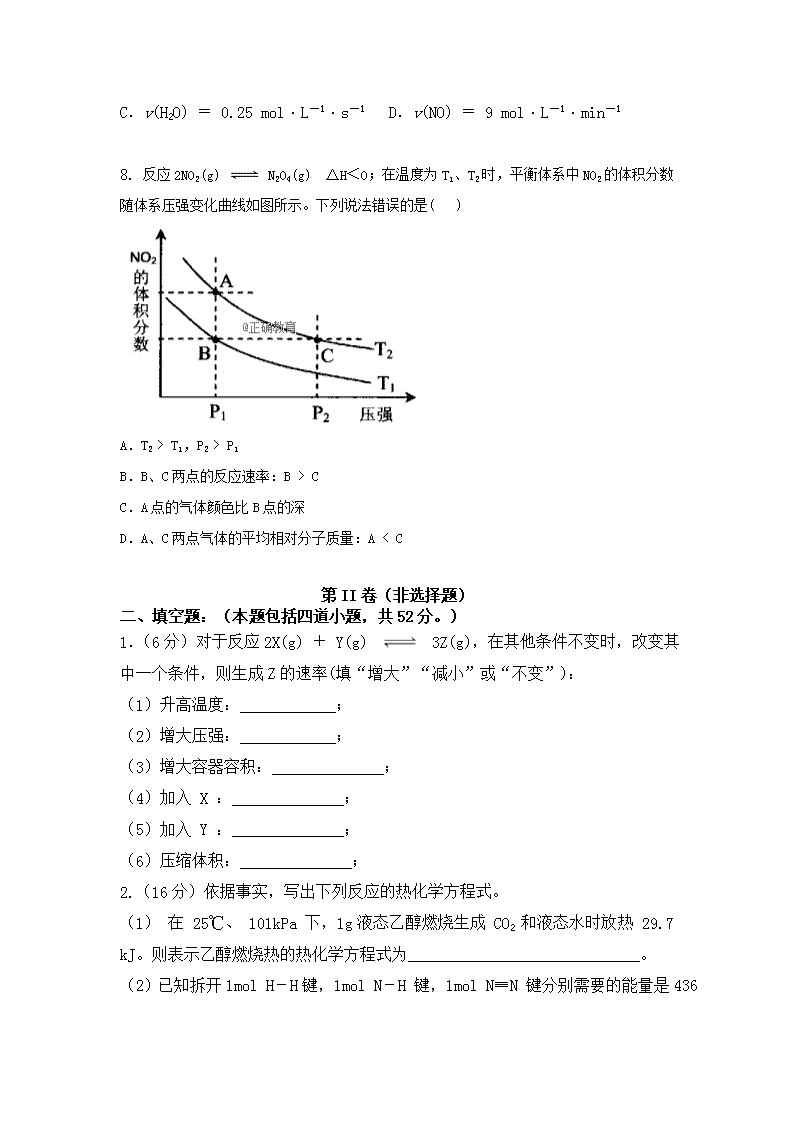
2018-2019学年拉萨中学高二第一次月考化学试卷 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Na-23 Fe—56 Cu—64 Zn—65 Pb—207 第Ⅰ卷(选择题,共40分) 一、 选择题:(每题6分,共48分,每小题只有一个选项符合题意。) 1. 未来新能源的特点是资源丰富,使用时对环境无污染或很少污染,且有些可以再生,下列全部属于新能源的是一组是( ) ①天然气 ②煤 ③核能 ④石油 ⑤海洋能 ⑥地热能 ⑦风能 ⑧氢能. A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外 2. 下列变化过程,属于放热反应的是( ) ①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4 稀释 ④固体NaOH溶于水 ⑤ H2 在 Cl2 中燃烧 ⑥食物腐败 A. ②⑤⑥ B. ②③④ C. ①③⑤ D. ②③④⑤⑥ 3. 下图为 H2 与 O2 反应生成 H2O(g) 的能量变化示意图: 下列有关叙述不正确的是 ( ) A.1 mol H2 分子断键需要吸收436 kJ的能量 B.H2(g) + 1/2O2(g) = H2O(g) ΔH = -241.8 kJ/mol C.反应物的总能量高于生成物的总能量 D.形成化学键释放的总能量比断裂化学键吸收的总能量小 4. 某温度下,在一恒容容器中进行如下反应 N2 + 3H2 2NH3 ,下列情况一定能说明反应 已达到平衡的是( ) ①容器内压强不随时间而变化 ②单位时间内,有 3mol H2 反应,同时有 2mol NH3 生成 ③气体的密度不随时间而变化 ④单位时间内,有 1mol N2 生成,同时有 2mol NH3 生成 ⑤用 N2、 H2、NH3 表示的该反应的化学反应速率之比为 1∶3∶2 ⑥气体的平均摩尔质量不随时间而变化 A.①④⑥ B.①②③ C.②③⑤ D.①②⑥ 5.下列有关热化学方程式及其叙述正确的是( ) A.氢气的燃烧热为285.5 kJ/mol,则水电解的热化学方程式为: 2H2O(l) = 2H2(g)+ O2(g) △H= +285.5 kJ/mol B.lmol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为: CH4(g) + O2(g) = CO2(g) + H2O(l) △H = -445 kJ/mol C.己知2C(s) + O2(g) = 2CO(g) △H = -221 kJ·mol-1,则C(S)的燃烧热为 -110.5 kJ/mol D.HF与NaOH 溶液反应:H+(aq) + OH-(aq) = H2O(l) △H = -57.3 kJ/mol 6. 已知: ① H2(g) + O2(g) H2O(g);ΔH1= a kJ·mol-1 ② 2H2(g) + O2(g) 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g) + O2(g) H2O(l);ΔH3= c kJ·mol-1 ④ 2H2(g) + O2(g) 2H2O(l);ΔH4= d kJ·mol-1 下列关系正确的是( ) A.c < a < 0 B.b > a > 0 C.2a = d < 0 D.2c = d > 0 7.对于反应 4NH3 + 5O2 === 4NO + 6H2O ,下列为4种不同情况下测得的反应速率,其中能表明该反应进行最快的是( ) A.v(NH3) = 0.2 mol·L-1·s-1 B.v(O2) = 14 mol·L-1·min-1 C.v(H2O) = 0.25 mol·L-1·s-1 D.v(NO) = 9 mol·L-1·min-1 8. 反应2NO2(g) N2O4(g) ΔH<0;在温度为T1、T2时,平衡体系中NO2的体积分数随体系压强变化曲线如图所示。下列说法错误的是( ) A.T2 > T1,P2 > P1 B.B、C两点的反应速率:B > C C.A点的气体颜色比B点的深 D.A、C两点气体的平均相对分子质量:A < C 第II卷(非选择题) 二、 填空题:(本题包括四道小题,共52分。) 1.(6分)对于反应2X(g) + Y(g) 3Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”): (1)升高温度:____________; (2)增大压强:____________; (3)增大容器容积:______________; (4)加入 X :______________; (5)加入 Y :______________; (6)压缩体积:______________; 2.(16分)依据事实,写出下列反应的热化学方程式。 (1) 在 25℃、 101kPa 下,1g液态乙醇燃烧生成 CO2 和液态水时放热 29.7 kJ。则表示乙醇燃烧热的热化学方程式为_____________________________。 (2)已知拆开1mol H-H键,1mol N-H 键,1mol N≡N 键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2 反应生成NH3 的热化学方程式为____________________________ 。 (3)① P4(白磷,s) + 5O2(g)= P4O10(s) ΔH = -2983.2 kJ/mol ② P(红磷,s) + 5/4O2(g)= 1/4 P4O10(s)ΔH = -738.5 kJ/mol 则白磷转化为红磷的热化学方程式为___________________。相同状况下,能量较低的是_______ 。 (4)③ C(s) + O2(g) = CO(g) ΔH = -110.5 kJ·mol-1 ④ C(s) + O2(g) = CO2(g) ΔH = -393.5 kJ·mol-1 则燃烧36g C(s)生成CO2,放出的热量为____________。写出CO燃烧的热化学方程式________________________。 3.(15分)某温度下,在2L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在 t1min 时到达平衡,依图所示: ⑴ ① 该反应的化学方程式是____________ ② 该反应的平衡常数是___________ ③ 在t1min时,该反应达到了__________状态,下列可作为判断反应已达到该状态的是________ __(填序号)。 A.X、Y、Z的反应速率相等 B.X、Y的物质的量浓度不再改变 C.生成 3mol Y 的同时生成 1mol Z D.生成 1mol Z 的同时生成 2mol X ⑵ ①若上述反应中X、Y、Z分别为 NH3 、H2 、N2 ,且已知1mol氨气分解成氮气和氢气要吸收46 kJ的热量,则由H2、N2 合成NH3 反应的热化学反应方程式为: ___________ ___。 ②甲、乙两位同学讨论放热反应和吸热反应:甲说加热后才能发生的化学反应是吸热反应;乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是_ ____同学。 4.(15分)用50mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: (1)观察实验装置,图中尚缺少的一种玻璃用品是__________。 (2)烧杯间填满碎纸条的作用是_________________________。 (3)大烧杯上如不盖硬纸板,测得的中和热数值 __________(填“偏大、偏小、无影响”)。 (4)实验中改用55mL 0.50 mol/L盐酸与55mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________ (填“相等、不相等”)。 (5)在中和热测定实验中,若用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热的数值会________ (填“偏大”、“偏小”“不变”)原因是_______ 。 拉萨中学高二年级(2020届)九月月考化学试卷参考答案 2018年09月 一、选择题(下列每题只有一个正确选项,每小题6分,共48分) 题号 1 2 3 4 5 6 7 8 答案 B A D A B A A B 二、填空题(共52分) 12. (6分,每空1分) (1)增大 (2)增大 (3)降低 (4)增大 (5)增大 (6)增大 13.(16分) (1)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=–1366.2kJ·mol-1 (3分) (2)N2(g)+3H2(g) = 2NH3(g) ΔH=-92kJ·mol-1 (3分) (3)P4(白磷,s)=4 P(红磷,s)ΔH=-29.2 kJ/mol ( 3分) 红磷 (2分) (4)1180.5kJ (2分) CO(g)+ O2(g)=CO2(g) ΔH=-283.0kJ·mol-1 (3分) 14.(15分) (1) ① 2X3Y+Z (3分) ② 0.27 (3分) ③ 平衡 (2分) BD(2分) ⑵ ① N2(g)+3H2(g) 2NH3(g) △H= -92kJ / mol(3分) ② 乙(2分) 15.(15分,每空2分) (1) 环形玻璃搅拌棒 (2分) (2) 减少热量损失起到保温的作用 (2分) (3)偏小(2分) (4)不相等 (2分) 相等 (2分) (5)偏小 (2分) 氨水为弱碱会发生电离,电离吸热。 (3分)查看更多