- 2021-07-05 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省合肥市第六中学2019-2020学年高一下学期学情检测化学试题
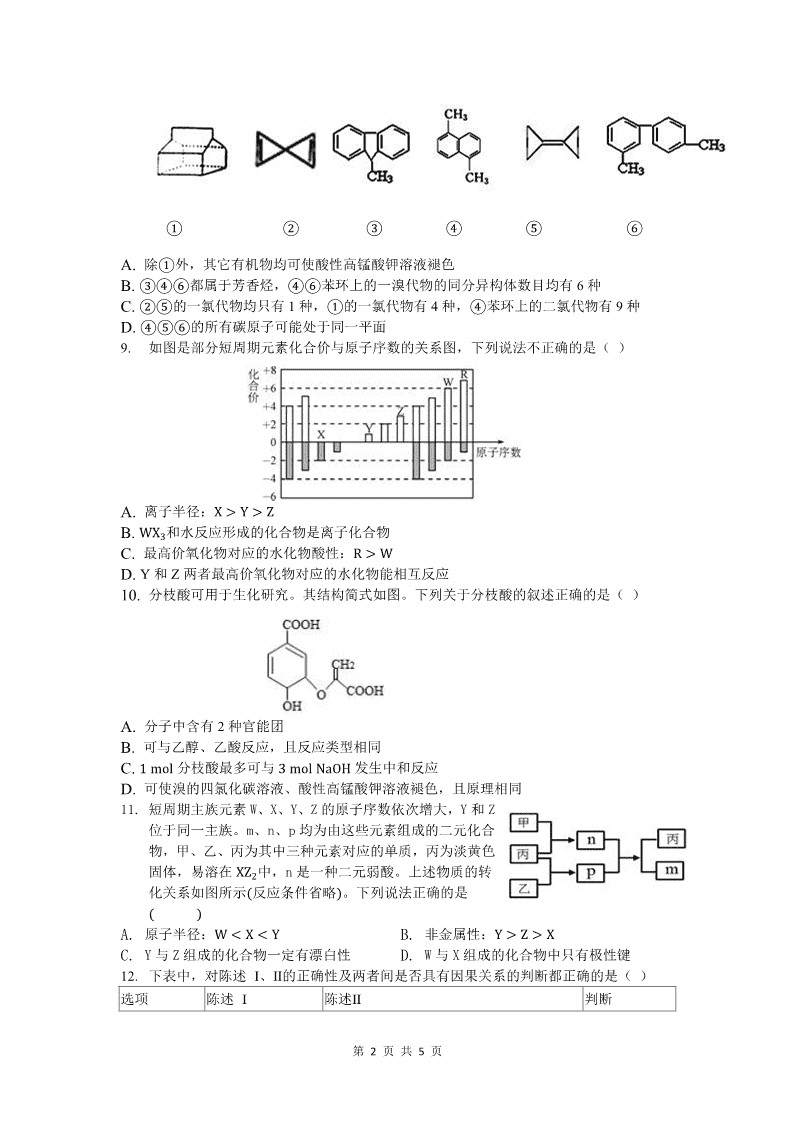
第 1 页 共 5 页 2019 级高一年级线上线下教学衔接监测(化学) (考试时间:80 分钟 试卷分值:100 分) 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Ca:40 Fe:56 Zn:65 Ag:108 Cu:64 Ba:137 一、选择题(1-4 每题 3 分,其余每题 4 分,共 52 分) 1. 化学与生产、生活、社会密切相关。下列叙述错误的是( ) A. 还原铁粉能用作食品抗氧化剂 B. 夜空中光柱的形成属于丁达尔效应 C. 做实验剩余的金属钠不得直接丢弃在废液缸中 D. 燃煤中加入 CaO 可减少温室气体的排放 2. 下列各有机物的命名中,正确的是( ) A. 1, 5 − 二甲苯 B. 2,2,4,4--四甲基辛烷 C. 2--甲基 − 5 --乙基己烷 D. 3 − 丁烯 3. 设 NA 为阿伏伽德罗常数的值,下列说法正确的是( ) A. 标准状况下, 22.4L 己烯和氯气发生加成反应,消耗氯气分子数为 NAB. 1molN2 和足量的 H2 在一定条件下充分反应,转移电子为 6NAC. 0.1molC100H202 分子中共含有 30.1NA 个共价键 D. 向含有 0.4mol 的浓盐酸中加入足量的 MnO2 充分反应后可产生氯气的分子数为 NA4. 根据元素周期表判断,下列叙述不正确的是( ) A. 周期表中第七周期共有 32 种元素 B. 周期表中共有 18 个列,其中形成化合物种类最多的在第 14 列 C. 除过渡元素外周期表中最外层电子数相同的元素都位于同一族中 D. L 层电子为奇数的所有元素所在族的序数与该元素原子的 L 层电子数相等 5. 分子式为 C7H16 的烷烃中,含有 4 个甲基的同分异构体数目是( ) A. 4 种 B. 3 种 C. 2 种 D. 5 种 6. 下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。 在上述实验过程中,所涉及的三次分离操作分别是( ) A. ① 蒸馏 ② 过滤 ③ 分液 B. ① 分液 ② 蒸馏 ③ 蒸馏 C. ① 蒸馏 ② 分液 ③ 分液 D. ① 分液 ② 蒸馏 ③ 结晶、过滤 7. 四种主族元素的离子 aX m+ 、 bY n+ 、 cZ n− 和 dR m− (a 、b、c、d 为元素的原子序 数 ) ,它们具有相同的电子层结构,若 m > n ,则下列叙述正确的是( ) ①a − b = n − m ② 元素的原子序数: a > b > c > d ③ 元素非金属性: Z > R ④ 最高价氧化物对应的水化物的碱性: X > YA. 只有 ③ B. ①②③④ C. ①②③ D. ②③8. 对下列有机物的判断错误的是( ) 第 2 页 共 5 页 ① ② ③ ④ ⑤ ⑥A. 除 ① 外,其它有机物均可使酸性高锰酸钾溶液褪色 B. ③④⑥ 都属于芳香烃, ④⑥ 苯环上的一溴代物的同分异构体数目均有 6 种 C. ②⑤ 的一氯代物均只有 1 种, ① 的一氯代物有 4 种, ④ 苯环上的二氯代物有 9 种 D. ④⑤⑥ 的所有碳原子可能处于同一平面 9. 如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( ) A. 离子半径: X > Y > ZB. WX3 和水反应形成的化合物是离子化合物 C. 最高价氧化物对应的水化物酸性: R > WD. Y 和 Z 两者最高价氧化物对应的水化物能相互反应 10. 分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( ) A. 分子中含有 2 种官能团 B. 可与乙醇、乙酸反应,且反应类型相同 C. 1 mol 分枝酸最多可与 3 mol NaOH 发生中和反应 D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 11. 短周期主族元素 W、X、Y、Z 的原子序数依次增大,Y 和 Z 位于同一主族。m、n、p 均为由这些元素组成的二元化合 物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色 固体,易溶在 XZ2 中,n 是一种二元弱酸。上述物质的转 化关系如图所示 ( 反应条件省略 ) 。下列说法正确的是 ( )A. 原子半径: W < X < Y B. 非金属性: Y > Z > XC. Y 与 Z 组成的化合物一定有漂白性 D. W 与 X 组成的化合物中只有极性键 12. 下表中,对陈述 I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( ) 选项 陈述 I 陈述Ⅱ 判断 第 3 页 共 5 页 A KSCN 溶液可检验 Fe 3+ 待测液先后滴入足量氯水和几滴 KSCN 溶 液后变为血红色,证明待测液含 Fe 3+ I 对; Ⅱ对;无 B SO2 具有还原性 SO2 通入 Ba(NO3)2 溶液中可见白色沉淀生 成 I 对; Ⅱ对;有 C NO2 和溴蒸气都呈 红棕色 用水可鉴别 NO2 和溴蒸气 I 对; Ⅱ错;无 D 反应物比例不同可 导致产物不同 Na 与 O2 反应可能生成 Na,也可能生成 Na2O2 I 对; Ⅱ对;有 13. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和 NO2 、 N2O4 、NO 的混合气体,这些气 体与 1.68L O2( 标准状况 ) 混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸 铜溶液中加入 5mol � L −1 NaOH 溶液至 Cu 2+ 恰好完全沉淀,则消耗 NaOH 溶液的体积是( ) A. 60 mL B. 45 mL C. 30 mL D. 15 mL 14.有机物 X、Y 分子式不同,它们只含有 C、H、O 元素中的两种或三种。实验表明:将 X 和 Y 不论以任何体积比例混合,只要其物质的量之和不变,完全燃烧时消耗氧气的质量和 生成水的质量均不变。则 X、Y 可能是( ) A. C2H4 、 C2H6O B. C2H2 、 C6H6C. CH2O 、 C3H6O2 D. CH4 、 C2H4O2二、简答题(共 4 题,48 分) 15.Ⅰ.下列各物质中, (1)互为同位素的是__________, (2)互为同系物的是_______, (3)互为同分异构体的是________。 A.金刚石与石墨 B.12C 与 l4C C.CH2=CH2 与 (环丙烷) D. 与 E. 与 F.2-甲基丁烷与新戊烷 G.C3H8 和 C8H18 Ⅱ已知:A 的产量通常用来衡量一个国家的石油化工水平,现以 A 为主要原料合成化合物 E, 其合成路线如图所示。回答下列问题: (1)写出 A 物质的官能团名称:____________________。 (2)反应④的化学方程式为_______________________________,反应类型:________。 (3)某学习小组设计物质 B 催化氧化的实验装置如下,根据图 2 装置回答问题。 第 4 页 共 5 页 ①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。 A.Na2O2 B.KCl C.Na2CO3 D.MnO2 ②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为 _______________________________。 16.A~F 六种元素中,除 F 外其他均为短周期元素,它们的原子结构或性质如下表所示。 元素 原子结构或性质 A 其形成的一种同位素原子在考古中可推测化石的年代 B 与 A 同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 C 地壳中含量最多的元素 D D 原子的内层电子数是最外层电子数的 5 倍 E 其单质主要存在于火山口附近 F 生活中常见的银白色金属,它有两种常见的氯化物,且相对分子质量相差 35.5 (1)F 在元素周期表中的位置是__________;A 与 C 形成的化合物 AC2 的电子式是 __________。 (2)下列事实能证明 C 和 E 的非金属性强弱的是________(填序号)。 ①常温下,C 的单质呈气态,E 的单质呈固态 ②C 的最简单气态氢化物的稳定性强于 E 的最简单气态氢化物的稳定性 ③C 与 E 形成的化合物中,E 呈正价 ④E 的氢化物的沸点高于 C 的氢化物的沸点 (3)由 A、B、C 和氢元素四种元素所形成的阴、阳离子数目之比为 1∶1 的离子化合物是 ________(填化学式),它与足量 NaOH 溶液在加热时反应的离子方程式为________________ 17.Ⅰ.某工厂的工业废水中含有大量的FeSO4 和较多的Fe3+和Cu2+。为了减少污染并变废为宝, 工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图: (1)检验此废水中的 Fe2+,实验室中可以选用的试剂是________。 (2)写出加入过量物质 1 后,发生的所有反应的离子方程式___________________________。 (3)操作 3 指的是__________ Ⅱ.工业上冶炼铝的原料是铝土矿( 主要成分是 Al2O3,杂质为 Fe2O3、FeO、SiO2 等)。某研究 小组设计的提纯 Al2O3 的方案如下: 第 5 页 共 5 页 (1)加盐酸后过滤得到的滤渣的主要成分是________(填化学式)。 (2)加入过量 NaOH 溶液过滤后,若滤渣中 Fe(OH)2 也被氧化,写出其被氧化的化学方程式 ______________。 (3)滤液 2 中加入过量盐酸能否得到沉淀 A,请说明理由 _________________________。 18.某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回 答下列问题: (1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器 b 的名称为________; 实验过程中,装置 B 中观察到的现象是______________________________; (2)装置 A 中还会产生 CO2 气体,请写出产生 CO2 的化学方程式:____________________ ____________________________________________________。 (3)装置 C 中有白色沉淀生成,甲同学认为白色沉淀含碳酸钡和硫酸钡,乙同学认为不含碳 酸钡,只有硫酸钡。 你同意谁的观点,并说明理由: ___________________________________________________ 请写出生成硫酸钡,发生的离子反应方程式: ___________________________________________________查看更多