2018-2019学年黑龙江省高二上学期“三区一县”四校联合考试化学试题(Word版)
2018-2019学年第一学期“三区一县”四校联合考试高二化学试题
可能用到的原子量:H -1,C- 12,N-14,O -16, S-32 ,Cu-64 ,Ag- 108
一、选择题(本题包括30个小题,每小题只有一个正确选项,每题2分,共60分)
1、 下列做法中用到物质氧化性的是 ( )
A.明矾净化水 B.纯碱除去油污 C.臭氧消毒餐具 D.食醋清洗水垢
2、 下列说法中,不正确的是 ( )
A.反应热指的是反应过程中放出的热量 B.中和反应都是放热反应
C.伴随着能量变化的过程不一定是化学反应 D.单液原电池中化学能转化成电能和热能
3、 在恒温、体积为2 L的密闭容器中进行反应:2A(g) 3B(g)+C(g),若反应物在前20 s由
3 mol降为1.8 mol,则前20 s的平均反应速率为 ( )
A.v(B)=0.03 mol•L-1•s-1
B.v(B)=0.045 mol•L-1•s-1
C.v(C)=0.03 mol•L-1•s-1
D.v(C)=0.06 mol•L-1•s-1
4、 一定条件下,反应:2A(g)+2B(g) 3C(g)+D(g)在容积不变的密闭容器中进行,达到化学平衡状态的标志是 ( )
A.单位时间内生成2n mol B,同时消耗3n mol C B.容器内压强不随时间变化
C.混合气体的密度不随时间变化 D.单位时间内生成2n mol A,同时生成n mol D
5、 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 ( )
A.用惰性电极电解饱和食盐水时,阳极的电极反应为2Cl--2e-===Cl2↑
B.酸性氢氧燃料电池的正极电极反应为2H2O+O2+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为Cu-2e-===Cu2+
D.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
6、 下列事实能说明亚硝酸是弱电解质的是 ( )
①25 ℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1
A.①②③ B.②③④ C.①④ D.①②④
7、 将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是 ( )
A.C(H+) B.Ka(HF) C. D.
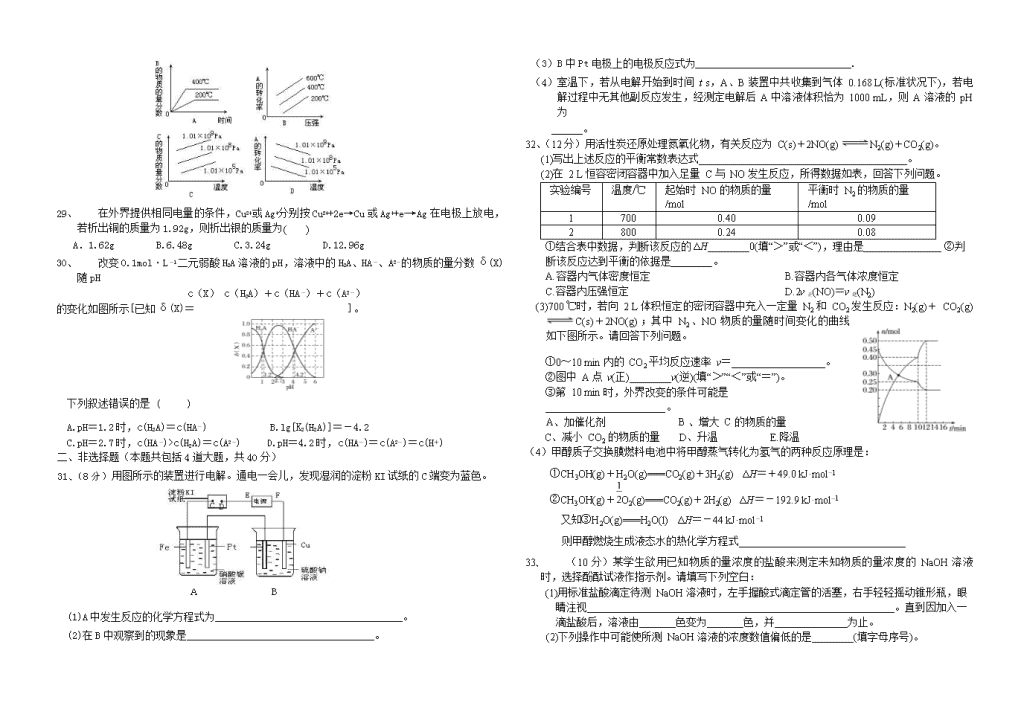
8、 下列物质的水溶液因为水解使溶液呈酸性的是( )
A CH3COOH B NaHSO4 C NH4Cl D CH3COOH
9、 下列化学原理的应用,主要用沉淀溶解平衡原理解释的是 ( )
①热纯碱溶液洗涤油污的能力强 ②误将钡盐[BaCl2、Ba(NO3)2]当作食盐混用后,常用0.5% 的Na2SO4溶液解毒 ③溶洞、珊瑚的形成 ④碳酸钡不能作“钡餐”而硫酸钡则能 ⑤泡沫灭火器灭火的原理
A.②③④ B.①②③ C.③④⑤ D.①②③④⑤
10、 下列热化学方程式中的反应热能表示燃烧热的是(a、b、c、d均大于0) ( )
A. C(s)+O2(g)===CO(g) ΔH=-ckJ·mol-1
B.CH3CH2OH(l)+O2(g)===CH3CHO(l)+H2O(l) ΔH=-bkJ·mol-1
C. C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-akJ·mol-1
D.NH3(g)+ O2(g)===NO(g)+H2O(g) ΔH=-dkJ·mol-1
11、 将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)
+Y(g) 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
A.升高温度,X的体积分数减小
B.增大压强(缩小容器体积),Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
12、 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为
2H2+O2===2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-===4OH-
C.每转移0.1 mol电子,便消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
13、 100℃时,Kw=1.0×10-12,若100℃某溶液中的c(H+)=1.0×10-7mol/L,则该溶液( )
A.呈中性 B.呈碱性 C.呈酸性 D.c(OH-)/ c(H+)=2
14、 对于有气体参加的反应,一定能使化学反应速率加快的因素是 ( )
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度
⑤缩小容积 ⑥增大容器内的压强
A.②③ B.②③④⑥ C.②④⑤ D.②④⑥
15、 实验室有下列试剂,其中必须用带橡胶塞的试剂瓶保存的是 ( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液
⑥澄清石灰水 ⑦浓HNO3 ⑧浓H2SO4
A.①⑥⑦ B.①②③④⑥ C.①②③⑥⑦⑧ D.⑤⑦⑧
16、 下列描述中,不.符.合.生产实际的是 ( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在铁件上电镀铜,用铜作阳极
1、 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol·L-1的NaA和NaB混合溶液中,下列排序正确的是 ( )
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
2、 常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是 ( )
1
9
、
已
知
:
锂
离
子
电
池
的
总
反
应
为
L
i
x
C
+
L
i
1
-
x
C
o
O
2
C
+
L
i
C
o
O
2
,
锂
硫
电
池
的
总
反
应
为
L
i
2
S
。
有
关
上
述
两
种
电
池
说
法
正
确
的
是
(
)
2Li+S
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.上图表示用锂离子电池给锂硫电池充电
20、 在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是 ( )
A.图中a点的值为0.15 B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小 D.平衡时A2的转化率为62.5%
21、 如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是 ( )
A.④>②>①>③ B.②>①>③>④ C.④>②>③>① D.③>②>④>①
22、 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10 分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF。
由此可判断下列叙述中不正确的是 ( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序为 HF>HNO2>HCN
D.K(HCN)
0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 24、已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ·mol-1、1411.0kJ·mol-1和1366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1 C.-330 kJ·mol-1 D.+330 kJ·mol-1
25、 在相同温度下(T=500 K) SO2 与O2发生反应生成SO3,有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1 g SO2和1 g O2,乙容器中充入2 g SO2和2 g O2,下列叙述中错误的是 ( )
A.化学反应速率:乙>甲 B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲 D.平衡时SO2的体积分数:乙>甲
26、 下列说法不正确的是( )
A. 焓变是一个与反应能否自发进行有关的因素,多数的能自发进行的反应都是放热反应。
B. 在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大。
C. 一个反应能否自发进行取决于该反应放热还是吸热
D. 一个反应能否自发进行,与焓变和熵变的共同影响有关
27、 在 25 ℃某稀溶液中,由水电离产生的 c(OH-)=10-13 mol·L-1。有关该溶液的叙述正确的是( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性 C.该溶液的 pH 一定为 1 D.该溶液的 pH 可能为 13
28、 对于反应 2A(g)+B(g)2C(g),△H<0, 下列图象正确的是( )
25、 在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为( )
A.1.62g B.6.48g C.3.24g D.12.96g
26、 改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH
c(X) c(H2A)+c(HA-)+c(A2-)
的变化如图所示[已知δ(X)= ]。
下列叙述错误的是 ( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
二、非选择题(本题共包括4道大题,共40分)
31、(8分)用图所示的装置进行电解。通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。
A B
(1)A中发生反应的化学方程式为____________________________________。
(2)在B中观察到的现象是____________________________________。
(3) B中Pt电极上的电极反应式为______________________________.
(4) 室温下,若从电解开始到时间 t s,A、B 装置中共收集到气体 0.168 L(标准状况下),若电解过程中无其他副反应发生,经测定电解后 A 中溶液体积恰为 1000 mL,则 A 溶液的 pH 为
______。
32、(12 分)用活性炭还原处理氮氧化物,有关反应为 C(s)+2NO(g) N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式________________________________________。
(2)在 2 L 恒容密闭容器中加入足量 C 与 NO 发生反应,所得数据如表,回答下列问题。
实验编号
温度/℃
起始时 NO 的物质的量/mol
平衡时 N2 的物质的量/mol
1
700
0.40
0.09
2
800
0.24
0.08
①结合表中数据,判断该反应的ΔH________0(填“>”或“<”),理由是_______________ ②判断该反应达到平衡的依据是________。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v 正(NO)=v 逆(N2)
(3)700 ℃时,若向 2 L 体积恒定的密闭容器中充入一定量 N2 和 CO2 发生反应:N2(g)+ CO2(g)C(s)+2NO(g) ;其中 N2、NO 物质的量随时间变化的曲线如下图所示。请回答下列问题。
①0~10 min 内的 CO2 平均反应速率 v=__________________。
②图中 A 点 v(正)________v(逆)(填“>”“<”或“=”)。
③第 10 min 时,外界改变的条件可能是_______________________。
A、加催化剂 B 、增大 C 的物质的量
C、减小 CO2 的物质的量 D、升温 E.降温
(4)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式________________________________
33、 (10 分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的 NaOH 溶液时,选择酚酞试液作指示剂。请填写下列空白:
(1)用标准盐酸滴定待测 NaOH 溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视___________________________________________________________。直到因加入一滴盐酸后,溶液由_______色变为_______色,并______________为止。
(2)下列操作中可能使所测 NaOH 溶液的浓度数值偏低的是________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B 碱式滴定管未用待测液润洗就直接注入待测液
C.滴定前盛放 NaOH 溶液的锥形瓶用蒸馏水洗净后没有干燥
D.酸式滴定管在滴定前有气泡,放出液体后气泡消失
E.碱式滴定管在开始有气泡,放出液体后气泡消失
F.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3) 若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL;所用盐酸溶液的体积为________mL。
33、 (10 分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为 0.1 mol·L-1 的下列五种钠盐溶液的 pH 如表所示:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述几种钠盐的阴离子,结合氢离子能力最强的是________(填离子符号),根据表中数据判断,将浓度均为 0.01 mol·L-1的下列四种酸的溶液分别稀释 100 倍,pH 变化最大的是________(填字母)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
①用 200 mL 1 mol·L-1 的氢氧化钠溶液吸收标准状况下的 2.24 L 二氧化碳,所得溶液中各离子的浓度由大到小的顺序为_______________________________________________。
②已知几种离子开始沉淀时溶液的 pH 如下表所示:
离子
Fe2+
Cu2+
Mg2+
pH
7.6
5.2
10.4
当向含有相同浓度的 Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,________(填离子符号)先沉淀;要使 0.2 mol·L-1 的硫酸铜溶液中铜离子沉淀较为完全(使铜离子的浓度降至原来的千分之一 ) ,则应向溶液中加入氢氧化钠溶液使溶液 pH = ________ 。
{Ksp[Cu(OH)2]=2×10-20}
2018-2019学年第一学期“三区一县”四校联合考试高二化学试题答案
1-5 CABDA 6-10 CDCAC
11-15CDBCB 16-20AACBB
21-25ABBAD 26-30CDDBD
31(8 分)
(1)4AgNO3 + 2H2O 4Ag + O2↑+4HNO3 2分
(2)铜片溶解,气体生成、蓝色沉淀 各1分
(3)2H++2e-=H2↑ 1分
(4)2 2分
32 (12分)
(1)c( Nc22)( ·Nc(O)CO2) 1 分
(2 )① > 计算 700 ℃和 800 ℃的平衡常数 K1<K2,所以ΔH>0 各 1 分
② AB 2 分
(3)① 0.01 mol·L-1·min-1 2 分
② > 1 分
③ AD 2 分
(4)CH3OH(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1 2 分
33 (10分)
(1)锥形瓶内溶液颜色的变化 浅红色或红色 无色 ,在半分钟内不变红每空各 1 分
(2)BEF 3 分
(3) 0.00 26.10 26.10 各 1 分
34(10)每空各 2 分
(1) CO32-- C
(2)①c(Na+)>c(CO23-)>c(OH-)>c(HCO3-)>c(H+)
②Cu2+ 6