- 2021-07-05 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第三章水溶液中的离子平衡4难溶电解质的溶解平衡真题导思含解析 人教版选修4
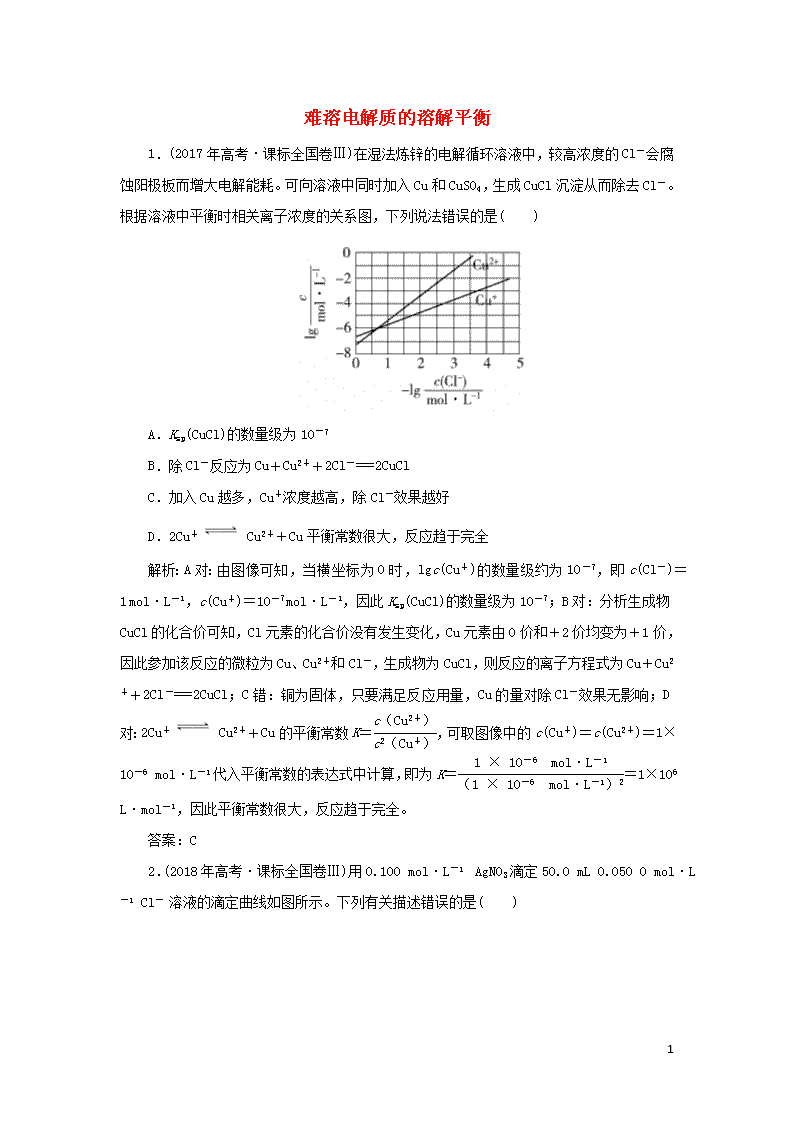
难溶电解质的溶解平衡 1.(2017年高考·课标全国卷Ⅲ)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( ) A.Ksp(CuCl)的数量级为10-7 B.除Cl-反应为Cu+Cu2++2Cl-===2CuCl C.加入Cu越多,Cu+浓度越高,除Cl-效果越好 D.2Cu+ Cu2++Cu平衡常数很大,反应趋于完全 解析:A对:由图像可知,当横坐标为0时,lgc(Cu+)的数量级约为10-7,即c(Cl-)=1 mol·L-1,c(Cu+)=10-7 mol·L-1,因此Ksp(CuCl)的数量级为10-7;B对:分析生成物CuCl的化合价可知,Cl元素的化合价没有发生变化,Cu元素由0价和+2价均变为+1价,因此参加该反应的微粒为Cu、Cu2+和Cl-,生成物为CuCl,则反应的离子方程式为Cu+Cu2++2Cl-===2CuCl;C错:铜为固体,只要满足反应用量,Cu的量对除Cl-效果无影响;D对:2Cu+ Cu2++Cu的平衡常数K=,可取图像中的c(Cu+)=c(Cu2+)=1×10-6 mol·L-1代入平衡常数的表达式中计算,即为K==1×106 L·mol-1,因此平衡常数很大,反应趋于完全。 答案:C 2.(2018年高考·课标全国卷Ⅲ)用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl- 溶液的滴定曲线如图所示。下列有关描述错误的是( ) 4 A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B.曲线上各点的溶液满足关系式c(Ag+ )·c(Cl-)=Ksp(AgCl) C.相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c移到a D.相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向b方向移动 解析:本题考查沉淀溶解平衡及溶度积常数。A项,根据滴定曲线知,当加入25 mL AgNO3溶液时达到反应终点,此时c(Cl-)≈1×10-5mol·L-1,Ag+沉淀完全,则c(Ag+)=1×10-5mol·L-1,故Ksp(AgCl)=c(Ag+)·c(Cl-),数量级为10-10,正确;B项,由溶度积常数的定义知,曲线上各点满足Ksp(AgCl)=c(Ag+)·c(Cl-),正确;C项,相同条件下,若改为0.040 0 mol·L-1 Cl-,达到反应终点时c(Cl-)不变,消耗V(AgNO3)=20 mL,错误;D项,相同条件下,若改为0.050 0 mol·L-1 Br-,由于Ksp(AgBr)查看更多
相关文章
- 当前文档收益归属上传用户