- 2021-07-03 发布 |
- 37.5 KB |
- 20页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】浙江省绍兴市2020届高三11月选考科目诊断性考试(解析版)
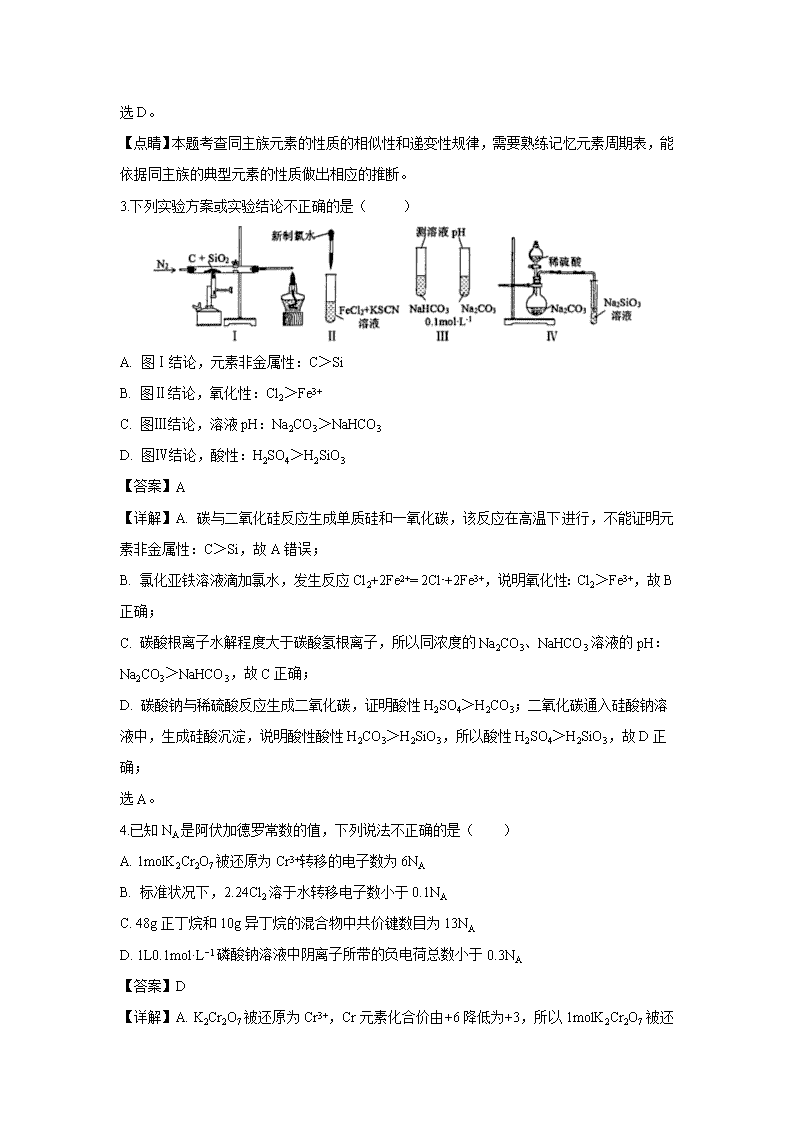
浙江省绍兴市2020届高三11月选考科目诊断性考试 可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Al 27 Cl 35.5 Ag 108 一、选择题(本大题共16小题,每小题3分,共48分) 1.在指定环境中一定能大量共存的是( ) A. 在强碱性溶液中:K+、Na+、CO32-、NO3- B. 在pH=1的溶液中:NO3-、SO42-、Na+、Fe2+ C. 与铝反应放出氢气的溶液中:K+、SO32-、NO3-、Na+ D. 在由水电离出的c(OH−)=1×10−12mol·L−1的溶液中:K+、ClO−、Na+、SO42- 【答案】A 【详解】A. 在强碱性溶液中:K+、Na+、CO32-、NO3-不反应,能大量共存,故选A; B. 在pH=1的溶液呈酸性,酸性条件下NO3-能氧化Fe2+,NO3-、Fe2+不能共存,故不选B; C. 与铝反应放出氢气的溶液呈酸性或碱性,酸性条件下SO32-、NO3-发生氧化还原反应,酸性条件下溶液中有NO3-,不能生成氢气,故不选C; D. 在由水电离出的c(OH−)=1×10−12mol·L−1的溶液,呈酸性或碱性,酸性条件下ClO−与H+结合成弱电解质HClO,故不选D。 2.运用元素周期律分析下面的推断,其中不正确的是( ) A. 铍(Be)的氧化物的水化物具有两性 B. 砹(At)为有色固体,AgAt感光性很强,不溶于水 C. 硫酸锶(SrSO4)是难溶于水的白色固体 D. 硒化氢(H2Se)是无色、有毒,比H2S稳定的气体 【答案】D 【详解】A. 铝的氧化物的水化物具有两性,根据对角线规则,铍(Be)的氧化物的水化物具有两性,故A正确; B.从上到下,卤素单质的颜色加深,卤化银溶解度依次减小、见光更易分解,所以砹(At)为有色固体,AgAt感光性很强,不溶于水,故B正确; C. Sr与Ca、Ba同主族,CaSO4、SrSO4、BaSO4 溶解度依次降低,所以硫酸锶(SrSO4)是难溶于水的白色固体,故C正确; D. Se与S同主族,H2S是有毒气体,所以硒化氢(H2Se)是无色、有毒气体;Se的非金属性小于S,所以H2Se稳定性比H2S差,故D错误; 选D。 【点睛】本题考查同主族元素的性质的相似性和递变性规律,需要熟练记忆元素周期表,能依据同主族的典型元素的性质做出相应的推断。 3.下列实验方案或实验结论不正确的是( ) A. 图Ⅰ结论,元素非金属性:C>Si B. 图Ⅱ结论,氧化性:Cl2>Fe3+ C. 图Ⅲ结论,溶液pH:Na2CO3>NaHCO3 D. 图Ⅳ结论,酸性:H2SO4>H2SiO3 【答案】A 【详解】A. 碳与二氧化硅反应生成单质硅和一氧化碳,该反应在高温下进行,不能证明元素非金属性:C>Si,故A错误; B. 氯化亚铁溶液滴加氯水,发生反应Cl2+2Fe2+= 2Cl-+2Fe3+,说明氧化性:Cl2>Fe3+,故B正确; C. 碳酸根离子水解程度大于碳酸氢根离子,所以同浓度的Na2CO3、NaHCO3溶液的pH:Na2CO3>NaHCO3,故C正确; D. 碳酸钠与稀硫酸反应生成二氧化碳,证明酸性H2SO4>H2CO3;二氧化碳通入硅酸钠溶液中,生成硅酸沉淀,说明酸性酸性H2CO3>H2SiO3,所以酸性H2SO4>H2SiO3,故D正确; 选A。 4.已知NA是阿伏加德罗常数的值,下列说法不正确的是( ) A. 1molK2Cr2O7被还原为Cr3+转移的电子数为6NA B. 标准状况下,2.24Cl2溶于水转移电子数小于0.1NA C. 48g正丁烷和10g异丁烷的混合物中共价键数目为13NA D. 1L0.1mol·L−1磷酸钠溶液中阴离子所带的负电荷总数小于0.3NA 【答案】D 【详解】A. K2Cr2O7被还原为Cr3+,Cr元素化合价由+6降低为+3,所以1molK2Cr2O7 被还原为Cr3+转移的电子数为6NA,故A正确; B. 标准状况下2.24Cl2溶于水,氯气部分与水反应生成盐酸和次氯酸,所以转移电子数小于0.1NA,故B正确; C. 正丁烷、异丁烷分子中都有13个共价键, 48g正丁烷和10g异丁烷的总物质的量为1mol,所以混合物中共价键数目为13NA,故C正确; D. 1L0.1mol·L−1磷酸钠溶液中钠离子的物质的量为0.3mol,阳离子为Na+和H+,阳离子所带正电荷总数大于0.3mol,根据电荷守恒,阴离子所带的负电荷总数大于0.3NA,故D错误。 选D。 5.某兴趣小组对NH4NO3热分解产物提出如下4种猜想: 甲:N2、HNO3、H2O 乙:N2O、NO、H2O 丙:NH3、N2、H2O 丁:N2、NO、H2O 你认为猜想有科学性不正确的是( ) A. 甲和乙 B. 乙和丁 C. 乙和丙 D. 丙和丁 【答案】C 【详解】A、NH4NO3中N元素的化合价有-3和+5两种,原子个数比为1:1,根据得失电子守恒,若发生归中反应生成氮气,消耗-3价N和+5价N的比为5:3,所以+5价N有剩余,有硝酸生成,不可能有氨气生成,故甲有可能、丙不可能;若发生归中反应, 、,根据得失电子守恒,-3价N和+5价N的比为3:4,所以-3价N有剩余,应有氨气生成,故乙不可能;若发生归中反应, 、,根据得失电子守恒, 消耗-3价N和+5价N的比为1:1,可能不生成其他含N的产物,故丁有可能;故选C。 【点睛】本题考查归中反应规律和得失电子守恒,氧化还原反应中失电子总数等于得电子总数,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。 6.下列关于铁元素的说法正确的是( ) A. 预热的铁丝能在氯气中燃烧,生成棕褐色的烟雾 B. 还原铁粉与浓硫酸共热,生成能使品红溶液褪色的气体 C. 镀锌铁皮不易生锈,原因是使用了牺牲阴极的阳极保护法 D. 向印刷电路板的废液中,加足量的铁粉,振荡,再滴入KSCN溶液显红色 【答案】B 【详解】A. 预热的铁丝能在氯气中燃烧,生成棕红色的烟,不是雾,故A错误, B. 还原铁粉与浓硫酸共热,生成二氧化硫气体,二氧化硫能使品红溶液褪色,故B正确; C. 镀锌铁皮不易生锈,原因是锌在铁的表面起到保护层的作用,故C错误; D. 向印刷电路板的废液中,加足量的铁粉,振荡,溶液中Fe3+被还原成Fe2+,再滴入KSCN溶液不显红色,故D错误。 7.肼(N2H4)空气燃料电池是一种环保型碱性燃料电池,电解液是20%~30%的KOH溶液。关于该电池,下列说法正确的是( ) A. 负极的电极反应式是:N2H4+4OH−-4e-=4H2O+N2↑ B. 正极的电极反应式是:O2+4H++4e−=2H2O C. 离子交换膜的类型为阳离子交换膜 D. b电极附近pH值减小 【答案】A 【详解】A. 负极肼失电子生成氮气,负极电极反应式是:N2H4+4OH−-4e-=4H2O+N2↑,故A正确; B. 正极是氧气得电子生成氢氧根离子,正极的电极反应式是:O2+4H2O+4e−=4OH-,故B错误; C. 正极生成氢氧根离子、负极消耗氢氧根离子,为使电池持续放电,离子交换膜的类型为阴离子交换膜,故C错误; D. b是正极,电极反应式是O2+4H2O+4e−=4OH-, pH值增大,故D错误; 【点睛】本题考查原电池工作原理,明确负极失电子发生氧化反应、正极得电子发生还原反应、阴离子向负极移动,熟练掌握电极反应式的书写。 8.下列有关说法正确的是( ) A. 将淀粉与稀硫酸混合加热,再加入少量新制的氢氧化铜溶液,观察无砖红色沉淀生成,可证明淀粉水解的产物中不含葡萄糖 B. 纸层析法分离Cu2+、Fe3+ 时,用玻璃棒蘸取试样在滤纸条的原点处轻轻点样,晾干后再点,重复3~5次 C. 酸碱中和滴定实验中,为准确测得反应的计量点,应尽量满足指示剂的变色范围窄于突跃范围,且滴定前后指示剂的颜色变化必须由深到浅 D. 制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品 【答案】D 【详解】A. 将淀粉与稀硫酸混合加热,需要先加入氢氧化钠溶液中和硫酸,再加入少量新制的氢氧化铜溶液,检验淀粉水解的产物中是否含葡萄糖,故A错误; B. 纸层析法分离Cu2+、Fe3+时,用毛细管蘸取试样在滤纸条的原点处轻轻点样,晾干后再点,重复3~5次,故B错误; C. 酸碱中和滴定实验中,为准确测得反应的计量点,应尽量满足指示剂的变色范围窄于突跃范围,且滴定前后指示剂的颜色变化必须由浅到深,容易判断滴定终点,故C错误; D. 摩尔盐在有机溶剂中的溶度积小,制摩尔盐时用酒精洗涤产品,可以减少晶体溶解;阿司匹林溶解度随温度升高而增大,制阿司匹林时用冷水洗涤产品,减少阿司匹林溶解,故D正确。 9.化合物Y具有抗菌、消炎作用,可由X制得。 下列有关化合物X、Y的说法不正确的是( ) A. X、Y均能与酸性KMnO4溶液反应 B. 1molX最多能与3 mol NaOH反应 C. Y与乙醇发生酯化反应可得到X D. 相对分子质量M(X)-M(Y)=42 【答案】C 【详解】A. X中含有碳碳双键、Y中含有碳碳双键、羟基,所以均能与酸性KMnO4溶液反应,故A正确; B. X中含有1个酚酯基、1个羧基,所以1molX最多能与3 mol NaOH反应,故B正确; C. Y与乙醇发生酯化反应生成,不是X,故C错误; D. X水解生成Y和乙酸,根据质量守恒,M(X)+18=M(Y)+60,M(X)-M(Y)=42,故D正确。 选C。 【点睛】本题考查多官能团有机物的结构与性质,熟练掌握常见官能团的结构和性质,注意酚酯水解消耗氢氧化钠的判断,根据质量守恒判断D选项。 10.在不同温度下,水溶液中-lg c(H+)与-lg c(OH−)。关系如图所示。下列说法不正确的是( ) A. 图中五点Kw间的关系:B>C>A=D=E B. A→E点对应的水溶液中,可能有NH4+、Ba2+、Cl−、I−大量同时存在 C. 若0.1mol·L−1的NaHA溶液水溶液中c(H+)与c(OH−)关系如图D点所示,则溶液中有:c(HA−)>c(OH−)>c(A2−)>c(H2A) D. 向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH−)关系如图E点所示,则溶液中反应:2H++SO42-+Ba2++2OH−=BaSO4↓+2H2O 【答案】C 【详解】A. 同一条曲线上点Kw相同,所以A=D=E,离原点越近,氢离子浓度、氢氧根离子的浓度越大,Kw越大,所以图中五点Kw间的关系:B>C>A=D=E,故A正确; B. A→E点对应的水溶液中,氢离子浓度大于氢氧根离子,溶液呈酸性,可能有NH4+、Ba2+、Cl−、I−大量同时存在,故B正确; C. D点所示溶液呈碱性,则0.1mol·L−1的NaHA溶液水溶液呈碱性,说明HA−水解大于电离,则溶液中有:c(HA−)>c(OH−)>c(H2A) >c(A2−),故C错误; D. E点所示的溶液呈酸性,说明NaHSO4与Ba(OH)2的比大于2:1,Ba(OH)2 溶液中钡离子、氢氧根离子能完全反应,则溶液中反应:2H++SO42-+Ba2++2OH−=BaSO4↓+2H2O,故D正确。 选C。 11.C和CuO在高温下反应可能生成Cu、Cu2O、CO2、CO。现将1 g碳粉跟8 g CuO混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为1.1 g,残余气体在标准状况下的体积为560 mL。下列说法错误的是( ) A. 在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应 B. 试管中发生的所有氧化还原反应共转移电子0.15 mol C. 反应后试管中剩余的固体混合物的总质量为7.2 g D. 反应生成铜和氧化亚铜的总物质的量为0.1 mol 【答案】D 【解析】NaOH溶液增加的质量就是反应生成二氧化碳的质量,残余气体就是一氧化碳。n(CO2)=1.1/44=0.025 mol,n(CO)=0.56/22.4=0.025 mol,则有0.05 mol碳参与了反应,参与反应的碳的质量为0.6 g。生成0.025 mol CO2转移0.1 mol电子,生成0.025 mol CO转移0.05 mol电子,反应中一共转移0.15 mol电子。反应中氧化铜失去的氧元素的质量为(0.025 mol×2+0.025 mol)×16 g/mol=1.2 g,反应后试管中剩余的固体混合物包括铜及其化合物和剩余的碳,总质量为8 g-1.2 g+1 g-0.6 g=7.2 g。设反应后生成铜和氧化亚铜的物质的量分别为x、y,根据电子得失守恒原理得:2x+2y=0.15 mol,则x+y=0.075 mol,反应生成铜和氧化亚铜的总物质的量为0.075 mol。 12.KClO3热分解是实验室制取氧气的一种方法,1molKClO3(s)热分解的能量变化如图所示。实验测得第一放热温度为400℃,第二放热温度为480℃。下列说法正确的是( ) A. 400℃时KClO3热分解的产物是KCl和O2 B. 若用MnO2作催化剂,KClO3热分解温度大于480℃ C. 曲线Ⅰ的活化能大于曲线Ⅱ,所以KClO3比KClO4稳定 D. 2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol−1 【答案】D 【分析】根据图示,反应Ⅰ活化能大于反应Ⅱ,所以反应Ⅰ为480℃时的反应,反应Ⅱ为400℃时的反应。 【详解】A. 反应Ⅰ为480℃时的反应,480℃时KClO3热分解的产物是KCl和O2,故A错误; B. 催化剂降低反应的活化能,若用MnO2作催化剂,KClO3热分解温度小于480℃,故B错误; C. 能量越低越稳定,KClO3的能量大于KClO4,所以KClO4比KClO3稳定,故C错误; D.根据图示,1mol KClO3(s)生成1molKCl(s)和1.5molO2(g)放热36+3=39kJ,所以2KClO3(s)=2KCl(s)+3O2(g) ΔH=-78kJ·mol−1,故D正确。 13.某学习小组研究大小相同、过量的去膜镁条与40mL0.1mol·L−1的盐酸和醋酸分别反应,相同条件下测得气体体积与反应时间关系如下表所示: 气体读数/mL 5 mL 10 mL 15 mL 20 mL …… 45 mL A瓶(醋酸)/s 155 310 465 565 …… 865 B瓶(盐酸)/s 7 16 30 64 …… 464 下列说法不正确的是( ) A. 0~5mL时,A与B反应速率不同的原因是c(H+)不同所致 B. 5~10mL时,A瓶平均反应速率为mL·s−1 C. 0~20mL时,A瓶反应速率增大,可能是温度升高所致 D. 0~45mL时段内,镁与盐酸反应的速率始终大于镁与醋酸反应的速率 【答案】D 【详解】A.醋酸是弱酸,相同浓度的盐酸、醋酸中氢离子浓度不同, 0~5mL时,A与B反应速率不同的原因是c(H+)不同所致,故A正确; B. 5~10mL时,A瓶平均反应速率=mL·s−1,故B正确; C. 酸与金属反应放热,0~20mL时,A瓶反应速率增大,可能是温度升高所致,故C正确; D. 20~45mL时段内,镁与盐酸用时400s,镁与醋酸用时300s,镁与醋酸反应的速率大于镁与盐酸反应的速率,故D错误。 选D。 14.利用0.2mol·L−1Al2(SO4)3溶液滴定0.05mol·L−1 NaOH溶液。其pH−t曲线如图所示。已知0.01mol·L−1Al3+时,Al(OH)3沉淀存在的pH范围为4~10。下列说法正确的是( ) A. 曲线段ab为未滴加Al2(SO4)3溶液,溶液只有Na+、OH− B. 曲线段bc存在c(Na+)+c(H+)+3c(Al3+)=c(OH−)+2c(SO42-) C. 曲线段cd发生反应为Al3++4OH−=AlO2-+2H2O D. 曲线段de现象为产生白色沉淀,继而沉淀消失 【答案】C 【详解】A. 曲线段ab为未滴加Al2(SO4)3溶液,氢氧化钠溶液中含有Na+、OH−、H+,故A错误; B. 曲线段bc存在溶质偏铝酸钠,c(Na+)+c(H+)+3c(Al3+)=c(OH−)+2c(SO42-)+ c(AlO2-),故C错误; C. Al(OH)3沉淀存在的pH范围为4~10,曲线段cd的pH>10,没有沉淀生成,所以发生反应为Al3++4OH−=AlO2-+2H2O,故C正确; D. Al(OH)3沉淀存在的pH范围为4~10,曲线段cd的pH范围为5~10,发生反应为Al3++3AlO2-+6H2O = 4Al(OH)3↓,曲线段de现象为产生白色沉淀,沉淀没有溶解,故D错误。 选C。 15.某工厂用NaCl为原料制备高氯酸,实验按流程如下所示: 下列说法不正确的是( ) A. 电解Ⅰ分别用不锈钢网和石墨作电极,石墨电极上有黄绿色气体生成 B. “60℃歧化”的反应为:3Cl2+3CO32-=5Cl−+ClO3-+3CO2 C. 电解Ⅱ中阳极反应式为:ClO3-+2OH−-2e−=ClO4-+H2O D. 循环利用物质A的成分是NaCl、NaClO4 【答案】C 【详解】A.根据流程图,电解Ⅰ分别用不锈钢网和石墨作电极,电解氯化钠溶液,制备氯气,所以需要用石墨为阳极,故A正确; B. “60℃歧化”的反应为氯气和碳酸钠反应生成氯化钠、氯酸钠和二氧化碳,反应离子方程式为3Cl2+3CO32-=5Cl−+ClO3-+3CO2,故B正确; C.电解Ⅱ中阳极反应式为:ClO3-+H2O-2e−=ClO4-+2H+,故C错误; D. 根据流程图,循环利用物质A的成分是NaCl、NaClO4,故D正确。 选C。 16.某固体样品可能含有Fe3+、NH4+、Ag+、NO3-、Cl−中的若干种离子,为确定该样品的组成,将样品用蒸馏水配成100mL分散系A,进行了如下实验(假设气体全部逸出): 下列说法正确的是( ) A. 该样品中肯定含有NH4NO3、AgNO3 B. 溶液A中肯定没有Fe3+、Cl− C. 溶液A可能含有Cl− D. 溶液A中NO物质的量浓度是0.5mol·L−1 【答案】C 【详解】100mL分散系A加入40mL 1mol/L的氢氧化钠溶液,恰好完全反应,生成448mL氨气和无色澄清溶液,氨气的物质的量是0.02mol,则原溶液一定含有NH4+,一定不含Fe3+;向无色澄清溶液中加入过量盐酸,生成1.435g白色沉淀,则白色沉淀一定是AgCl,物质的量是0.01mol,则无色澄清溶液中含有0.01mol ,原溶液含有0.04mol NH4+,0.01mol Ag+,AgCl能溶于氨水,原溶液可能含Cl−、NO; 根据以上分析,A. 该样品中可能含有NH4Cl、AgNO3,故A错误; B. AgCl能溶于氨水,溶液A可能含Cl−,故B错误 C. AgCl能溶于氨水,溶液A可能含Cl−,故C正确; D. 若溶液中含有Cl−,根据电荷守恒,溶液A中NO3-物质的量浓度小于0.5mol·L−1,故D错误。 选C。 【点睛】本题考查离子推断,通过离子反应判断离子共存,知道铵根离子检验的方法,关键是考查Ag+能与氨水反应生成络合离子。 二、非选择题(本大题共5小题,共52分) 17.2019年诺贝尔化学奖授予了研究锂电池的3位科学家,研宄领域之一是发明了磷酸铁锂(LiFePO4)正极材料,写出LiFePO4中Fe元素的化合价是____;利用FeSO4、(NH4)2HPO4、LiOH为原料,以物质的量之比1∶1∶1在高温下反应生成LiFePO4,写出该化学反应方程式______________________________________________________;锂电池(Li/LiFePO4)电解液采用非水体系,其原因是_____________________________________(用化学方程式表示)。 【答案】(1). +2 (2). FeSO4+(NH4)2HPO4+LiOH=LiFePO4+(NH4)2SO4+H2O (3). 2Li+2H2O=2LiOH+H2↑ 【详解】LiFePO4中Li是+1价,P是+5价,O是-2价,根据化合价规则确定Fe元素的化合价是+2价; 根据质量守恒,FeSO4、(NH4)2HPO4、LiOH以物质的量之比1∶1∶1在高温下反应生成LiFePO4、(NH4)2SO4、H2O,反应方程式是FeSO4+(NH4)2HPO4+LiOH=LiFePO4+(NH4)2SO4+H2O; 锂是活泼金属,与水反应放出氢气,2Li+2H2O=2LiOH+H2↑,所以锂电池(Li/LiFePO4)电解液采用非水体系。 18.储氢材料甲由X、Y、Z三种短周期元素组成,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍。为确定甲的组成,进行了如下实验: ①称取5.4g甲固体,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,同时得到两种固体,其中一种为二元化合物。 ②冷却后,向①反应后的固体混合物中加入足量的蒸馏水,充分反应后,又放出标准状况下5.6L单质气体乙,同时得到澄清溶液丙。 请回答: (1)乙的电子式_________。 (2)甲的化学式________。 (3)写出生成溶液丙的化学反应方程式___________________________________。 (4)设计实验方案检验溶液丙中的溶质成分______________________________________ _______________________________________________________。 【答案】 (1). H∶H (2). NaAlH4 (3). 2NaH+2Al+4H2O=2NaAlO2+5H2↑ (4). 用洁净的铂丝蘸取丙溶液进行焰色反应,显黄色,证明含Na+;另取少量丙溶液于试管中,逐滴滴加稀盐酸,若出现白色沉淀,继而沉淀消失,则含有AlO2- 【分析】常见的储氢材料是金属氢化物,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,气体乙是氢气,所以一定含有H元素;短周期元素中化合价最高的金属元素是+3价Al元素,Z元素的最外层电子数是X与Y元素最外层电子数之和的1.5倍,故Z是 Al元素,则另一种金属元素化合价为+1,反应②得到澄清溶液丙,说明另一种金属元素一定为钠。 【详解】(1)常见的储氢材料是金属氢化物,加热到250℃时,完全反应后,放出标准状况下3.36 L单质气体乙,所以一定含有H元素,气体乙是氢气,电子式为H∶H。 (2)①②共生成标准状况下的氢气8.96L÷22.4L/mol=0.4mol,根据得失电子守恒,5.4g甲固体含有0.4molH原子;设5.4g甲固体含有Al元素xmol、Na元素ymol,则 ,解得y=0.1、x=0.1, n(Na):n(Al):n(H)=0.1:0.1:0.4=1:1:4,甲的化学式是NaAlH4; (3)钠的活泼性大于铝,反应①生成的固体是NaH和Al,NaH与水反应生成氢氧化钠和氢气,氢氧化钠与铝反应生成偏铝酸钠和氢气,总反应方程式是2NaH+2Al+4H2O=2NaAlO2+5H2↑。 (4)AlO2-与少量盐酸反应先生成氢氧化铝沉淀,氢氧化铝与盐酸反应生成铝离子,Na+的焰色反应呈黄色;检验溶液丙中的溶质成分的方法是:用洁净的铂丝蘸取丙溶液进行焰色反应,显黄色,证明含Na+;另取少量丙溶液于试管中,逐滴滴加稀盐酸,若出现白色沉淀,继而沉淀消失,则含有AlO2-。 19.甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加到容器,加热并搅拌,达到60℃恒温时,通入CO到一定压力,开始反应后记录容器压力随时间变化,直到压力不再变化,冷却,泄压,取出反应物,抽滤、烘干并称量。其反应如下: Ⅰ:CO(g)+H2O(g)HCOOH(aq) ΔH1 K1 Ⅱ:HCOOH(aq)+NaOH(aq)HCOONa(s)+H2O(l) ΔH2 K2 Ⅲ:CO(g)+NaOH(aq)HCOONa(s) ΔH K 请回答: (1)K=_______(用K1、K2表示),ΔH=___________(用ΔH1、ΔH2表示)。 (2)若需加快反应Ⅲ的速率,下列措施可行的是_____。 A.增大CO的初始压力 B.适当升高温度 C.减少乙醇浓度 D.降低搅拌转速 (3)CO的压力转化率可以反映羰基化进程。CO的压力转化率可以表示为:x(CO)=1-×100%,P0为CO初始压力,P1为CO某时刻分压。HCOONa收率可表示为:Y(HCOONa)=×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成HCOONa的物质的量。投料比r=。 保持60℃恒温,以投料比r=0.7时,CO初始压力分别为0.5Mpa、1.5Mpa和2.0Mpa,测得x(CO)与t的关系如图所示。 ①表示1.5Mpa的曲线为_____(用A、B、C表示)。 ②若1.5Mpa时,Y(HCOONa)=87%,则NaOH的转化率为_____。 ③当CO初始压力为1.5Mpa,保持60℃ 恒温,不计HCOONa在乙醇中溶解。画出Y(HCOONa)与r示意图___。 【答案】(1). K=K1K2 (2). ΔH=ΔH1+ΔH2 (3). AB (4). B (5). 87% (6). 【分析】(1).Ⅰ:CO(g)+H2O(g)HCOOH(aq) Ⅱ:HCOOH(aq)+NaOH(aq)HCOONa(s)+H2O(l) 反应Ⅰ+反应Ⅱ得反应Ⅲ:CO(g)+NaOH(aq)HCOONa(s) ; (2)根据影响反应速率的因素分析; (3)①增大压强,平衡正向移动,压强越大,CO的平衡转化率越大; ②根据Y(HCOONa)=×100%计算NaOH的转化率; ③根据题意,保持60℃恒温,以投料比r=0.7时,CO初始压力为1.5Mpa, Y(HCOONa)=87%,增大氢氧化钠的物质的量,氢氧化钠的转化率减小,随r增大,Y(HCOONa)减小; 【详解】(1).Ⅰ:CO(g)+H2O(g)HCOOH(aq) Ⅱ:HCOOH(aq)+NaOH(aq)HCOONa(s)+H2O(l) 反应Ⅰ+反应Ⅱ得反应Ⅲ:CO(g)+NaOH(aq)HCOONa(s) ;所以K=K1K2;根据盖斯定律ΔH=ΔH1+ΔH2; (2)A.增大压强,反应速率增大,增大CO的初始压力 ,能加快反应Ⅲ的速率,故选A; B.温度越高反应速率越快,适当升高温度,能加快反应Ⅲ的速率,故选B; C.反应速率与氢氧化钠浓度有关,所以减少乙醇浓度,不能加快反应Ⅲ的速率,故不选C; D.降低搅拌转速,反应速率减慢,故不选D。 (3)①增大压强,平衡正向移动,压强越大,CO的平衡转化率越大,所以表示1.5Mpa的曲线为B; ②设氢氧化钠的初始物质的量为amol,Y(HCOONa)=×100%=87%,则生成甲酸钠的物质的量为0.87amol,消耗氢氧化钠的物质的量是0.87amol, NaOH的转化率为 87%; ③根据题意,保持60℃恒温,以投料比r=0.7时,CO初始压力为1.5Mpa, Y(HCOONa)=87%,增大氢氧化钠的物质的量,氢氧化钠的转化率减小,随r增大,Y(HCOONa)减小,所以Y(HCOONa)与投料比r的关系示意图为。 【点睛】本题综合考查化学反应速率和化学平衡,熟练掌握影响反应速率的因素、化学平衡常数和平衡转化率的计算;第(3)问的关键是从题目中提取概念信息,并应用概念解题。 20.某研究小组拟合成西他沙星的中间体X。其流程如下: 已知:①+CH3CH2Br ②R-CH2Br++HBr ③+H-CH2-COOR″RCOCH2COOR″+R′-OH 请回答: (1)下列说法正确的是_____。 A.化合物A不能与H2发生加成反应 B.化合物D→E,发生了取代反应 C.化合物F的水解产物具有两性 D.化合物G分子式为C13H15ON2 (2)化合物C的结构简式___________。 (3)写出E→F的化学方程式_______________________________________。 (4)中间体X有多种同分异构体,写出3种同时满足下列条件的X的同分异构体结构简式_____________。 ①分子中含有一个六元碳环;②含有结构。 (5)以乙醇为原料,设计合成A的路线(无机试剂任选,用流程图表示)_ _______________________________________________________________________。 【答案】(1). BC (2). (3). +HBr (4). 、、、 (5). CH3CH2OHCH3CHOCH3COOH CH3COOCH2CH3CH3COCH2COOCH2CH3 【分析】根据+CH3CH2Br,与1,2-二溴乙烷反应生成,再水解为,B是;由G的结构,含有苯环,逆推C是;与反应生成,则D是 ,D与溴发生取代反应生成 (E),根据R-CH2Br++HBr ,E在一定条件下生成(F)。 【详解】A.化合物A含有羰基,能与H2发生加成反应,故A错误; B.化合物D→E,是D分子中1个氢原子被1个溴原子代替,发生了取代反应,故B正确; C.化合物F是,含有肽键,水解产物含有氨基、羧基,所以具有两性,故C正确; D.由G的结构简式,可知G分子式为C13H16ON2,故D错误。 选BC; (2)由G的结构,含有苯环,逆推C是。 (3)E是在一定条件下生成,反应的化学方程式是+HBr。 (4)①分子中含有一个六元碳环;②含有结构的同分异构体有、、、 ; (5)乙醇氧化为乙醛、乙醛氧化为乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,2分子乙酸乙酯在一定条件下反应生成,以乙醇为原料合成的路线图为CH3CH2OHCH3CHOCH3COOHCH3COOCH2CH3CH3COCH2COOCH2CH3。 21.实验室利用呋喃甲醛为原料制备呋喃甲醇与呋喃甲酸。 Ⅰ、制备原理: 2+NaOH+ +HCl+NaCl Ⅱ、实验步骤 Ⅲ、相关信息 呋喃甲醛 呋喃甲醇 呋喃甲酸 乙醚 熔点/℃ -36.5 -29 133 -116.3 沸点/℃ 161.7 170 231 34.5 水溶性 微溶 微溶 可溶 不溶 相对分子质量 96 98 112 74 Ⅳ、实验装置 V、分析与思考,回答下列问题: (1)操作①名称___________;产品Y为___________。 (2)操作②的装置如图1所示,收集产品X时温度计的读数应控制在90℃左右,其原因是_____________________________________________________________________。 (3)操作①所得水溶液,加盐酸须控制pH为2~3,pH<3的理由是___________________;控制溶液pH时,应选择的指示剂是________。 (4)粗产品Y纯化过程用图2装置进行热过滤,具体操作:向铜漏斗中加热水→_________→拆装置。涉及操作顺序最合理的选项。 A.加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液 B.放入短颈漏斗→放接液烧杯→加热漏斗支管→放入滤纸→倒入热的待滤液 C.放入短颈漏斗→放入滤纸→加热漏斗支管→放接液烧杯→倒入热的待滤液 D.放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→加热漏斗支管 (5)共消耗30mL萃取剂乙醚,从萃取效果角度思考,下列4种萃取方式最合理的是__。 A.30mL、0mL、0mL B.10mL、10mL、10mL C.15mL、10mL、5 mL D.5mL、10mL、15mL (6)计算产品Y的产率ω(Y)=_____。 【答案】(1). 萃取分液 (2). 呋喃甲酸 (3). 减压蒸馏便呋喃甲醇沸点降低,低于170℃(约90℃)时沸腾收集,防止温度过高引起呋喃甲醇结构破坏 (4). 控制pH<3,使呋喃甲酸钠完全转化为呋喃甲酸而析出 (5). 甲基橙(或刚果红) (6). A (7). B (8). 70% 【分析】呋喃甲醛在碱性条件下发生歧化反应生成和,易溶于乙醚,加入乙醚萃取分液,得到的乙醚溶液和的水溶液;的乙醚溶蒸馏得到;的水溶液加入盐酸,调节pH=3,生成析出,再用重结晶法提纯。 【详解】根据以上分析,(1)操作①是加入乙醚,分离的乙醚溶液和的水溶液,名称萃取分液;的水溶液加入盐酸,调节pH=3,生成析出,所以产品Y为呋喃甲酸。 (2)操作②为蒸馏装置,防止温度过高引起呋喃甲醇结构破坏,通过减压蒸馏便呋喃甲醇沸点降低,低于170℃(约90℃)时沸腾收集呋喃甲醇,所以温度计的读数应控制在90℃左右。 (3)操作① 所得水溶液,加入盐酸,控制pH<3,使呋喃甲酸钠完全转化为呋喃甲酸而析出,所以要控制pH<3;甲基橙在pH<3.1时,呈红色,所以控制溶液pH时应选择甲基橙作指示剂。 (4)为防止呋喃甲酸结晶析出,粗产品Y纯化过程用热过滤,具体操作:向铜漏斗中加热水→加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→拆装置。故选A; (5)从萃取效果角度思考,用30mL萃取剂乙醚,最好分多次等量萃取,合并萃取液。故选B。 (6)呋喃甲醛的物质的量是,根据2+NaOH +、+HCl+NaCl,生成呋喃甲酸的理论产量是0.025mol,质量是0.025mol×112g/mol=2.8g,实际生成呋喃甲酸的质量是1.96g;产品Y的产率ω(Y)=70%。 查看更多