化学卷·2019届河南省信阳市商城高级中学高二上学期期中考试(2017
2017—2018学年度上期高中二年级期中检测
化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至3页,第Ⅱ卷4至6页,全卷共6页,共100分,考试时间90分钟。
注意事项:
1.答第I卷前,考生务必将自己的姓名、考号等考生信息填写在答题卡上,并用2B铅笔将考号填涂在相应位置。
2.答第I卷时,每小题选出答案后,用2B铅笔把答题卷上的答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号,不能答在试题卷上。
3. 非选择题答案使用0.5毫米的黑色墨水笔书写在答题卷上,字体工整字迹清楚,不得超出答题栏边界。
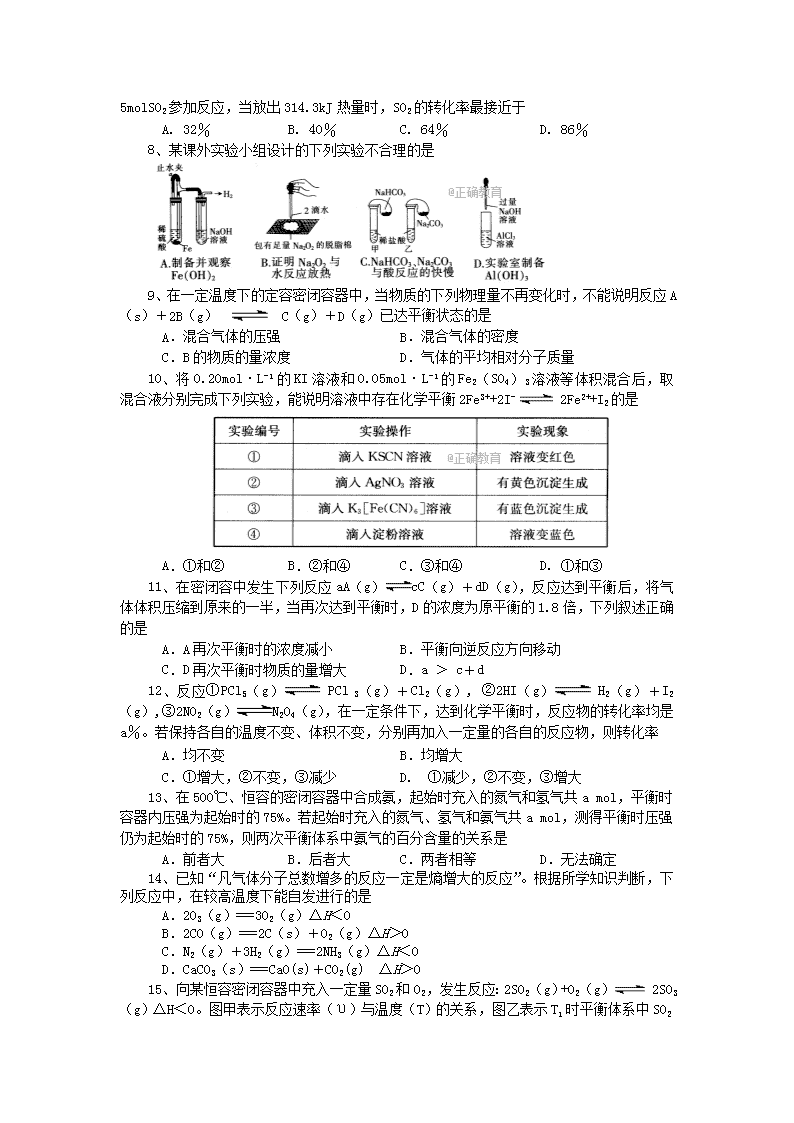
4. 考试结束后,监考员请将答题卷收回。
可能用到的相对原子质量:
H:1 C:12 O:16 S:32
第I卷 选择题
一、选择题(本题包括16小题,每题3分,共48分。每小题只有一个选项符合题意)
1、以下能源不属于一次能源的是
A. 电能 B. 太阳能 C. 风能 D. 天然气
2、下列说法中不正确的是
①能够发生有效碰撞的分子一定是活化分子 ②根据能量守恒定律,反应物的总能量等于生成物的总能量 ③化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体 ④煤转化为煤气后燃烧,可以提高燃烧效率 ⑤等质量的氢气燃烧生成水蒸气所放出的热量低于生成液态水所放出的热量 ⑥等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫粉放出的热量多
A.①⑤ B.②⑤ C.②⑥ D.③④⑥
3、已知反应 H(未配平),X为下列何种物质时H最小
A.CH3COOH(1) B.CH3COOH(g) C.CO(g) D.CO2(g)
4、按如图所示装置进行实验,小试管中加入盐酸后发现反应剧烈,U形管液面左高右低,则下列判断正确的是
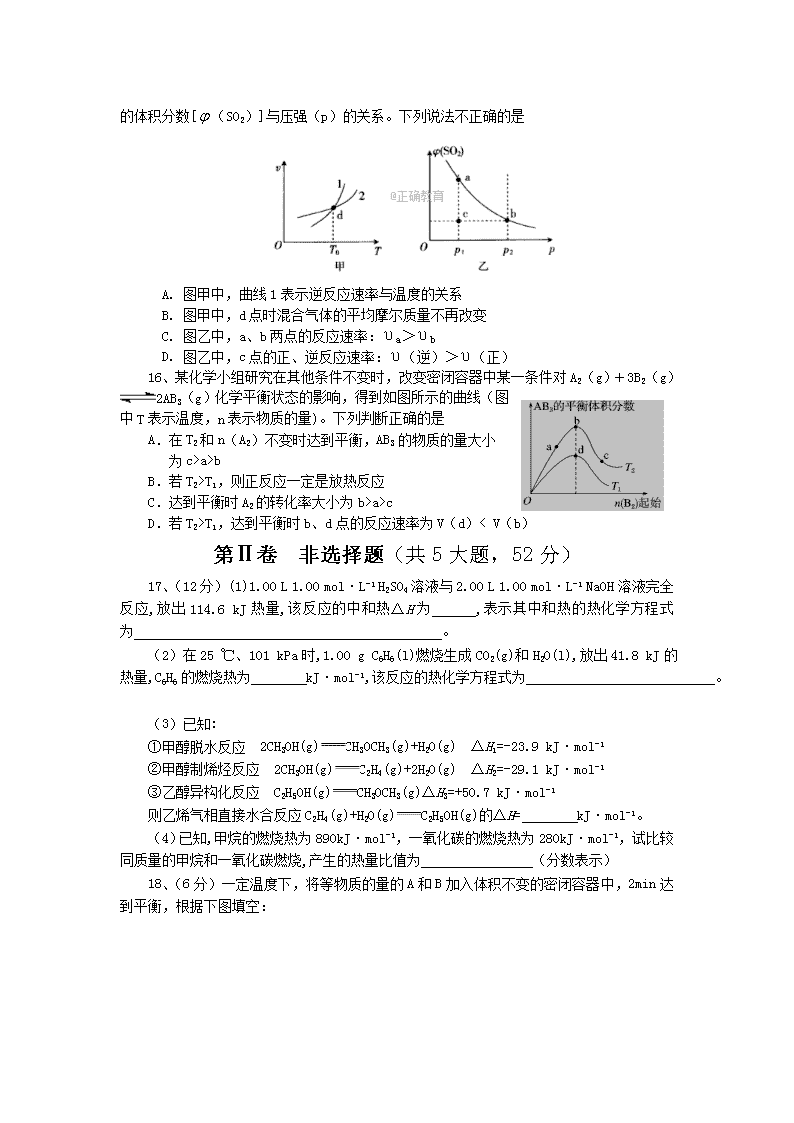
A.该反应的H
a>b
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为V(d)< V(b)
第Ⅱ卷 非选择题(共5大题,52分)
17、(12分)(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH为 ,表示其中和热的热化学方程式为 。
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的燃烧热为 kJ·mol-1,该反应的热化学方程式为 。
(3)已知:
①甲醇脱水反应 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
②甲醇制烯烃反应 2CH3OH(g)C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
③乙醇异构化反应 C2H5OH(g)CH3OCH3(g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)C2H5OH(g)的ΔH= kJ·mol-1。
(4)已知,甲烷的燃烧热为890kJ·mol-1,一氧化碳的燃烧热为280kJ·mol-1,试比较同质量的甲烷和一氧化碳燃烧,产生的热量比值为 (分数表示)
18、(6分)一定温度下,将等物质的量的A和B加入体积不变的密闭容器中,2min达到平衡,根据下图填空:
(1) 该反应的化学方程式为:
(2) 用A表示2min内该反应的反应速率是: ,B的转化率等于 。
(3) 该反应达到平衡后压强是起始压强的 倍。
19、(10分)在一定条件下,白磷(P4)与氯气发生反应的热化学方程式如下:
已知:①P4的结构可表示为
②破坏P—Cl键所需能量为326kJ·mol-1。
试回答下列问题:
(1)PCl3极易水解生成亚磷酸和氯化氢,亚磷酸的化学式为_____。
(2)反应I中,每消耗1molCl2,反应放出211kJ的热量,则ΔH1=_____;反应Ⅱ中, 每转移1 mol电子,反应放出145.7kJ的热量,则ΔH2=______。
(3)写出Cl2(g)和PCl3(g)反应生成PCl5(g)的热化学方程式:____________。
(4)破坏1 mol Cl2和Cl—Cl键所需的能量为______kJ。
(5)1 mol P4完成断裂成P原子,需要吸收的能量是______kJ。
20.(10分)某实验小组欲用酸性KMnO4溶液和H2C2O4溶液反应,通过测定单位时间内生成CO2的量来探究影响反应速率的因素,设计实验方案如下表:
(1)甲图实验装置在使用前需检查气密性,最简便的检查方法是______________。
(2)H2C2O4溶液与酸性KMnO4溶液反应的化学方程式为___________________。
(3)该实验探究的影响化学反应速率的因素是_______,依据原理可推测相同时间内针筒中所得CO2的体积大小关系是______(用实验序号表示)。
(4)若实验①在2min末收集了4.48mL(标准状况)CO2,则在2min末,c(MnO4-)=______(忽略溶液混合前后体积的变化)。
(5)小组同学发现其反应速率随时间变化曲线如图乙所示,为进一步探究t1~t2时间内速率变快的主要原因,小组同学对可能的原因提出假设:①__________,②__________。
21.(14分)Ⅰ.工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应
平衡
常数
温度/℃[
500
800
①2H2(g)+CO(g) CH3OH(g)
K1
2.5
0.15
②H2(g)+CO2(g) H2O(g)+CO(g)
K2
1.0
2.50
③3H2(g)+CO2(g) CH3OH(g)+H2O(g)
K3
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.6、0.1、0.3、0.2,则此时v正________v逆(填“>”、“=”或“<”)。
(2)在6 L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如下左图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________。
Ⅱ.利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g) CH3OH(g)。一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如上右图所示。
(1)p1________p2(填“>”、“<”或“=”),理由是 。
(2)该甲醇合成反应在A点的平衡常数K= (用a和V表示)。
(3)该反应达到平衡时,反应物转化率的关系是CO_______H2。(填“>”、“<”或“=”)
(4)下列措施中能够同时满足增大反应速率和提高CO浓度的是________(填字母)。
A.使用高效催化剂 B.压缩体积增大体系压强
C.降低反应温度 D.不断将CH3OH从反应混合物中分离出来
2017—2018学年度上期高中二年级期中检测
化学试题参考答案
一、选择题(每题3分,共48分)
1.A 2.C 3.D 4.B 5.B 6.A 7.C 8.D
9.A 10.D 11.B 12.D 13.B 14.D 15.C 16.D
二、填空题(共5大题,总分52分)
17.(每空2分,共12分)
(1)-57.3 kJ·mol-1
H2SO4(aq)+NaOH(aq)Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)3260.4 C6H6(l)+7.5O2(g)6CO2(g)+3H2O(l) ΔH=-3 260.4 kJ·mol-1
(3)-45.5 (4)89∶16
18.(共6分)
(1)3A(g)+2B(g) 3C(g)(2分)
(2)3mol/(L·min)(1分) 50% (1分) (3)0.75(2分)
19.
20.
21.(共14分)
Ⅰ.(1)K1·K2(2分) <(2分)
(2)加入催化剂;(1分) 将容器的体积(快速)压缩至4 L(1分)
Ⅱ.(1)<(1分) 甲醇的合成反应是气体分子数减少的反应,相同温度下,增大压强CO的转化率提高(1分)
(2) (2分) (3)=(2分) (4)B(2分)