- 2021-07-03 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
天津专用2020高考化学二轮复习热点专攻15化学工艺流程综合题训练含解析
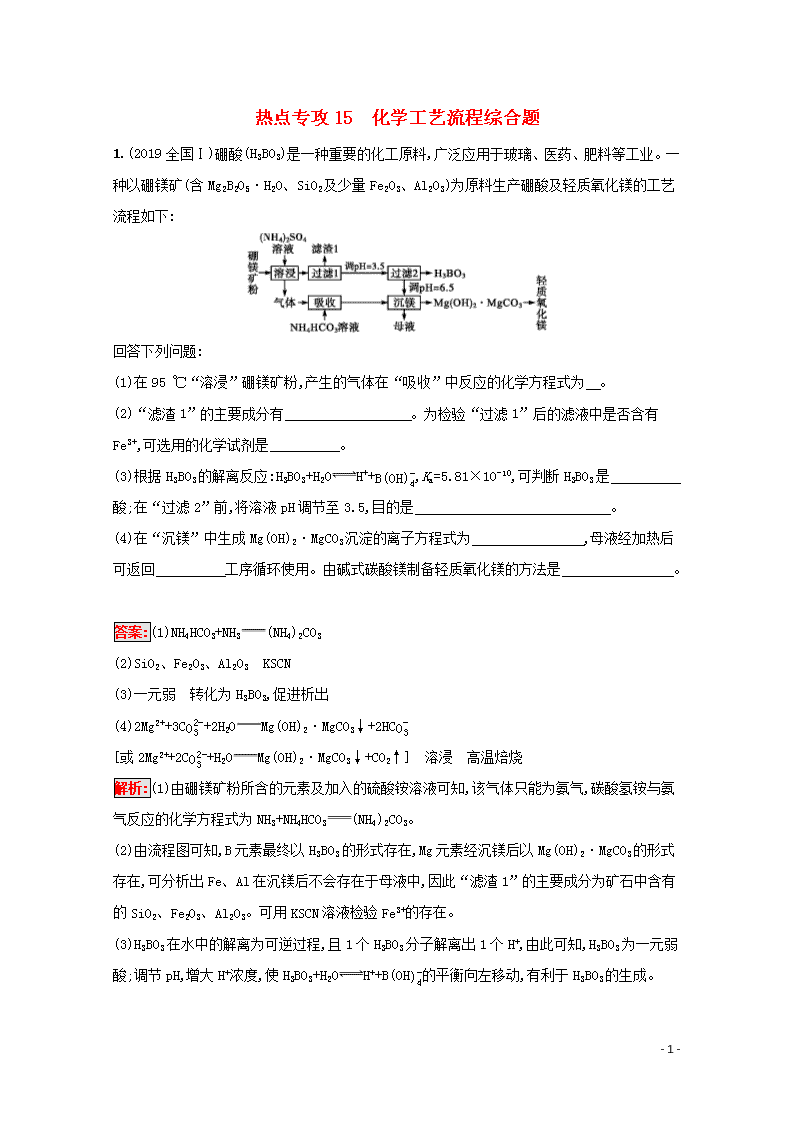
热点专攻15 化学工艺流程综合题 1.(2019全国Ⅰ)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下: 回答下列问题: (1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为 。 (2)“滤渣1”的主要成分有 。为检验“过滤1”后的滤液中是否含有Fe3+,可选用的化学试剂是 。 (3)根据H3BO3的解离反应:H3BO3+H2OH++B(OH)4-,Ka=5.81×10-10,可判断H3BO3是 酸;在“过滤2”前,将溶液pH调节至3.5,目的是 。 (4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为 ,母液经加热后可返回 工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是 。 答案:(1)NH4HCO3+NH3(NH4)2CO3 (2)SiO2、Fe2O3、Al2O3 KSCN (3)一元弱 转化为H3BO3,促进析出 (4)2Mg2++3CO32-+2H2OMg(OH)2·MgCO3↓+2HCO3- [或2Mg2++2CO32-+H2OMg(OH)2·MgCO3↓+CO2↑] 溶浸 高温焙烧 解析:(1)由硼镁矿粉所含的元素及加入的硫酸铵溶液可知,该气体只能为氨气,碳酸氢铵与氨气反应的化学方程式为NH3+NH4HCO3(NH4)2CO3。 (2)由流程图可知,B元素最终以H3BO3的形式存在,Mg元素经沉镁后以Mg(OH)2·MgCO3的形式存在,可分析出Fe、Al在沉镁后不会存在于母液中,因此“滤渣1”的主要成分为矿石中含有的SiO2、Fe2O3、Al2O3。可用KSCN溶液检验Fe3+的存在。 (3)H3BO3在水中的解离为可逆过程,且1个H3BO3分子解离出1个H+,由此可知,H3BO3为一元弱酸;调节pH,增大H+浓度,使H3BO3+H2OH++B(OH)4-的平衡向左移动,有利于H3BO3的生成。 - 8 - (4)“沉镁”过程中的反应物有碳酸铵,生成物有Mg(OH)2·MgCO3,根据原子个数守恒和电荷守恒可写出该反应的离子方程式为2Mg2++3CO32-+2H2OMg(OH)2·MgCO3↓+2HCO3-[或2Mg2++2CO2-3+H2OMg(OH)2·MgCO3↓+CO2↑]。根据元素守恒,NH4+、SO42-存在于母液中,即母液中主要成分为硫酸铵,可返回“溶浸”工序循环使用。高温焙烧可使Mg(OH)2·MgCO3分解生成MgO。 2.(2019全国Ⅲ)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题: 相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下: 金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+ 开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9 (1)“滤渣1”含有S和 ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式 。 (2)“氧化”中添加适量的MnO2的作用是 。 (3)“调pH”除铁和铝,溶液的pH范围应调节为 ~6.0。 (4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是 。 (5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是 。 (6)写出“沉锰”的离子方程式 。 (7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=13时,z= 。 答案:(1)SiO2(或不溶性硅酸盐) MnO2+MnS+2H2SO42MnSO4+S+2H2O (2)将Fe2+氧化为Fe3+ (3)4.7 - 8 - (4)NiS和ZnS (5)F-与H+结合形成弱电解质HF,MgF2Mg2++2F-平衡向右移动 (6)Mn2++2HCO3-MnCO3↓+CO2↑+H2O (7)13 解析:本题为工艺流程图题,综合考查了陌生化学方程式和离子方程式的书写、pH调节、除杂、沉淀溶解平衡及化合价的简单计算等知识,综合性较强,难度中等。 (1)加硫酸“溶浸”过程中MnO2将MnS中的S2-氧化为单质硫:MnO2+MnS+2H2SO42MnSO4+S+2H2O。天然锰矿中含有的二氧化硅(或硅酸盐)不溶于稀硫酸,所以“滤渣1”为S和二氧化硅(或不溶性硅酸盐)。 (2)“溶浸”时杂质Fe、Al、Mg、Zn、Ni等元素也都转化为相应的硫酸盐,其中铁元素部分以Fe2+存在,结合金属离子沉淀时的pH范围,加MnO2是将溶液中的Fe2+氧化为Fe3+,以方便后面将其转化为沉淀除去。 (3)~(5)结合题给表格中金属离子沉淀时的pH范围可知,加氨水“调pH”主要是沉淀Fe3+和Al3+[滤渣2的主要成分为Fe(OH)3和Al(OH)3],此时需控制的pH范围为4.7~6.0。而后面加Na2S完成的“除杂1”是沉淀Zn2+和Ni2+,“滤渣3”的主要成分为ZnS和NiS。加MnF2完成的“除杂2”是沉淀Mg2+,“滤渣4”的主要成分为MgF2。若沉淀Mg2+时溶液酸性较强,H+会与F-生成弱电解质HF,使平衡MgF2(s)Mg2+(aq)+2F-(aq)右移,则导致Mg2+沉淀不完全。 (6)流程图中加NH4HCO3是为了沉淀Mn2+,产物为MnCO3,同时生成CO2和(NH4)2SO4、H2O。 (7)根据化合物中元素化合价的代数和为0可列式计算:(+1)+(+2)×13+(+3)×13+(+4)×z+(-2)×2=0,解得z=13。 3.(2019四川成都二模)NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下: 已知P4与两种碱的反应主要有: - 8 - Ⅰ.2Ca(OH)2+P4+4H2O2Ca(H2PO2)2+2H2↑,Ⅱ.4NaOH+P4+8H2O4NaH2PO2·H2O+2H2↑,Ⅲ.4NaOH+P4+2H2O2Na2HPO3+2PH3↑,Ⅳ.NaH2PO2+NaOHNa2HPO3+H2↑。 (1)已知H3PO2是一元中强酸,NaH2PO2是 (填“正盐”或“酸式盐”)。 (2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为 、 、过滤、洗涤和干燥。 (3)用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为 。 (4)“反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)n(磷)>2.6时,NaH2PO2的产率随n(碱)n(磷)的增大而降低的可能原因是 。 (5)“滤渣2”的主要成分为 (填化学式)。 (6)“过滤2”的滤液须用Ag2SO4、Ba(OH)2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是 。 (7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式: 。 答案:(1)正盐 (2)蒸发浓缩 冷却结晶 (3)2NiCl2+NaH2PO2+2H2O2Ni↓+H3PO4+NaCl+3HCl (4)过量的碱将NaH2PO2转化为Na2HPO3 (5)CaCO3和Al(OH)3 (6)过量的Ag+会氧化H2PO2- (7)H2PO2-+2H2O-4e-H3PO4+3H+ 解析:(1)由于H3PO2是一元中强酸,则NaH2PO2是正盐。 (2)根据题中所给信息,PH3与NaClO反应生成NaH2PO2和NaCl,从吸收液中获得NaH2PO2·H2O的操作为蒸发浓缩、冷却结晶、过滤、洗涤和干燥。 - 8 - (3)根据题意,NiCl2中Ni转化成Ni单质,NaH2PO2为还原剂,P元素的化合价升高,NiCl2+NaH2PO2Ni↓+H3PO4+NaCl,依据化合价升降法进行配平,即2NiCl2+NaH2PO22Ni↓+H3PO4+NaCl,产物为H3PO4,说明该溶液为酸性,利用原子守恒配平可得化学方程式:2NiCl2+NaH2PO2+2H2O2Ni↓+H3PO4+NaCl+3HCl。 (4)n(碱)n(磷)>2.6,说明碱过量,根据已知反应Ⅳ,H2PO2-与过量的NaOH反应转化成HPO32-,次磷酸钠的产率降低,因此NaH2PO2的产率随n(碱)n(磷)的增大而降低的可能的原因是过量的碱将NaH2PO2转化为Na2HPO3。 (5)“调pH”除去Ca2+和Al3+,CO2与碱反应生成CO32-,CO32-与Ca2+反应生成CaCO3,Al3+转化成Al(OH)3,因此“滤渣2”的成分是CaCO3和Al(OH)3。 (6)NaH2PO2具有强还原性,Ag+具有强氧化性,因此加入Ag2SO4溶液不易过量的主要原因是过量Ag+会氧化H2PO2-。 (7)因为次磷酸钠具有很强的还原性,所以阳极H2PO2-放电生成磷酸,则阳极反应为H2PO2-+2H2O-4e-H3PO4+3H+。 4.(2019湖南衡阳二模)锂离子电池与传统电池相比,充电更快,功率密度更高,使用时间更长,在手机和笔记本电脑等便携式电子产品上广泛应用。工业上常以锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,其中一种工艺流程如下: 已知: ①部分金属氢氧化物开始沉淀和完全沉淀时的pH: 氢氧化物 开始沉淀pH 完全沉淀pH Fe(OH)3 2.7 3.7 Al(OH)3 3.7 4.7 Mg(OH)2 9.6 11.0 - 8 - ②Li2CO3的溶解度随温度变化如图所示: 试回答下列问题: (1)酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施,还可通过 来提高浸取率。 (2)反应Ⅰ中应调节pH范围为 ,沉淀A的成分除H2SiO3、CaCO3、Al(OH)3外,还有 。 (3)反应Ⅱ的离子方程式为 。 (4)“操作Ⅰ”的名称为 ;洗涤Li2CO3沉淀要使用 (填“热水”或“冷水”),理由是 。 答案:(1)延长浸取时间、增大浓度 (2)4.7~9.6 Fe(OH)3、CaSO4 (3)Mg2++2OH-Mg(OH)2↓、Ca2++CO32-CaCO3↓ (4)过滤 热水 Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗 解析:以锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,加入过量硫酸溶解锂辉矿,加入碳酸钙除去过量的硫酸调节溶液pH,使铁离子和铝离子沉淀完全,过滤后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到的溶液中主要含锂离子,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,过滤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂。 (1)酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等,还可延长浸取时间、增大浓度,提高浸取效率。 (2)反应Ⅰ中通过调节pH,可除去铁离子、铝离子,沉淀A中除含有H2SiO3、CaCO3、Al(OH)3外,还有Fe(OH)3、CaSO4,由表中数据可知调节pH应为4.7~9.6。 (3)反应Ⅱ加入氢氧化钙和碳酸钠,用于除去镁离子、钙离子,离子方程式为Mg2++2OH-Mg(OH)2↓、Ca2++CO32-CaCO3↓。 (4)操作Ⅰ用于分离固体和液体,为过滤操作,由图像可知洗涤Li2CO3沉淀要使用热水,可减少Li2CO3的损耗。 - 8 - 5.(2019济南一模)工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。 已知: Ⅰ.过程①~④中,钨的化合价均不变; Ⅱ.常温下钨酸难溶于水; Ⅲ.25 ℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mn(OH)2]=4.0×10-14。 回答下列问题: (1)上述流程中的“滤渣1”除MnO2外还有 ,“气体”除水蒸气、HCl外还有 (均填化学式)。 (2)过程①中MnWO4参与反应的化学方程式为 ;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为 。 (3)已知WO3(s)+3H2(g)W(s)+3H2O(g) ΔH=a kJ·mol-1, WO3(s)WO3(g) ΔH=b kJ·mol-1。 写出WO3(g)与H2(g)反应生成W(s)的热化学方程式: 。 (4)过程⑦在25 ℃时调pH,至少应调至 (当离子浓度等于1.0×10-5 mol·L-1时,可认为其已沉淀完全)。 (5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是 。 (6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0查看更多
相关文章
- 当前文档收益归属上传用户