- 2021-07-03 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省三明市第一中学高二下学期开学考试化学试题 Word版
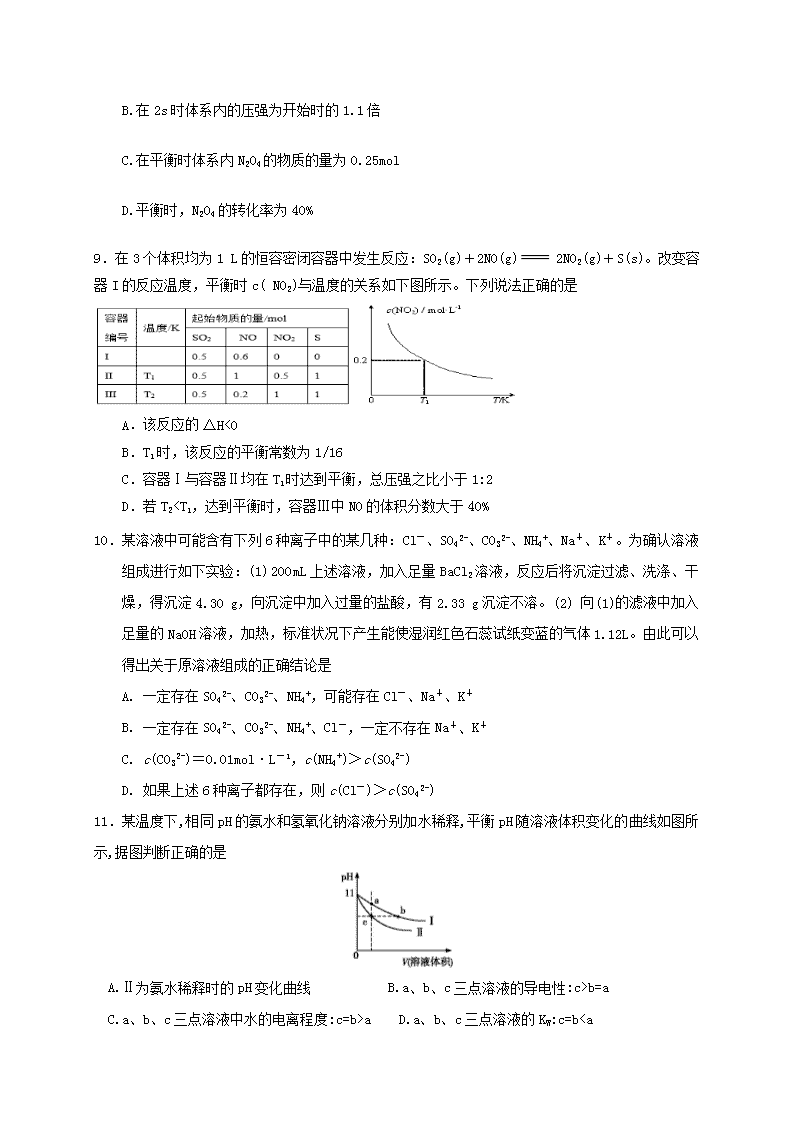
三明一中2018~2019学年度下学期返校考 高二化学试卷 (满分:100分;考试时间:120分钟) 注意事项:请将所有答案填写在答题卷中,第II卷选考部分作答时要填好小题号。 可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cu 64 Ba 137 第Ⅰ卷(必考) 化学反应原理模块 一、选择题(共20小题,每题只有一个正确选项,每小题2分,共40分) 1.化学与科技、社会、生产、生活密切相关。下列有关说法不正确的是 A.铵态氮肥与草木灰混合使用,会损失肥效 B.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 C.绿色化学的核心是应用化学原理对环境污染进行治理 D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 2.下列实验操作能达到实验目的的是 A. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 B. 用排水法收集铜粉与浓硝酸反应产生的NO2 C. 用分液漏斗分离乙酸与乙醇 D. 将Cl2与HCl的混合气体通过饱和碳酸氢钠溶液可得到纯净的Cl2 3.下列说法或表示方法正确的是 A.C燃烧的热化学方程式为C(s)+1/2O2(g)CO(g) ΔH=110.5 kJ·mol-1 B.由H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于 57.3 kJ C.碳酸氢钠水解的离子方程式:HCO3-+H2OCO32-+H3O+ D.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1 4.设NA为阿伏伽德罗常数的值。下列说法正确的是 A.2L 0.5mol/L亚硫酸溶液中含有的H+离子数为2NA B.室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g D.某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目小于0.6NA 5.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是 A.NH4+、Fe2+、NO3-、SO42- B.Na+、K+、Cl-、SO42- C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl- 6.下列离子反应方程式书写正确的是 A.Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O B.向 Na[Al(OH)4] 溶液中通入过量 CO2:[Al(OH)4]- +CO2=Al(OH)3↓+HCO3﹣ C.在强碱溶液中次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4 : 3ClO﹣+2Fe(OH)3=2FeO42- +3Cl﹣+H2O+4H+ D.向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2﹣=Al2S3↓ 7.下列有关《化学反应原理》的内容说法不正确的是 A、应用盖斯定律,可计算某些难以直接测量的反应的焓变 B、向FeCl3与CuCl2溶液中加入碱式碳酸铜调节pH可以除去溶液中的FeCl3 C、使用催化剂,可以增大活化分子百分数,加快反应速率 D、为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。 8.在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是 A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1 B.在2s时体系内的压强为开始时的1.1倍 C.在平衡时体系内N2O4的物质的量为0.25mol D.平衡时,N2O4的转化率为40% 9.在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g) 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是 A.该反应的ΔH<0 B.T1时,该反应的平衡常数为1/16 C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2 D.若T2查看更多