- 2021-07-03 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省安达七中2020届高三上学期寒假考试(6)化学试卷
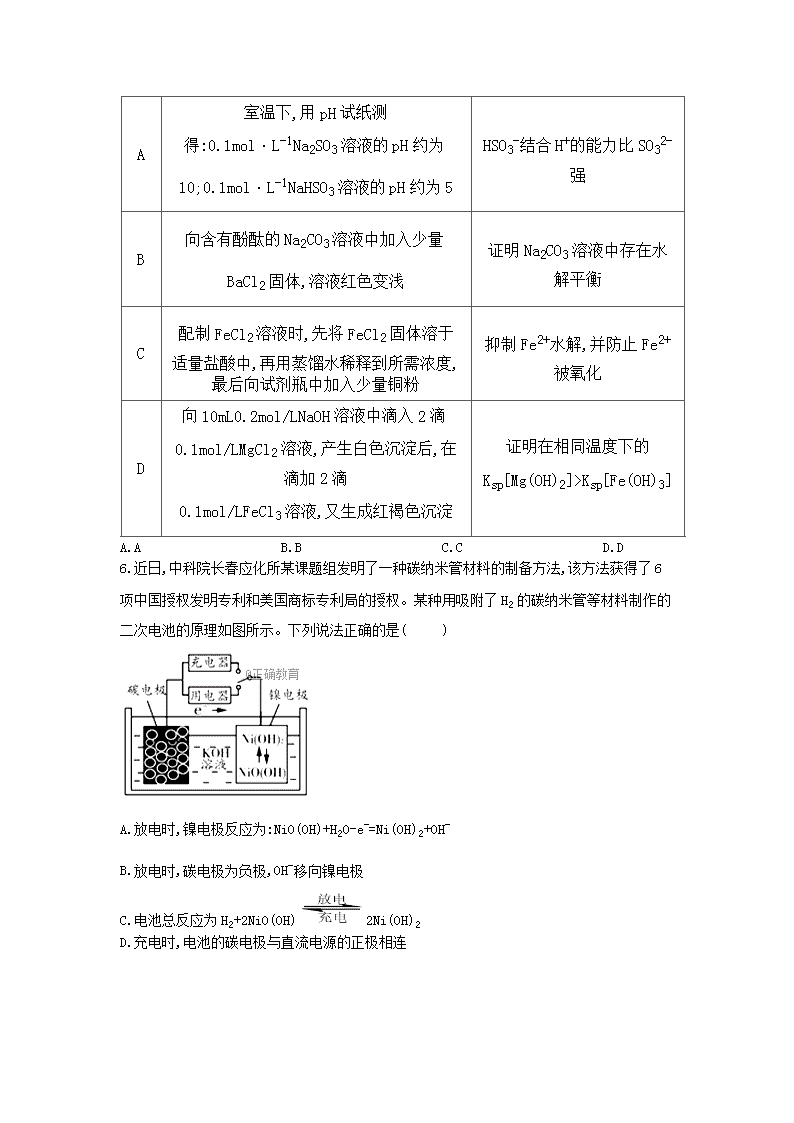
化学试卷六 一、单选题 1.化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是( ) A.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法可提高空气质量 C.肌红蛋白、蚕丝、过氧化氢酶、鱼肝油充分水解后均可得到氨基酸 D.直馏汽油和裂化汽油都可以作萃取剂 2.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) ①1mol CnH2n+2所含的共用电子对数为(3n+1)NA ②0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个 ③标准状况下,22.4L CHCl3中含有的氯原子数目为3NA ④电解精炼铜时转移了NA个电子,阳极溶解32g铜 ⑤标准状况下,2.24L Cl2溶于水,转移的电子数目为0.1NA ⑥含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA ⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA A.①④⑦ B.①⑥⑦ C.①④⑥⑦ D.②③⑤⑥ 3.分子式为的单取代芳烃,其可能的结构有( ) A.2种 B.3种 C.4种 D.5种 4.、、、、是5种短周期主族元素,原子序数依次增大;它们可组成离子化合物和共价化合物、;已知、同主族, 、、同周期,下列说法错误的是( ) A.原子半径: B.气态氢化物稳定性: C. 分子中各原子最外层电子均满足8电子结构 D. 、、三种元素组成的化合物水溶液一定显碱性 5.下列实验能达到预期目的的是( ) 选项 实验内容 实验目的 A 室温下,用pH试纸测得:0.1mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5 HSO3-结合H+的能力比SO32-强 B 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 证明Na2CO3溶液中存在水解平衡 C 配制FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铜粉 抑制Fe2+水解,并防止Fe2+被氧化 D 向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,在滴加2滴 0.1mol/LFeCl3溶液,又生成红褐色沉淀 证明在相同温度下的 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] A.A B.B C.C D.D 6.近日,中科院长春应化所某课题组发明了一种碳纳米管材料的制备方法,该方法获得了6项中国授权发明专利和美国商标专利局的授权。某种用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( ) A.放电时,镍电极反应为:NiO(OH)+H2O-e-=Ni(OH)2+OH- B.放电时,碳电极为负极,OH-移向镍电极 C.电池总反应为H2+2NiO(OH)2Ni(OH)2 D.充电时,电池的碳电极与直流电源的正极相连 7.常温下体积为1mL、浓度均为0.10mol·L-1的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lg V的变化情况如图所示,下列叙述中正确的是( ) A.XOH为弱碱 B.pH=10的两种溶液中的c(X+):XOH>X2CO3 C.已知的电离平衡常数远远大于,则约为 D.当lgV=2时,若溶液升高温度,溶液碱性增强,则减小 二、填空题 8.高锰酸钾和重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂。 1.用KMnO4标准液测定市售过氧化氢溶液中H2O2的质量分数:量取10.00mL密度为ρg/mL市售过氧化氢溶液配制成250.00mL,取25.00mL溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用KMnO4标准液滴定。重复滴定三次,平均消耗cmol/L的KMnO4标准液VmL。 ①滴定过程中发生的反应如下:KMnO4+H2O2+H2SO4→K2SO4+MnSO4+H2O+O2↑(未配平),每生成1molO2,反应转移电子的物质的量为__________;原过氧化氢溶液中H2O2的质量分数为__________。 ②验证H2O2的不稳定性的操作步骤为__________ 2.工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),部分工艺流程及相关物质溶解度曲线如图: 向Na2Cr2O7母液中加碱液调pH的目的是__________。由Na2Cr2O7生产K2Cr2O7的化学方程式为__________,通过冷却结晶析出大量K2Cr2O7的原因是__________ 3.+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。工业含铬废水的处理方法之一是将含K2Cr2O7的酸性废水放入电解槽内,用铁作阳极,加入适量的NaCl后进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。(已知:常温下Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cr(OH)3]=6.0×10-31)。 ①写出Fe2+和Cr2O7 2-反应的离子方程式________________________________。 ②用平衡移动原理解释Cr3+沉淀的原因__________________________________;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为______mol/L。 9.二氧化碳和氨气在生产、生活中具有重要作用。 1.工业上用和反应合成二甲醚。已知: ①写出加转化为和的热化学方程式是______________________________。 ②一定条件下,上述合成二甲醚的的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是_________。 a.逆反应速率先增大后减小 b. 的转化率增大 c. 的体积百分含量减小 d.容器中的值减小 2.研究发现利用可消除硝酸尾气中的污染。与的物质的量之比分别为1:3、3:1、4:1时, 脱除率随温度变化的曲线如图所示。 ①曲线中, 的起始浓度为,从点到点经过0.8,该时间段内的脱除速率为__________。 ②曲线对应的与的物质的量之比是__________,其理由是__________。 3.查阅资料可知:银氨溶液中存在平衡: ,该反应平衡常数的表达式稳_______________,已知某温度下, 稳,。计算得到可逆反应的化学平衡常数________ ,1 1氨水中最多可以溶解_______。 10.铁是一种重要的过渡元素,能形成多种物质,如做染料的普鲁士蓝(化学式为)。 1. 基态核外电子排布式为__________。 2.在普鲁士蓝中,存在的化学键有离子键、__________和__________。 3.一定条件下, 可氧化为。中三种元素的电负性由大到小的顺序为__________;碳原子采取杂化,1 该物质中含有的键数目为__________。 4.与互为等电子体的一种分子为__________(填化学式)。 5.常温条件下,铁的晶体采用如图所示的堆积方式,则这种堆积模型的配位数为_________,如果铁的原子半径为 ,阿伏加德常数的值为 ,则此种铁单质的密度表达式为______。 三、实验题 11.甲酸(HCOOH)是一种有刺激性气味的无色液体,有很强的腐蚀性、较强的还原性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。 1.实验室用甲酸与浓硫酸共热制备一氧化碳:HCOOHH2O+CO↑,实验的部分装置如图所示.制备时先加热浓硫酸至80℃﹣90℃,再逐滴滴入甲酸 ①挑选所需的仪器,补充图中虚线方框中缺少的气体发生装置:__________、e(填选项序号)(必要的塞子、玻璃管、橡胶管、固定装置已省略)。其中温度计的水银球应该处于位置。 ②装置Ⅱ的作用是__________ 2.实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,碱式碳酸铜再与甲酸反应制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体。相关的化学方程式是: 2CuSO4+4NaHCO3═Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O Cu(OH)2·CuCO3+4HCOOH+5H2O═2Cu(HCOO)2·4H2O+CO2↑ 实验步骤如下: Ⅰ、碱式碳酸铜的制备: ①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是__________。 ②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃﹣80℃,如果看到__________(填写实验现象),说明温度过高。 ③步骤ⅱ的后续操作有过滤、洗涤.检验沉淀是否已洗涤干净的方法为__________ Ⅱ、甲酸铜的制备:将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2~3次,晾干,得到产品 ④“趁热过滤”中,必须“趁热”的原因是__________。 ⑤用乙醇洗涤晶体的目的是__________。 3.请设计实验证明甲酸具有较强的还原性:__________ 12.【化学--选修5:有机化学基础】 化合物H是一种抗病毒药物,在实验室中利用芳香烃A制备H的流程如下图所示(部分反应条件已略去): 己知:①有机物B苯环上只有两种不同环境的氢原子; ②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基; ③ ④ 1.有机物B的名称为__________。 2.由D生成E的反应类型为__________,E中官能团的名称为__________。 3.由G生成H所需的“一定条件”为__________。 4.写出B与NaOH溶液在高温高压下反应的化学方程式:__________。 5.F酸化后可得R,X是K的同分异构体,X能发生银镜反应,且其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为1:1:1,写出2种符合条件的X的结构简式:__________。 6.设计由和丙醛合成的流程图:__________(其他试剂任选)。 参考答案 1.答案:B 解析: 2.答案:B 解析: 3.答案:C 解析:的单取代芳烃的结构必须满足,其中有、、、四种异构体。 4.答案:D 解析: 5.答案:B 解析: 6.答案:C 解析: 7.答案:C 解析:由常温下0.1mol·L-1的XOH溶液的pH=13知XOH是强碱,A错误;XOH为强碱,X2CO3为强碱弱酸盐,pH=10的两种溶液中X2CO3的浓度大于XOH,则c(X+):XOH查看更多