- 2021-07-02 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河北省定州中学高二上学期开学考试化学试题
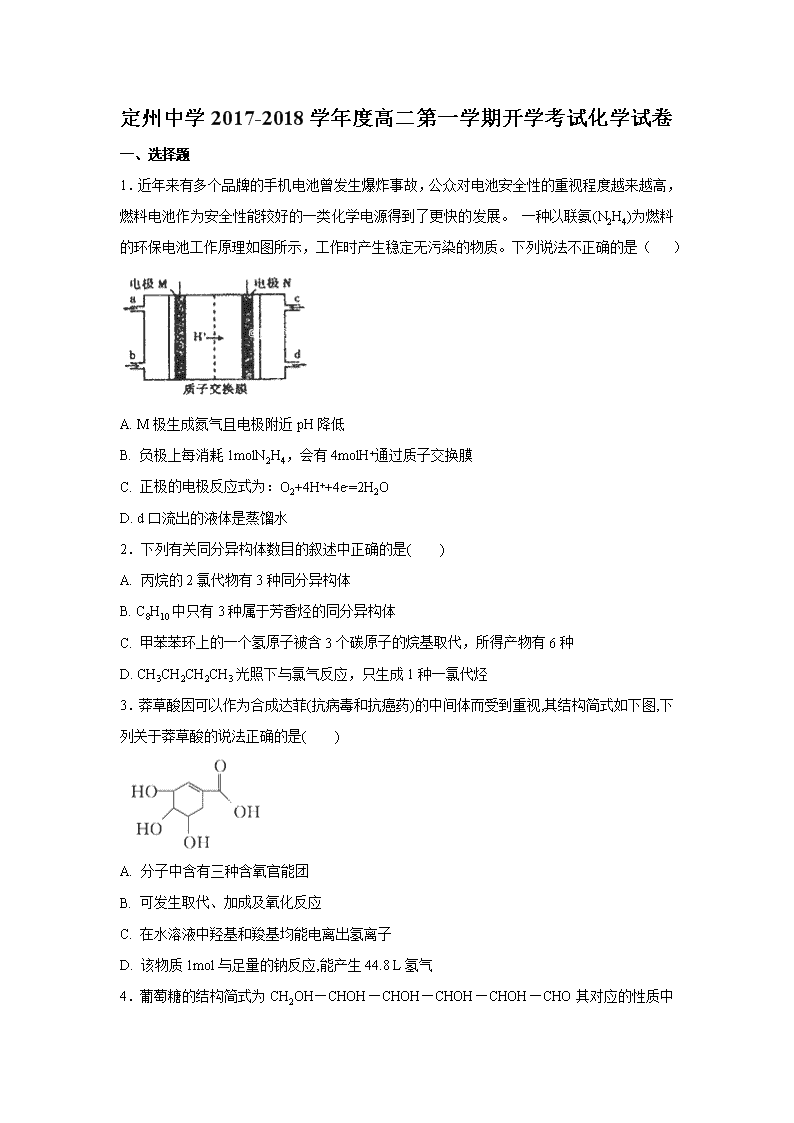
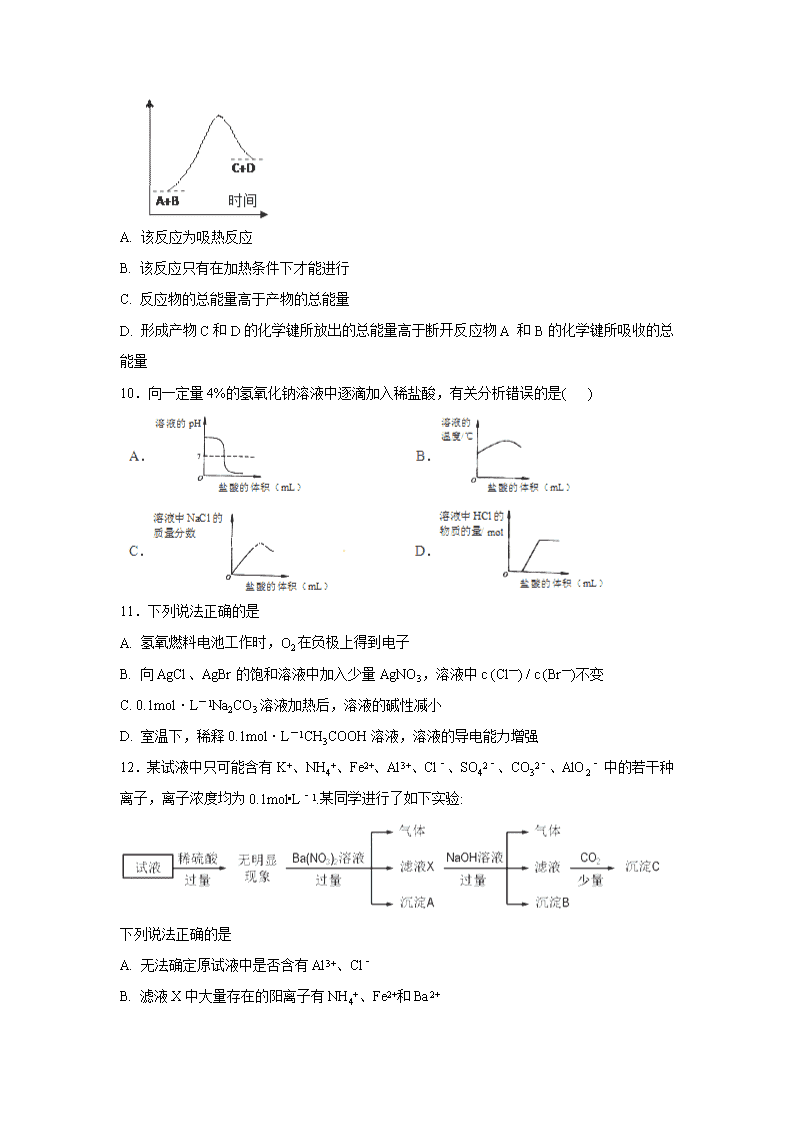
定州中学2017-2018学年度高二第一学期开学考试化学试卷 一、选择题 1.近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( ) A. M极生成氮气且电极附近pH降低 B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜 C. 正极的电极反应式为:O2+4H++4e-=2H2O D. d口流出的液体是蒸馏水 2.下列有关同分异构体数目的叙述中正确的是( ) A. 丙烷的2氯代物有3种同分异构体 B. C8H10中只有3种属于芳香烃的同分异构体 C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 D. CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃 3.莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如下图,下列关于莽草酸的说法正确的是( ) A. 分子中含有三种含氧官能团 B. 可发生取代、加成及氧化反应 C. 在水溶液中羟基和羧基均能电离出氢离子 D. 该物质1mol与足量的钠反应,能产生44.8 L氢气 4.葡萄糖的结构简式为CH2OH—CHOH—CHOH—CHOH—CHOH— CHO其对应的性质中不正确的是 A. 与钠反应放出氢气 B. 可与乙酸发生酯化反应 C. 能发生银镜反应 D. 可使小苏打溶液冒出气泡 5.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) 6.下列各组物质的性质及粒子的性质变化正确的是 A. 稳定性H2S>HCl>HBr>HI B. 酸性HF>HCl>HBr>HI C. 酸性HClO4>H2SO4>H2CO3>HClO D. 离子半径Na+>F->O2->N3- 7.汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+ PbO2(s) +2H2SO4(aq)2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是 A. PbO2是电池的负极 B. 铅蓄电池属于一次电池 C. 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) D. 电池放电时,溶液酸性增强 8.下列说法正确的是 ①离子化合物含离子键,也可能含极性键或非极性键 ②共价化合物含共价键,也可能含离子键 ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤由分子组成的物质中一定存在共价键 ⑥熔融状态能导电的化合物是离子化合物 A. ①③⑥ B. ②④⑥ C. ②③④ D. ①③⑤ 9.已知反应A+B==C+D的能量变化如图所示,下列说法正确的是 A. 该反应为吸热反应 B. 该反应只有在加热条件下才能进行 C. 反应物的总能量高于产物的总能量 D. 形成产物C和D的化学键所放出的总能量高于断开反应物A 和B的化学键所吸收的总能量 10.向一定量4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是( ) 11.下列说法正确的是 A. 氢氧燃料电池工作时,O2在负极上得到电子 B. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c (Cl—) / c (Br—)不变 C. 0.1mol·L-1Na2CO3溶液加热后,溶液的碱性减小 D. 室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力增强 12.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为0.1mol•L﹣1.某同学进行了如下实验: 下列说法正确的是 A. 无法确定原试液中是否含有Al3+、Cl﹣ B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ C. 无法确定沉淀C的成分 D. 原溶液中存在的离子为NH4+、Fe2+、Cl﹣、SO42﹣ 13.白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应: (1)2P+5CuSO4+8H2O5Cu+2H3PO4+5H2SO4 (2)11P+15CuSO4+24H2O5Cu3P+6H3PO4+15H2SO4 下列有关说法中错误的是 A. 在上述两个反应中,水既不是氧化剂也不是还原剂 B. 在上述两个反应中,氧化产物都是H3PO4 C. 在反应(2)中,当有5molCuSO4发生反应时,共转移10mol电子 D. 在上述两个反应中,氧化剂都只有硫酸铜 14.下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是 A. 升高温度,同时加压 B. 降低温度,同时减压 C. 增大反应物浓度,同时使用催化剂 D. 增大反应物浓度,同时减小生成物浓度 15.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 A. Cl-、Br-、CrO B. Br-、Cl-、CrO C. CrO、Br-、Cl- D. Br-、CrO、Cl- 16.已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是 A. 混合溶液的pH=7 B. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) C. a=b D. 混合溶液中,c(H+)=mol·L-1 17.汽车尾气中NO产生的反应为N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2 (g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是 A. 曲线b对应的条件改变可能是加入了催化剂 B. 温度T下,随着反应的进行,混合气体的密度减小 C. 温度T下,该反应的平衡常数K= D. 若曲线b对应的条件改变是温度,可判断该反应的ΔH<0 18.根据下列实验事实,不能得到相应结论的是 选项 实验操作和现象 结论 A 常温下分别测等浓度的醋酸和氨水pH,二者的pH分别为2和12 常温下,醋酸和氨水的电离平衡常数相等 B 向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol•L﹣1 FeCl3,和0.3mol•L﹣1CuCl2溶lmL,前者生成气泡的速率更快 催化效果:Fe3+>Cu2+ C 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动 D 向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀 醋酸的酸性强于H2SiO3 A. A B. B C. C D. D 19.常温下,下列有关电解质溶液的叙述正确的是 ( ) A. 等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7 B. pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性 C. pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3) D. 将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 20.下列指定反应的离子方程式正确的是( ) A. Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O B. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ D. 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- 二、计算题 21.取不同质量、相同组成的铜铁合金,每次用20.0 mL FeCl3溶液溶解,溶液中剩余金属的质量如下表所示, I II Ⅲ FeCl3溶液(mL> 20.0 20.0 20.0 铜铁合金(g) 1.8 2.4 3.6 剩余金属(g) 0.32 0.96 2.20 求:(1)合金中Fe与Cu的物质的量之比为_________。 (2)FeC13溶液的物质的量浓度为________mol • L-1. 22.取氯化钠和碳酸钠的混合固体13.9g,加入50g水使其完全溶解,滴入90.5g稀盐酸恰好完全反应,反应后所得溶液质量为150g,请计算: (1)完全反应后,生成CO2的质量为 g。 (2)混合物中碳酸钠的质量分数。 (3)反应后所得溶液中溶质的质量分数。(Na2CO3+2HCl=2NaCl+CO2↑+H2O) 参考答案 DCBDC CCAAD BDDDB DCCDD 21. 1:1 2.5 【解析】本题考查Fe3+的性质,以及化学计算,发生的反应有Fe+2Fe3+=3Fe2+、Cu+2Fe3+=2Fe2++Cu2+,II可以看作是在I的基础上加入0.6g合金,剩余固体的质量增加,说明发生Fe+Cu2+=Fe2++Cu,即I中剩余固体为Cu,I到II固体质量增加0.4g,III可以看作在II基础上加入1.2g合金,剩余金属质量增加,说明发生Fe+Cu2+=Fe2++Cu,即0.96g全部是铜单质,II→III固体质量增加1.24g,加入合金为1.2g,剩余固体质量增加0.4g,I→III固体共增加0.8g,合金中铜总质量为(0.32+0.64)g=0.96g,铁的质量为(1.8-0.96)g=0.84g,铁和铜的物质的量之比为0.84/56:0.96/64=1:1;(2)根据I,FeCl3全部参加反应,根据上述分析,铁全部参加反应,部分铜参加反应,根据得失电子数目守恒有:0.015×2+(0.015×64-0.32)×2/64=20×10-3×c(FeCl3),解得c(FeCl3)=2.5mol·L-1。 22.(1)4.4g;(2)76.3%;(3)10% 【解析】(1)由质量守恒定律可知,生成的二氧化碳的质量=13.9g+90. 5g+50g-150g=4.4g; (2)设原固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y, Na2CO3+2HCl=2NaCl+H2O+CO2↑ 106 117 44 x y 4.4 ,x=10.6g,y=11.7g,混合物中碳酸钠的质量分数=10.6g/13.9g×100%=76.3% (3)所得溶液中溶质的质量=11.7g+(13.9g-10.6g)=15.0g,得溶液中溶质的质量分数= 。查看更多