- 2021-07-02 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021新高考化学二轮总复习专题突破练7 化学反应速率和化学平衡 Word版含解析
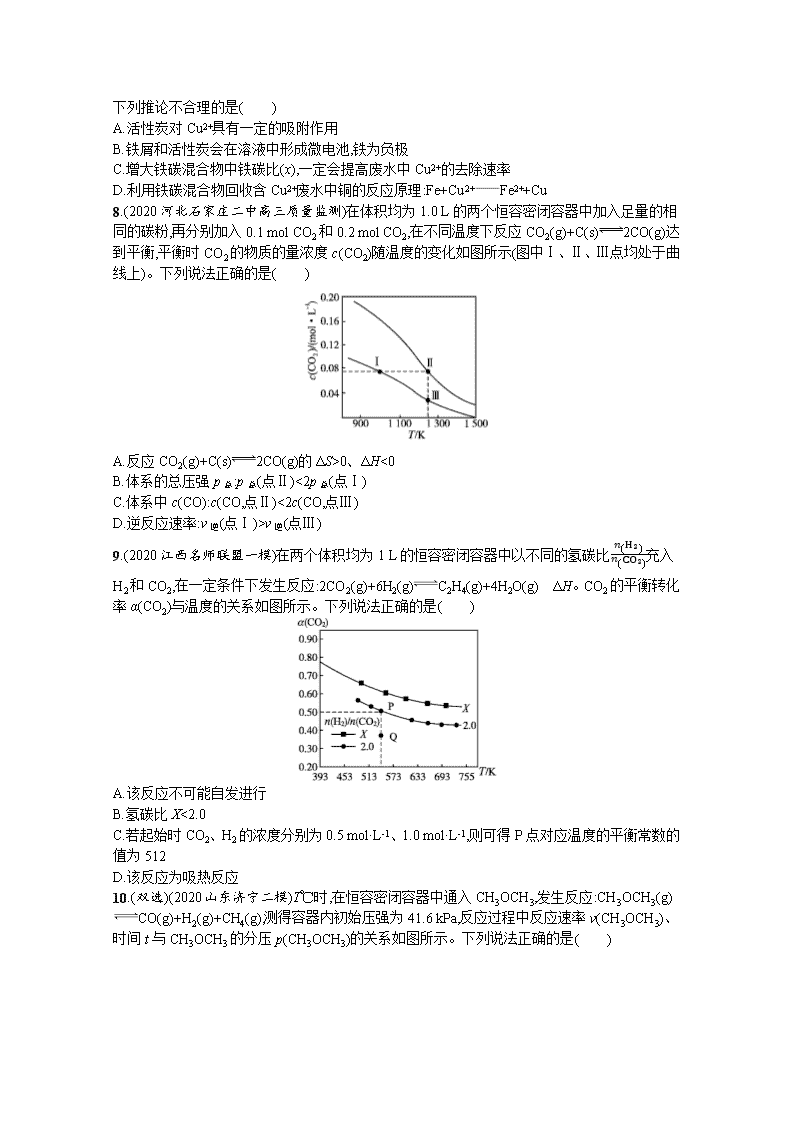
专题突破练 7 化学反应速率和化学平衡 一、选择题(本题包括 10 个小题,每题 5 分,共 50 分) 1.(2020 山东潍坊二模)燃煤工业锅炉烟气中含有 1%~3%的 CO 和 0.02%~0.04%的 NO,在新型 催化剂作用下可消除 CO 和 NO 两种有害气体,反应机理如图所示,在反应过程中 CO 可被 O2 氧化。下列说法中正确的是( ) A.温度越高越有利于有害气体消除 B.O2 浓度越大催化除杂效果越好 C.催化反应的速率由氧化吸附过程决定 D.总反应方程式为 2NO+2CO N2+2CO2 2.(2020 北京西城区高三一模)向某密闭容器中充入 NO2,发生反应:2NO2(g) N2O4(g)。其他条 件相同时,不同温度下平衡体系中各物质的物质的量分数如下表(已知 N2O4 为无色气体)。 t/℃ 27354970 NO2 20254066百分含 量/% N2O4 80756034 下列说法不正确的是( ) A.27 ℃时,该平衡体系中 NO2 的转化率为8 9 B.平衡时,NO2 的消耗速率为 N2O4 消耗速率的 2 倍 C.室温时,将盛有 NO2 的密闭玻璃球放入冰水中其颜色会变浅 D.增大 NO2 起始量,可增大相同温度下该反应的化学平衡常数 3.(2019 山东济南外国语学校高三模拟)常压下羰基化法精炼镍的一步反应为 Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4 的沸点为 42.2 ℃,固体杂质 不参与反应。 第一阶段:将粗镍与 CO 反应转化成气态 Ni(CO)4; 第二阶段:将第一阶段反应后的气体分离出来,加热至 230 ℃制得高纯镍。 下列判断不正确的是( ) A.该反应达到平衡时,v 分解[Ni(CO)4]=4v 消耗(CO) B.第一阶段应选择稍高于 42.2 ℃的反应温度 C.第二阶段,230 ℃时 Ni(CO)4 分解率较高 D.其他条件不变,增大 c(CO)时平衡向正反应方向移动,反应的平衡常数不变 4.(2020 北京东城一模)科研人员提出 CeO2 催化合成 DMC 需经历三步反应,示意图如下: 下列说法正确的是( ) A.①、②、③中均有 O—H 键的断裂 B.生成 DMC 总反应的原子利用率为 100% C.该催化剂可有效提高反应物的平衡转化率 D.DMC 与过量 NaOH 溶液反应生成 CO2- 3 和甲醇 5.(2020 河南中原名校第四次质量考评)某同学在实验室中进行如下两组实验:①T1 K 时,将 2 mL 0.02 mol·L-1 的酸性 KMnO4 溶液与 2 mL 0.2 mol·L-1 草酸溶液混合,观察到溶液完全褪色所 需要的时间是 4 s;②T2 K 时,将 2 mL 0.03 mol·L-1 的酸性 KMnO4 溶液与 2 mL 0.2 mol·L-1 草酸 溶液混合,观察到溶液完全褪色所需要的时间是 5 s。下列说法正确的是( ) A.实验①反应速率较快 B.实验②反应速率较快 C.无法比较二者反应速率的快慢 D.T2 K—定高于 T1 K 6.(2020 山东枣庄二调)在一定温度下,向 2 L 恒容密闭容器中充入 1 mol A,发生反应 2A(g) B(g)+C(g)。反应过程中 c(C)随时间变化的曲线如图所示,下列说法不正确的是( ) A.反应在 0~50 s 的平均速率 v(C)=1.6×10-3 mol·L-1·s-1 B.该温度下,反应的平衡常数 K=0.025 C.保持其他条件不变,升高温度,平衡时 c(B)=0.09 mol·L-1,则该反应的 ΔH<0 D.反应达平衡后,再向容器中充入 1 mol A,该温度下再达到平衡时,A 的转化率不变 7.(2020 陕西西安一模)工业上常用铁碳混合物处理含 Cu2+废水获得金属铜。当保持铁屑和活性 炭总质量不变时,测得废水中 Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所 示。 下列推论不合理的是( ) A.活性炭对 Cu2+具有一定的吸附作用 B.铁屑和活性炭会在溶液中形成微电池,铁为负极 C.增大铁碳混合物中铁碳比(x),一定会提高废水中 Cu2+的去除速率 D.利用铁碳混合物回收含 Cu2+废水中铜的反应原理:Fe+Cu2+ Fe2++Cu 8.(2020 河北石家庄二中高三质量监测)在体积均为 1.0 L 的两个恒容密闭容器中加入足量的相 同的碳粉,再分别加入 0.1 mol CO2 和 0.2 mol CO2,在不同温度下反应 CO2(g)+C(s) 2CO(g)达 到平衡,平衡时 CO2 的物质的量浓度 c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲 线上)。下列说法正确的是( ) A.反应 CO2(g)+C(s) 2CO(g)的 ΔS>0、ΔH<0 B.体系的总压强 p 总:p 总(点Ⅱ)<2p 总(点Ⅰ) C.体系中 c(CO):c(CO,点Ⅱ)<2c(CO,点Ⅲ) D.逆反应速率:v 逆(点Ⅰ)>v 逆(点Ⅲ) 9.(2020 江西名师联盟一模)在两个体积均为 1 L 的恒容密闭容器中以不同的氢碳比 푛(H2) 푛(CO2)充入 H2 和 CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。CO2 的平衡转化 率 α(CO2)与温度的关系如图所示。下列说法正确的是( ) A.该反应不可能自发进行 B.氢碳比 X<2.0 C.若起始时 CO2、H2 的浓度分别为 0.5 mol·L-1、1.0 mol·L-1,则可得 P 点对应温度的平衡常数的 值为 512 D.该反应为吸热反应 10.(双选)(2020 山东济宁二模)T℃时,在恒容密闭容器中通入 CH3OCH3,发生反应:CH3OCH3(g) CO(g)+H2(g)+CH4(g),测得容器内初始压强为 41.6 kPa,反应过程中反应速率 v(CH3OCH3)、 时间 t 与 CH3OCH3 的分压 p(CH3OCH3)的关系如图所示。下列说法正确的是( ) A.t=400 s 时,CH3OCH3 的转化率为 0.16 B.该温度下,要缩短达到平衡所需的时间,只可以使用催化剂 C.平衡时,测得体系的总压强 121.6 kPa,则该反应的平衡常数 Kp=4 000 D.反应速率满足 v(CH3OCH3)=k·p(CH3OCH3),则 t=400 s 时,v(CH3OCH3)=0.015 4 kPa·s-1 二、非选择题(本题包括 4 个小题,共 50 分) 11.(2020 山东青岛一模)(14 分)医用酒精在抗击“新型冠状病毒”战役中发挥着杀菌消毒的作用, 其主要成分是乙醇。回答下列问题: Ⅰ.工业上主要采用乙烯直接水合法(CH2 CH2+H2O CH3CH2OH)制乙醇。 (1)在磷酸/硅藻土催化剂作用下,乙烯进行气相水合的反应机理大致如下: ⅰ.CH2 CH2+H3O+ CH3CH+2 +H2O ⅱ.CH3CH+2 +H2O CH3CH2OH+2 ⅲ.CH3CH2OH+2 +H2O CH3CH2OH+H3O+ 随着反应进行,该过程能量变化如图所示。 下列有关说法正确的是 (填字母标号,下同)。 a.该反应过程中ⅰ~ⅲ步均释放能量 b.第ⅰ步反应的活化能最大,决定总反应速率 c.CH3CH+2 和 CH3CH2OH+2 是反应的中间产物 (2)已知:C2H4(g)+H2O(g) C2H5OH(g)的反应速率表达式为 v 正=k 正 c(C2H4)c(H2O),v 逆=k 逆 c(C2H5OH),其中 k 正、k逆为速率常数。若其他条件不变时,降低温度,则下列推断合理的是 。 a.k 正增大,k 逆减小 b.k 正减小,k 逆增大 c.k 正减小的倍数大于 k 逆 d.k 正减小的倍数小于 k 逆 Ⅱ.工业用二氧化碳加氢可合成乙醇:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。保持压强为 5 MPa,向密闭容器中投入一定量的 CO2 和 H2 发生上述反应,CO2 的平衡转化率与温度、投料比 m [ 푛(H2) 푛(CO2)]的关系如图所示。 (1)投料比由大到小的顺序为 。 (2)若投料比 m=1,一定温度下发生上述反应,下列说法不能作为反应是否达平衡判据的 是 。 a.容器内气体密度不再变化 b.容器内气体平均相对分子质量不再变化 c.CO2 的体积分数不再变化 d.容器内 푛(H2) 푛(CO2)不再变化 e.断裂 3NA 个 H—H 键的同时生成 1.5NA 个水分子 (3)若 m3=3,则 A 点温度下,该反应的平衡常数 Kp 的数值为 (Kp 是以分压表示的平衡常数); 若其他条件不变,将 A 点对应起始反应物置于某刚性密闭容器中,则平衡时 CO2 的转化率 (填“>”“=”或“<”)50%。 12.(2020 海南高三三模)(12 分)氮及其化合物与工农业生产及人们的日常生活密切相关。回答 下列问题: (1)利用某废铜下脚料(主要成分是 Cu)可制备硫酸铜晶体(蓝矾),制备方法如图所示: ①蓝矾的化学式为 。 ②废铜与浓硝酸、稀硫酸反应的化学方程式为 。 (2)工业上制备尿素的反应是 CO2(g)+2NH3(g) CO(NH2)2(l)+H2O(g) ΔH<0。一定温度下,在 容积为 5.0 L 的恒容密闭容器中加入 1.0 mol CO2 和 2.0 mol NH3,反应过程中有关物质的物质 的量(n)与时间的关系如图所示,40 s 时反应达到平衡状态。 ①曲线甲表示的物质是 (写化学式)。反应开始至达到平衡时,平均反应速率 v(NH3)= mol·L-1·s-1,NH3 的平衡转化率是 。 ②升高温度,平衡 (填“不移动”“向正反应方向移动”或“向逆反应方向移动”, 下同);及时从容器中分离出尿素,平衡 。 (3)用 Fe 电极作阳极可处理酸化后的亚硝酸盐污水,使 NO-2转化为无害气体,且溶液逐渐变为黄 色,则NO-2转化为无害气体的离子方程式为 。 13.(2019 华中师大第一附属中学高三期中检测)(12 分)工业上可通过煤的液化合成甲醇,主反应 为 CO(g)+2H2(g) CH3OH(l) ΔH=x。 (1)已知常温下 CH3OH(l)、H2 和 CO 的燃烧热分別为 ΔH(CH3OH)=-726.5 kJ·mol-1、 ΔH(H2)=-285.5 kJ·mol-1、ΔH(CO)=-283.0 kJ·mol-1,则 x= ;为提高合成甲醇反应的选择性, 关键因素是 。 (2)T K 下,在容积为 1.00 L 的某密闭容器中进行上述反应(CH3OH 为气体),相关数据如图。 ①该反应 0~10 min 的平均速率 v(H2)= ;M 点和 N 点的逆反应速率较大的是 (填“v 逆(M)”“v 逆(N)”或“不能确定”)。 ②10 min 时容器内 CO 的体积分数为 。相同条件下,若起始投料加倍,达平衡时,CO 的体积分数将 (填“增大”“减小”或“不变”)。 ③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以 Kp 表 示),其中,pB=p 总×B 的体积分数;若在 T K 下平衡时气体总压强为 x atm,则该反应 Kp= (列出计算表达式)。实验测得不同温度下的 ln K(化学平衡常数 K 的自然对数)如图,请分析 ln K 随 T 呈现图中变化趋势的原因是 。 14.(2020 山东学业水平等级考试二模)(12 分)探索氮氧化合物反应的特征及机理,对处理该类化 合物的污染问题具有重要意义。回答下列问题: (1)工业上利用 Na2CO3 溶液吸收 NO、NO2 混合气制备 NaNO2,该反应可实现 NO 和 NO2 的完 全转化,反应的化学方程式为 。 (2)NO2 可发生二聚反应生成 N2O4,化学方程式为 2NO2(g) N2O4(g),该反应达到平衡后,升高 温度可使体系颜色加深,则该反应的 ΔH 0(填“>”或“<”)。已知该反应的正反应速率方 程为 v(正)=k 正·c2(NO2),逆反应速率方程为 v(逆)=k 逆·c(N2O4),其中 k 正、k 逆分别为正、逆反应 的速率常数。则如图(lg k 表示速率常数的对数;1 푇表示温度的倒数)所示①、②、③、④四条斜 线中,能表示 lg k 正随1 푇变化关系的是斜线 ,能表示 lg k 逆随1 푇变化关系的是斜 线 。 (3)图中 A、B、C、D 点的纵坐标分别为 a+1.5、a+0.5、a-0.5、a-1.5,则温度 T1 时化学平衡常 数 K= 。已知温度 T1 时,某时刻恒容密闭容器中 NO2、N2O4 浓度均为 0.2 mol·L-1,此 时 v(正) (填“>”或“<”)v(逆);上述反应达到平衡后,继续通入一定量的 NO2,则 NO2 的 平衡转化率将 (填“增大”“减小”或“不变”,下同),NO2 的平衡浓度将 。 参考答案 专题突破练 7 化学反应速率和化学平衡 1.C 解析在一定温度下,催化剂的活性能达到最大限度,有利于有害气体的消除,若 温度过高,会使催化剂失去活性,不利于有害气体的消除,故 A 错误;O2 浓度稍微增 大,可以利于反应正向进行,但是 O2 浓度太大会把一氧化碳氧化,则不利于有害气体 的消除,故 B 错误;催化反应的速率由慢反应决定,即由氧化吸附过程决定,故 C 正确; 根据两步反应,①2NO+O2 2NO2,②2NO2+4CO N2+4CO2,可得总反应为 2NO+O2+4CO N2+4CO2,故 D 错误。 2.D 解析由表格数据可知,27℃反应达到平衡时,二氧化氮和四氧化二氮的物质的 量之比为 1∶4,则若四氧化二氮为 4mol,由方程式可知,反应消耗二氧化氮为 8mol, 起始二氧化氮为(8+1)mol=9mol,则二氧化氮的转化率为8 9,故 A 正确;平衡时,正逆反 应速率相等,由方程式可知,NO2 的消耗速率为 N2O4 消耗速率的 2 倍,故 B 正确;二 氧化氮转化为四氧化二氮的反应为放热反应,降低温度,平衡向正反应方向移动,二 氧化氮浓度减小,气体颜色变浅,故 C 正确;化学平衡常数是温度的函数,温度不变, 化学平衡常数不变,故 D 错误。 3.A 解析各物质反应的速率之比等于相应的计量数之比,该反应达到平衡时,应满 足 4v 分解[Ni(CO)4]=v 消耗(CO),A 错误;第一阶段应选择稍高于 42.2℃的反应温度,有 利于 Ni(CO)4 的生成,B 正确;230℃时 Ni(CO)4 分解反应的平衡常数较大,分解率较 高,C 正确;平衡常数是温度的函数,温度不变,平衡常数不变,D 正确。 4.D 解析根据示意图可知反应②中没有 O—H 键的断裂,A 错误;①中有水分子生 成,生成 DMC 总反应的原子利用率小于 100%,B 错误;催化剂不影响化学反应平衡, 不能提高反应物的平衡转化率,C 错误;DMC 的结构中有酯基,能与过量 NaOH 溶液 发生水解反应生成 CO2- 3 和甲醇,D 正确。 5.B 解析用 KMnO4 溶液变化表示的反应速率 v1(KMnO4)=0.01mol·L-1 4s =0.0025mol·L-1·s-1,v2(KMnO4)=0.015mol·L-1 5s =0.003mol·L-1·s-1,则实验②反应速率快,选 项 B 正确;选项 A、C 错误;由于实验②中 c(KMnO4)较实验①中 c(KMnO4)大,故 T2K 不一定高于 T1K,选项 D 错误。 6.B 解析反应在 0~50s 的平均速率 v(C)=0.08mol·L-1 50s =1.6×10-3mol·L-1·s-1,A 正确;该 温度下,平衡时,c(C)=0.10mol·L-1,则 c(B)=0.10mol·L-1,c(A)=0.50mol·L-1-0.20mol·L-1=0.30mol·L-1,反应的平衡常数 K= 0.10 × 0.10 0.302 ≈0.11,B 不正确;升高温度,平衡时 c(B)=0.09mol·L-1<0.10mol·L-1,则平衡逆 向移动,该反应的 ΔH<0,C 正确;反应达平衡后,再向容器中充入 1molA,相当于加压, 但平衡不发生移动,A 的转化率不变,D 正确。 7.C 解析活性炭具有许多细小的微孔,且表面积巨大,具有很强的吸附能力,由图像 可知,Cu2+在纯活性炭中浓度减小,表明活性炭对 Cu2+具有一定的吸附作用,故不选 A 项;铁屑和活性炭在溶液中形成微电池,其中铁具有较强的还原性,易失去电子形 成 Fe2+,发生氧化反应,因此铁作负极,故不选 B 项;由图像可知,随着铁碳混合物中铁 含量增加至 x=2∶1,Cu2+的去除速率逐渐增加;但当铁碳混合物变为纯铁屑时,Cu2+ 的去除速率又降低。当铁碳混合物中铁的含量过大时,正极材料比例降低,铁碳在废 液中形成的微电池数量减少,Cu2+的去除速率会降低,因此增大铁碳混合物中铁碳比 (x),不一定会提高废水中 Cu2+的去除速率,故选 C 项;在铁碳微电池中,碳所在电极发 生还原反应,Cu2+得到电子生成铜单质;因此该微电池的总反应方程式为 Fe+Cu2+ Fe2++Cu,故不选 D 项。 8.C 解析由气体的化学计量数增大可知 ΔS>0,由图可知温度越高,平衡时 c(CO2) 越小,则升高温度时平衡正向移动,则题给反应的 ΔH>0,故 A 错误;分别加入 0.1molCO2 和 0.2molCO2,点Ⅰ所在曲线为加入 0.1molCO2,点Ⅱ所在曲线为加入 0.2molCO2,将点Ⅱ所在曲线代表的反应看作两个 1.0L 恒容容器分别加入了 0.1molCO2,平衡后将两容器压缩为一个容器,若平衡不移动,体系的总压强为 p 总(点 Ⅱ)=2p 总(点Ⅰ),但加压 CO2(g)+C(s) 2CO(g)平衡逆向移动,体系压强减小,c(CO2) 增大,为使 c(CO2)相同,则加热使平衡正向移动,则体系的总压强又增大,由于前面压 强减小和后面压强增大的程度未知,因此无法判断 p 总(点Ⅱ)和 2p 总(点Ⅰ)的相对大 小,故 B 错误;点Ⅱ、点Ⅲ的温度相同,点Ⅱ看作先加入 0.1molCO2,与点Ⅲ平衡时 CO 的浓度相同,再加入 0.1molCO2,若平衡不移动,点ⅡCO 的浓度等于点Ⅲ的 2 倍,但再 充入 CO2,相当于增大压强,平衡左移,消耗 CO,则 c(CO,点Ⅱ)<2c(CO,点Ⅲ),故 C 正 确;点Ⅰ、点Ⅲ的温度不同,温度越高,反应速率越快,则逆反应速率为 v 逆(点Ⅰ)查看更多