- 2021-07-02 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版中和滴定图像题作业
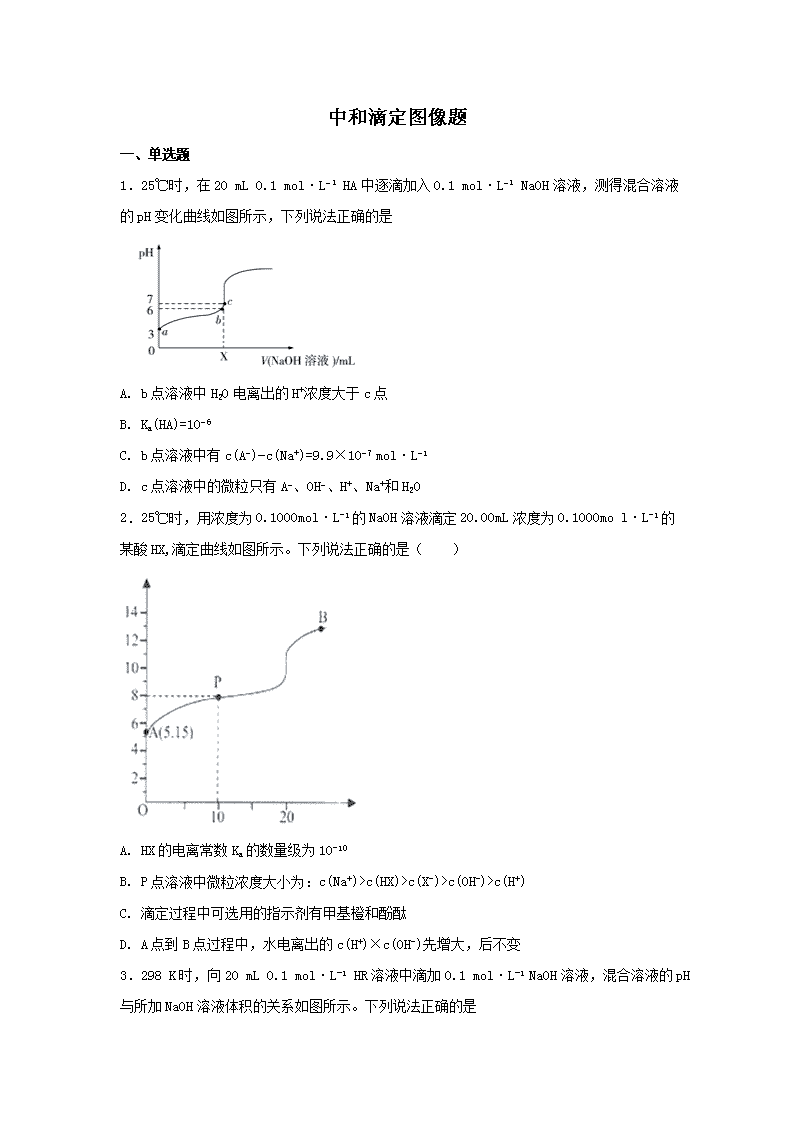
中和滴定图像题 一、单选题 1.25℃时,在20 mL 0.1 mol·L−1 HA中逐滴加入0.1 mol·L−1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 A. b点溶液中H2O电离出的H+浓度大于c点 B. Ka(HA)=10−6 C. b点溶液中有c(A−)−c(Na+)=9.9×10−7 mol·L−1 D. c点溶液中的微粒只有A−、OH−、H+、Na+和H2O 2.25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( ) A. HX的电离常数Ka的数量级为10-10 B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) C. 滴定过程中可选用的指示剂有甲基橙和酚酞 D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变 3.298 K时,向20 mL 0.1 mol·L-1 HR溶液中滴加0.1 mol·L-1 NaOH溶液,混合溶液的pH与所加NaOH溶液体积的关系如图所示。下列说法正确的是 A. ①点对应溶液中:c(Na+)>c(R-)>c(H+)>c(OH-) B. 加少量蒸馏水稀释②对应的溶液,稀释后溶液pH>7 C. ③点对应的溶液中:c(Na+)=c(OH-)+c(HR) D. 若②点坐标为(x,7),则HR的电离常数Ka= 4.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( ) A. 三种酸的电离常数关系:KHA>KHB>KHD B. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) C. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)= c(OH-)-c(H+) 5.浓度均为0.1 mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V, pH 随V的变化关系如下图所示。下列叙述不正确的是 A. HX的酸性比HY的弱,且HY是强酸 B. NaX溶液中存在关系: c(X-)+c(HX)= c(Na+) C. 相同温度下,电离常数K(HX): a=b D. ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则减小 6.常温下将NaOH溶液滴加到亚硒酸(H2SeO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是 A. Ka1(H2SeO3)的数量级为10-7 B. 曲线M表示pH与lg的变化关系 C. NaHSeO3溶液中c(OH-)>c(H+) D. 混合溶液中:lg- lg=lgKa1(H2SeO3)-lgKa2(H2SeO3)=4 7.在湿法炼锌的电解循环溶液中,较高浓度的会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 A. 的数量级为 B. 除反应为Cu+Cu2++2=2CuCl C. 加入Cu越多,Cu+浓度越高,除效果越好 D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 8.常温时,1 mol·L−1的HClO2和1 mol·L−1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液稀释后的体积)。下列说法正确的是 A. HClO2的电离方程式:HClO2H++ClO2- B. 当稀释至pH=3时,中和等体积的两种酸所用n(NaOH):HClO2>HMnO4 C. 当两溶液均稀释至lg=3时,溶液中c(H+)>c(OH-) D. 等物质的量浓度的NaMnO4和NaClO2溶液中水的电离程度相同 9.浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随的变化如图所示,下列叙述错误的是( ) A. MOH的碱性强于ROH的碱性 B. ROH的电离程度:b点大于a点 C. 若两溶液无限稀释,则它们的c(OH-)相等 D. 当=2时,若两溶液同时升高温度,则增大 10.25℃时,往某酸的钠盐Na2A 溶液中通入HCl,溶液中 和-lgc (HA-)或和-1gc (A2 -)的关系如图所示。下列说法正确的是 A. 直线L2表示 和-lgc(HA-)的关系 B. 通入HCl 过程中,水电离的c(OH-)与水电离的c(H+)的乘积不断增大 C. K(H2A)的数量级为10-7 D. 在NaHA 溶液中c(Na+ )>(HA-) > c(H2A) >c(A2-) 11.常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是 A. Ka2(H2X)的数量级为10-6 B. 曲线N表示pH与的变化关系 C. NaHX溶液中c(H+)>c(OH-) D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-) 12.常温下,向100mL 0. 1mol/LNH4Cl溶液中,逐滴滴加 0. 1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是 A. M点溶液中水的电离程度比原溶液大 B. 在M点时,n(H+)-n( OH- )=(0.005-a)mol C. 随着NaOH溶液的滴加,不断增大 D. 当n(NaOH)= 0.01mol时,c(NH3·H2O)>c( Na+)>c(OH-) 13.常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是 A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6 B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-) C. a、c两点水的c(OH-)之比为10-11.6 :10-7 D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-) 14.已知:pKa=-lgKa,25℃时H2A的pKa1=1.85;pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是 A. a点所得溶液中c(HA)+c(A2-)+c(HA-)=0.1mol/L B. b点所得溶液中:c(H2A)+2c(H+)=c(A2-)+2c(OH-) C. 对应溶液水的电离程度:a>b>c>d D. C点所得溶液中:c(Na+)>3c(HA-) 15.常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是 A. 常温下,水解常数Kh(CO32-)的数量级为10-4 B. 当溶液是中性时,溶液的总体积大于20mL C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+) D. 在B点所示的溶液中,离子浓度最大的是HCO3- 16.常温下,HA为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列不正确的是 A. 常温下,HA的电离平衡常数Ka=10-9 B. x=0时,1查看更多