- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广东省蕉岭县蕉岭中学高二上学期第三次月考化学试题 Word版
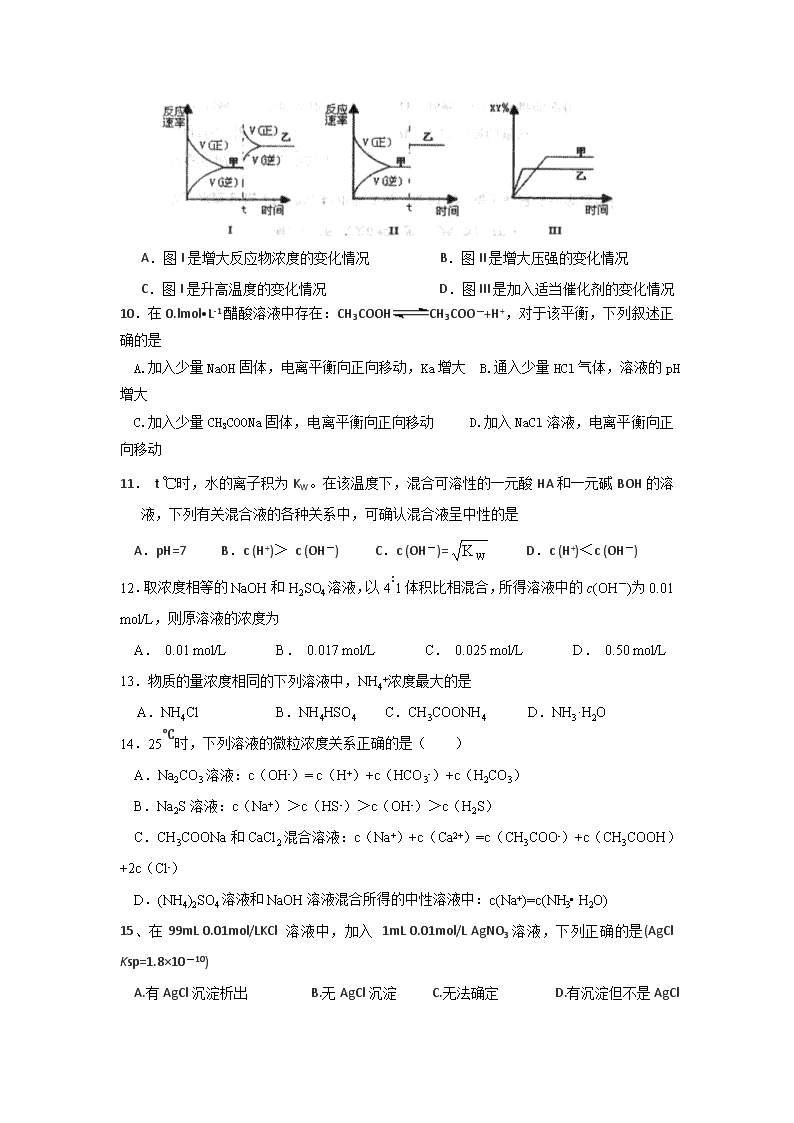
蕉岭中学2018—2019学年高二级第一学期 第三次质检化学试题 命题人:刘婕 审题人:何子龙 (考试时间为90分钟,满分100分) 相对原子质量:H:1; C:12; N:14; O:16; S:32; Na:23; Fe:56; Cu:64; Zn:65 一、选择题(每小题只有一个选项符合题意,每小题3分,共16小题,共48分) 1.下列说法正确的是 A. 用热的纯碱溶液可以清除炊具上残留的油污 B. 泡沫灭火器内的成分是苏打溶液和硫酸铝溶液 C. 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到Fe2O3 D. 将光亮Mg条放入盛有氯化铵溶液的试管中,产生的气体只有H2 2.下列说法正确的是 A. CaO+H2O=Ca(OH)2可放出大量热,可利用该反应设计成原电池,把化学能转化为电能 B. 任何化学反应中的能量变化都表现为热量变化 C. 有化学键断裂一定发生化学反应 D. 灼热的铂丝与NH3、O2混合气接触,铂丝继续保持红热,说明氨的氧化反应是放热反应 3.下列实验操作规范且能达到目的的是 目的 操作 A. 取20.00 mL盐酸 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 B. 除去锅炉中沉积的CaSO4 可用Na2CO3溶液浸泡后,再将不溶物用酸溶解去除 C. 测定醋酸钠溶液pH 用玻璃棒蘸取溶液,点在湿润的pH试纸上 D. 证明Ksp(ZnS) > Ksp(CuS) 在10ml 0.1mol/LNa2S溶液中加入几滴等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 4.氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是 A. 容器的温度保持不变 B. 容器的压强保持不变 C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6 5.设NA为阿伏加德罗常数的值,下列说法正确的是 A. 标准状况下,2.24L苯中含有的碳原子数为0.5 NA B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA C. 一定条件下,0.1molN2与0.3mol H2充分反应,生成NH3的分子数为0.2NA D.10.6g Na2CO3固体含CO32-的数目为0.1NA 6.已知:2CO(g)+O2(g)2CO2(g) ΔH=−566 kJ·mol−1; Na2O2(s)+CO2(g)Na2CO3(s)+1/2 O2(g) ΔH=−226 kJ·mol−1 根据热化学方程式和图像判断,下列说法正确的是 A.CO的燃烧热为283 kJ B.2Na2O2(s)+2CO2(s) = 2Na2CO3(s)+O2(g) ΔH >−452 kJ·mol−1 C.右图可表示由1 mol CO生成CO2的反应过程和能量关系 D.根据以上热化学方程式无法求算Na2O2(s)+CO(g) = Na2CO3(s)的反应热 7.常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是 A.由水电离产生的c(H+)=10−12 mol·L−1的溶液中:K+、Na+、ClO−、I− B.无色溶液中:K+、Fe3+、Cl−、CO32- C.pH=13的溶液中:AlO2−、Cl−、HCO3−、SO42− D.常温下,c(H+)/c(OH-)=10−12的溶液:K+、AlO2−、CO32-、Na+ 8.下列表达式书写正确的是 A.CaCO3的电离方程式:CaCO3 Ca2++CO32- B.HCO3-的电离方程式:HCO3-+H2OH3O++CO32- C.CO32-的水解方程式:CO32-+2H2OH2CO3+2OH- D.CaCO3的沉淀溶解平衡表达式:CaCO3(s)=Ca2+(aq)+CO32-(aq) 9.在密闭容器中,反应X2(g) +Y2(g) 2XY(g);△H < 0,达到甲平衡。在仅改变某一条件后,又达到乙平衡,对此过程的分析正确的是 A.图I是增大反应物浓度的变化情况 B.图II是增大压强的变化情况 C.图I是升高温度的变化情况 D.图III是加入适当催化剂的变化情况 10.在0.lmol•L-1醋酸溶液中存在:CH3COOHCH3COO—+H+,对于该平衡,下列叙述正确的是 A.加入少量NaOH固体,电离平衡向正向移动,Ka增大 B.通入少量HCl气体,溶液的pH增大 C.加入少量CH3COONa固体,电离平衡向正向移动 D.加入NaCl溶液,电离平衡向正向移动 11. t ℃时,水的离子积为KW。在该温度下,混合可溶性的一元酸HA和一元碱BOH的溶液,下列有关混合液的各种关系中,可确认混合液呈中性的是 A.pH=7 B.c (H+)> c (OH-) C.c (OH-)= D.c (H+)<c (OH-) 12.取浓度相等的NaOH和H2SO4溶液,以4∶1体积比相混合,所得溶液中的c(OH-)为0.01 mol/L,则原溶液的浓度为 A. 0.01 mol/L B. 0.017 mol/L C. 0.025 mol/L D. 0.50 mol/L 13.物质的量浓度相同的下列溶液中,NH4+浓度最大的是 A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH3·H2O 14.25℃时,下列溶液的微粒浓度关系正确的是( ) A.Na2CO3溶液:c(OH-)= c(H+)+c(HCO3-)+c(H2CO3) B.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) D.(NH4)2SO4溶液和NaOH溶液混合所得的中性溶液中:c(Na+)=c(NH3• H2O) 15、在99mL 0.01mol/LKCl 溶液中,加入 1mL 0.01mol/L AgNO3溶液,下列正确的是(AgCl Ksp=1.8×10-10) A.有AgCl沉淀析出 B.无AgCl沉淀 C.无法确定 D.有沉淀但不是AgCl 16.某温度下,Fe(OH)3 (s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是 A. Ksp[Fe(OH)3]查看更多