- 2021-07-02 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年高二化学新教材人教版必修第二册教师用书:7
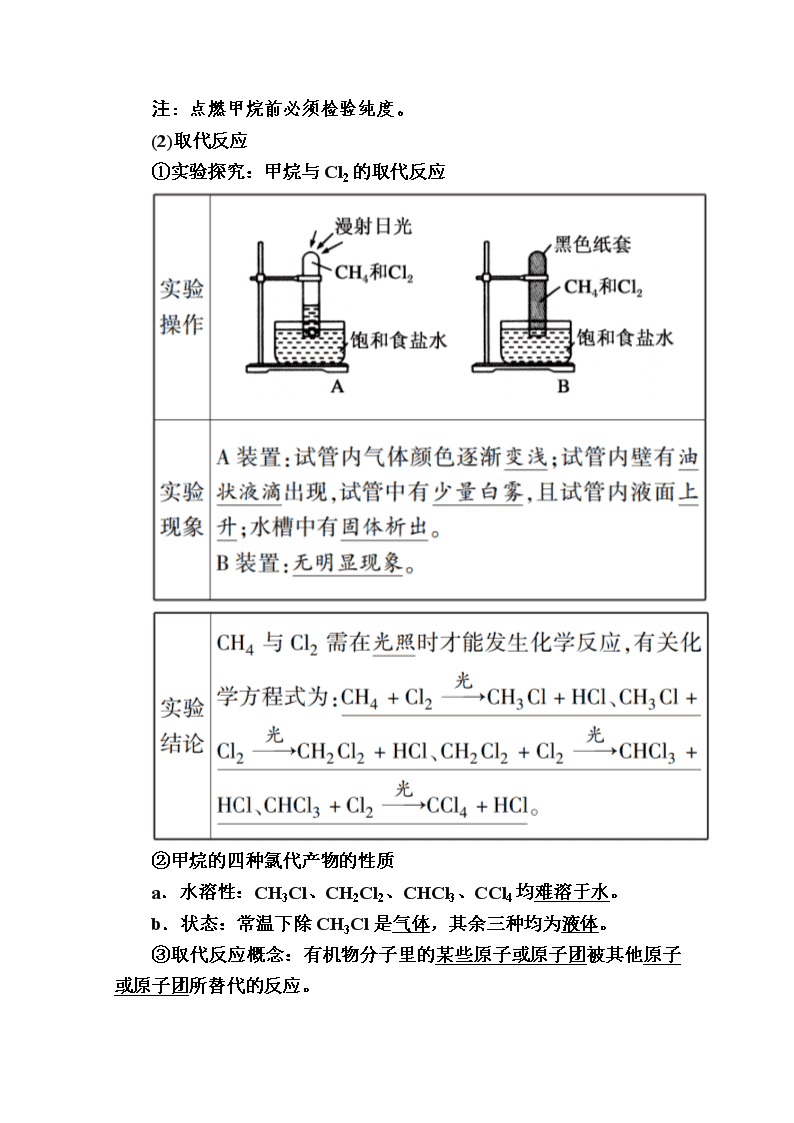
www.ks5u.com 第七章 有机化合物 第一节 认识有机化合物 第1课时 有机化合物中碳原子的成键特点和甲烷 课前自主预习 一、有机化合物中碳原子的成键特点 1.碳原子的结构 碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子。碳原子通过共价键与氢、氧、氮、硫、磷等多种非金属原子形成共价化合物。 2.碳原子的成键方式 (1)碳碳之间的结合方式有单键()、双键()、三键(—C≡C—),如CH3—CH3、 CH2===CH2、CH≡CH。 (2)多个碳原子可以相互结合成链状,也可以结合成环 状(且可带支链),如。碳链和碳环也可以相互结合。 3.甲烷的分子结构 (1)甲烷分子的不同表示方法 (2)甲烷分子的空间构型 甲烷分子中,构成以碳原子为中心,4个氢原子位于四个顶点的正四面体立体结构,两个碳氢键之间的夹角均为109°28′。 点拨:在烷烃中每一个碳原子都位于其他与之成键的四个原子(碳原子或氢原子)形成的四面体中心。 二、甲烷 1.物理性质 甲烷是一种没有颜色、没有气味的气体,密度比空气小,极难溶于水。 2.化学性质 通常状况下,甲烷性质比较稳定,与强酸、强碱、强氧化剂都不反应。但在特定的条件下,甲烷也能发生某些反应。 (1)氧化反应 甲烷在空气中燃烧的化学方程式为CH4+2O2CO2+ 2H2O;现象为安静地燃烧,火焰呈淡蓝色。 注:点燃甲烷前必须检验纯度。 (2)取代反应 ①实验探究:甲烷与Cl2的取代反应 ②甲烷的四种氯代产物的性质 a.水溶性:CH3Cl、CH2Cl2、CHCl3、CCl4均难溶于水。 b.状态:常温下除CH3Cl是气体,其余三种均为液体。 ③取代反应概念:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。 课堂互动探究 有机物分子结构和组成的表示方法 甲烷的分子结构 1.甲烷分子的结构特点 经过实验测定甲烷是一个空间正四面体结构,四个H原子分别位于正四面体的四个顶点上,C原子位于正四面体的中心, 4个C—H键的长度和强度相同,C—H键之间的夹角都是109°28′。 (1)若将CH4分子中的4个氢原子全部用其他的相同的原子或原子团替代,则形成的分子结构仍为正四面体,如CCl4。 (2)若CH4分子中的4个氢原子被其他的不同原子或原子团替代,则形成的分子结构仍为四面体,但不属于正四面体,如CH3Cl、CH2Cl2、CHCl3。 2.有机物分子中紧邻碳原子的四个原子的空间构型 有机物分子中,碳原子以四个单键与其他原子或原子团结合,则紧邻该碳原子的四个原子形成的空间结构就是四面体结构,即这四个原子一定不共平面。若这四个原子相同,则紧邻该碳原子的四个原子构成正四面体结构。 3.中学化学中常见的具有正四面体结构的物质有CH4、CCl4、P4、金刚石、晶体硅、SiO2、NH等。 甲烷的取代反应 1.甲烷与卤素单质的取代反应 反应条件 光照(强光照射会发生爆炸) 反应物 气态卤素单质和甲烷 生成物 卤化氢和各种卤代甲烷的混合物,其中生成的卤化氢最多 反应特点 ①卤素单质不同,反应速率不同 ②逐步取代,各步反应同时进行 ③取代1 mol H原子,消耗1 mol X2,生成1 mol HX 2.反应产物的性质比较 化学式 CH3Cl CH2Cl2 CHCl3 CCl4 名称 (俗称) 一氯甲烷 二氯甲烷 三氯甲烷 (氯仿) 四氯甲烷 (四氯化碳) 溶解性 不溶于水,溶于有机溶剂 不溶于水,溶于有机溶剂 不溶于水,是重要的有机溶剂 不溶于水,是重要的有机溶剂 常温状态 气态 液态 液态 液态 用途 - - 有机溶剂 有机溶剂 3.取代反应和置换反应的比较 取代反应 置换反应 举例 CH4+Cl2CH3Cl+HCl Zn+H2SO4===ZnSO4+H2↑ 定义 有机物分子里的原子或原子团被其他原子或原子团所代替的反应 一种单质跟一种化合物反应,生成另一种单质和另一种化合物的反应 反应物 一种化合物和另一种化合物或单质 一种化合物和一种单质 生成物 一般为两种新化合物 另一种化合物和另一种单质 反应中 电子得 失 不一定发生电子转移,因此不一定是氧化还原反应 一定发生电子转移,一定是氧化还原反应 反应是 否可逆 有很多是可逆反应 一般是不可逆反应 典例题组训练 题组一 有机物的结构特点 1.目前已知化合物中数量、种类最多的是ⅣA族碳的化合物(有机化合物),下列关于其原因的叙述中不正确的是( B ) A.碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 B.碳原子性质活泼,可以跟多数元素原子形成共价键 C.碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和三键 D.多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合 解析:有机物种类繁多的一个重要原因是碳原子最外层有四个电子,可以自身之间成键,也可以与其他原子成键,既可以成单键,又可以成双键或三键,且可以形成碳链,也可以形成碳环,A、C、D正确;碳原子性质不活泼,B不正确。 2.有机化合物键线式的特点是以线表示键,每个拐点和端点均表示有一个碳原子,并以氢原子补足四价,C、H不表示出来,某有机化合物的立体结构如图所示。 (1)写出该有机化合物的分子式C7H12。 (2)该有机化合物属于AB。 A.环烷烃 B.饱和烃 C.不饱和烃 D.芳香烃 解析:(1)根据键线式可知,该有机化合物有7个碳原子,因为碳原子可以形成四个共价键,故拐点的5个碳原子上各连有2个氢原子,中间2个碳原子上各连有1个氢原子,故氢原子数目为5×2+2×1=12,该有机化合物的分子式是C7H12。 (2)该有机化合物属于环烷烃,所以是饱和烃,芳香烃中必须含有苯环。 (3)碳、氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中的氢原子)。 (4)由键线式写分子式时不能忘记两端的碳原子。 题组二 甲烷的结构与性质 3.(双选)下图是CH4、CCl4、CH3Cl的分子球棍模型图,下列说法正确的是( BD ) A.CH4、CCl4和CH3Cl都是正四面体结构 B.CH4、CCl4都是正四面体结构 C.CH4和CCl4中的化学键均为非极性键 D.CH4、CCl4的结构相同,但性质不同 解析:CCl4的分子结构同CH4的分子结构,为正四面体结构,但性质不同,CH3Cl中的C—H和C—Cl键不同,不是正四面体结构。 4.下列叙述中正确的是( D ) A.甲烷分子中碳、氢原子间是离子键 B.甲烷分子的空间结构是正方体 C.甲烷的结构式为CH4 D.甲烷的取代产物CCl4分子中4个碳氯键完全相同 解析:非金属元素之间形成共价键,甲烷分子中碳、氢原子间是共价键,A错误;甲烷分子的空间结构是正四面体,而不是正方体,B错误;甲烷的结构式为,CH4为其分子式,C错误;CCl4分子同CH4结构相似,4个碳氯键完全相同,D正确。 题组三 取代反应 5.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为14)的混合气体,假定氯气在水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方,让混合气体缓慢反应一段时间。 (1)假设甲烷与氯气反应充分,且只生成一种有机物,写出发生反应的化学方程式CH4+4Cl2CCl4+4HCl。 (2)经过几个小时的反应,U形管右端的水面变化是B。 A.升高 B.降低 C.不变 D.无法确定 (3)U形管左端的气柱变化是B。 A.体积增大 B.体积减小 C.不变 (4)试分析U形管右端水面变化的原因。 答案:甲烷与氯气在光照条件下可发生的反应:①CH4+Cl2CH3Cl+HCl、②CH3Cl+Cl2CH2Cl2+HCl、③CH2Cl2+Cl2CHCl3+HCl、④CHCl3+Cl2CCl4 +HCl,反应生成的CH2Cl2、CHCl3、CCl4均是油状液体,反应后气体的物质的量减少,且生成的HCl易溶于水,故U形管左端压强减小,气柱体积减小,U形管右端的水面降低。 6.下列反应属于取代反应的是( C ) 解析:①CHCl3中的H原子被Cl原子取代,属于取代反应;②该反应属于置换反应;③该反应属于氧化还原反应;④CH3CH2 CN分子中“—CH2—”上的1个H原子被Cl原子取代,属于取代反应;⑤CH3CH2OH分子中的—OH被Br原子取代,属于取代反应。故C项正确。 核心素养 取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。 甲烷与Cl2反应 提醒:甲烷与氯气反应的产物中HCl和CH3Cl为气体,CH2Cl2、CHCl3、CCl4为液体。 【例1】 实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是( ) 【解析】 甲烷与氯气在光照条件下发生反应:CH4+Cl2CH3Cl+HCl,CH3Cl+Cl2CH2Cl2+HCl,CH2Cl2 +Cl2CHCl3+HCl,CHCl3+Cl2CCl4+HCl。黄绿色的氯气参加反应,逐渐减少,生成无色的气体,因此试管内气体颜色逐渐变浅;反应生成的HCl极易溶于水,使试管内气体压强减小,因此试管内液面上升;生成的CH2Cl2、CHCl3、CCl4均为无色油状液体,附着在试管壁上,因此试管壁上出现油状液滴;生成的HCl气体遇到水蒸气溶解生成盐酸小液滴,形成白雾,因此试管中有少量白雾。 【答案】 D 【例2】 下列反应中,属于取代反应的是( ) A.①②⑤ B.③④ C.①③ D.②④⑤ 【答案】 B查看更多