化学卷·2019届黑龙江省友谊县红兴隆管理局第一高级中学高二上学期第一次月考(2017
红兴隆管理局第一高级中学
2017-2018学年度第一学期高二月考
化学学科试卷
注:卷面分值100分; 时间:70分钟。
一、选择题(每小题只有一个正确答案,每题3分共60分)
1. 下列物质属于强电解质的是( )
A. 醋酸 B. 二氧化硫 C. 酒精 D.硝酸钾
2. 下列溶液导电性最强的是
A. 0.1mol/LCHCOOH B. 0.1mol/LNH3.H2O C. 0.1mol/LNH4Cl D. 0.1mol/L HClO
3. 已知氨水溶液中存在 NH3.H2O⇋NH4++OH-下列叙述中正确的是
A. 加水稀释NH3.H2O的电离程度加大
B. 加入少量氯化铵晶体,电离平衡向正反应方向移动
C. 降低温度对该电离平衡没有影响
D. 加少量氢氧化钠固体,电离平衡向逆反应方向移动c(OH-)减小
4. 在12Ll0.1mol/LHCl溶液中加入12mL0.1mol/L的NaOH溶液时,所得的溶液呈
A. 弱酸性 B. 中性 C. 碱性 D. 酸性
5. 某同学服用抗酸药氢氧化铝时,下列饮食中,该同学在服药期间不宜食用的是
A. 松花蛋 B. 可乐 C. 酱油 D. 陈醋
6. 中和等体积等浓度的HCl和CH3COOH所需KOH的物质的量
A. 相等 B. 中和HCl的多 C. 中和CH3COOH的多 D. 无法比较 7.下列方程式书写正确的是( )
A. HCO3-在水溶液中的水解离子方程式:HCO3-+H2O⇌H3O++CO32-
B.H2SO3的电离方程式:H2SO3⇌2H++SO32-
C. CH3COO-的水解离子方程式:CH3COO-+H2O=CH3COOH+OH-
D. HS-的水解离子方程式:. HS-+H2O⇌H2S+OH-
8. 能证明乙酸是弱酸的实验事实是 ( )
A.CH3COOH溶液与Zn反应放出H2
B.0.1mol/L CH3COONa溶液的滴入酚酞溶液后溶液变红
C.CH3COOH溶液与NaCO3反应生成CO2
D.0.01mol/LCH3COOH溶液的导电性弱
9. 下列说法中正确的是
A. 强酸的水溶液中不存在OH- B.任何条件下,c(H+)和(OH-)的乘积保持不变
C. 常温时,PH=1的溶液呈酸性。 D. 某温度时,纯水的PH=6时,其呈酸性。
10. 关于硫酸与醋酸两种稀溶液说法正确的是
A .硫酸是强电解质,醋酸是弱电解质
B .CH3COOH的电离方程式:CH3COOH + H2O = CH3COO- + H3O+
C.pH=1的两溶液均稀释100倍后,硫酸的PH=3醋酸的PH>3.
D.纯硫酸导电强于醋酸晶体
11. 用已知浓度的H2SO4溶液测定某NaOH溶液的浓度,如图甲、乙,
从下表中选出正确选项
锥形瓶中溶液
滴定管中溶液
选用指示剂
选用滴定管
A
碱
酸
甲基橙
甲
B
酸
碱
石蕊
乙
C
碱
酸
酚酞
乙
D
酸
碱
酚酞
甲
12. 常温下,a mol·L一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,
则下列关系一定正确的是
A.a=b B.a>b C.c(A-)=c(Na+) D.c(A-)
c(Cl-)>c(H+ )>c(OH﹣) B.c(Cl-)>c(NH4+ )>c(H+ )>c(OH﹣)
C.c(NH4+ )>c(Cl-)>c(OH﹣)>c(H+ ) D.c(Cl-)> c(H+ )>c(NH4+ )>c(OH﹣)
18. PH=5的某溶液中滴入下列指示剂,溶液颜色变化不正确的是
A. 甲基橙 橙色 B. 石蕊 红色
C. 酚酞 无色 D. 以上变化都不正确
19. 已知: Cl2+ H2O ⇌HCl + HClO
为了增加氯水的漂白作用,用水吸收氯气时,可以采取下了措施
A. 用热水吸收 B.水中加入稀盐酸
C.水中加入碳酸钙 D.水中加入氯化钠
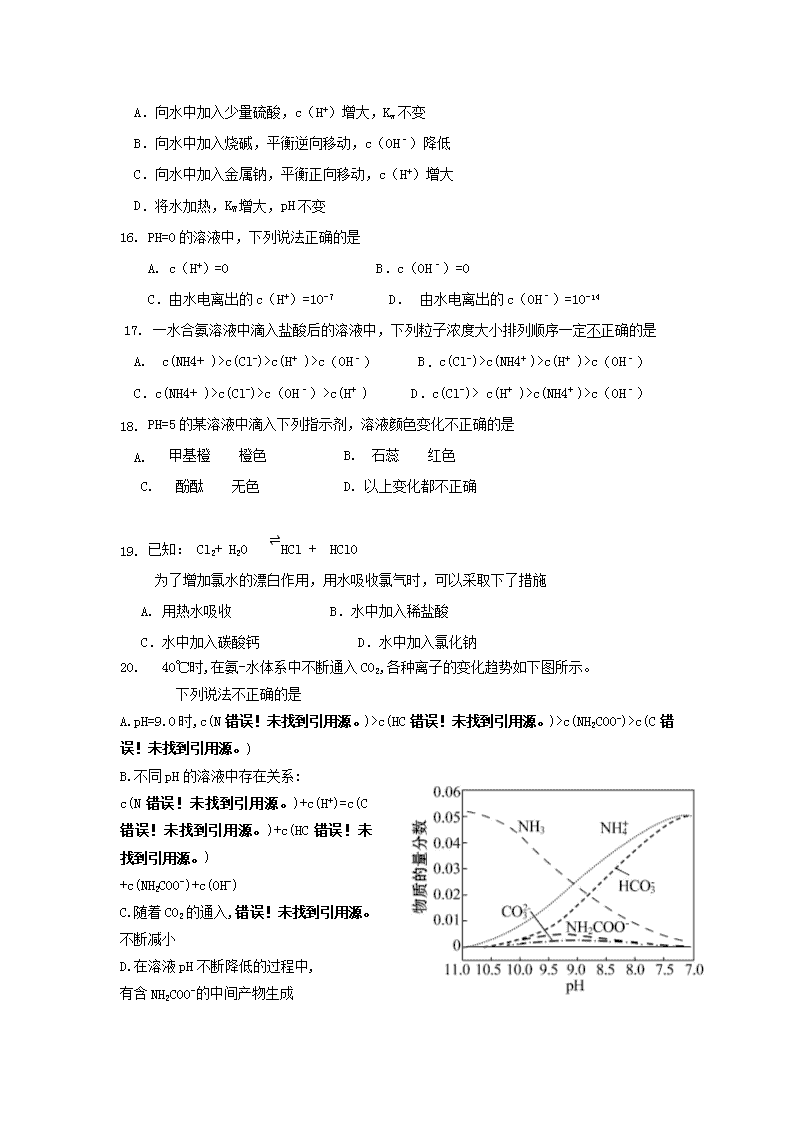
20. 40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。
下列说法不正确的是
A.pH=9.0时,c(N错误!未找到引用源。)>c(HC错误!未找到引用源。)>c(NH2COO-)>c(C错误!未找到引用源。)
B.不同pH的溶液中存在关系:
c(N错误!未找到引用源。)+c(H+)=c(C错误!未找到引用源。)+c(HC错误!未找到引用源。)
+c(NH2COO-)+c(OH-)
C.随着CO2的通入,错误!未找到引用源。不断减小
D.在溶液pH不断降低的过程中,
有含NH2COO-的中间产物生成
第II卷 非选择题 共40分
三、 填空题(14分)
21. 现有以下物质:
①氯化铁溶液 ②干冰 ③冰乙酸 ④硝酸钾晶体 ⑤液态氯化氢 ⑥纯蔗糖 ⑦硫酸钡晶体 ⑧熔融的氢氧化钡 ⑨硫酸钠溶液
(1) 其中,能导电的是: ;属于电解质的是: ;
属于非电解质的是: 。
(以上题答题时填序号,写对一半以上给1分,全对给2分,错写一个零分。)
(2) 写出下列几种物质在水溶液中的电离方程式:
硫酸氢钠 ;乙酸 ;
亚硫氢化钠 ;氢氧化钡 ;
22. 填空(7分)
(1)在25°C时,纯水中C(H+)•C(OH﹣)= ;
(2)在NH4Cl溶液中C(H+) 10﹣7mol/L(大于、小于或等于),
其溶液pH 7(大于、小于或等于);
(3) 在Na2CO3溶液中C(H+) 10﹣7mol/L (大于、小于或等于),
其溶液pH 7(大于、小于或等于)
(4) 在NaCl溶液中C(H+) 10﹣7mol/L (大于、小于或等于),
其溶液pH 7(大于、小于或等于).
23. (13分)某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。
完成以下填空:
(1) 正确操作的顺序是(用序号字母填写)
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)滴定开始后,眼睛注视_________________________________________________.
直到 后,溶液_____________________时,且 为止.
(5)下列操作中可能使所测盐酸的浓度数值偏高的是________.(漏答给1分,错答零分)
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(6)若滴定开始和结束时,碱式滴定管中的液面如图所示,
则起始读数为________mL,
终点读数为_______________________ mL;
所用盐酸溶液的浓度为____________mol/L
(保留四位有效数字)
24.(5分)25℃时,用 0.10 mol·L-1的氨水滴定10.0mL a mol • L-1的盐酸,
溶液的pH与氨水体积(V)的关系如图所示。
回答下列问题:
(1)盐酸的物质的量浓度a= mol/L
(2)P点时,溶液中各离子浓度由大到小的顺序是 。
(3)比较N点和P点水的电离程度大小, N点 P点 (填 > = < )
(4)写出M点的电荷守恒表达式
(5)已知Q点的PH=12,计算c(NH4+)-c(NH3·H2O)=
(计算结果用指数表示即可)
1
2
3
4
5
6
7
8
9
10
D
C
A
B
D
A
D
B
C
A
11
12
13
14
15
16
17
18
19
20
A
C
C
A
A
D
A
A
C
B
21. 现有以下物质:
(1) 能导电的是: ①⑧⑨ ;属于电解质的是:③④⑤⑥⑦⑧ ;
属于非电解质的是: ② ⑥ 。
22. 填空(7分)
(1) 1.0x10-14 ;0(2)在NH4Cl溶液中C(H+) 大于 10﹣7mol/L(、小于或等于),
其溶液pH 小于 7(大于、或等于);
(3) 在Na2CO3溶液中C(H+) 小于 10﹣7mol/L (大于、或等于),
其溶液pH 大于 7(、小于或等于)
(4) 在NaCl溶液中C(H+) 等于 10﹣7mol/L (大于、小于或),
其溶液pH 等于 7(大于、小于或).
23. BDCEAF
(2)________防止标准液被稀释___________________________。
(3))____偏大_____________________。
(4) _______锥形瓶中溶液__________________________________________.
直到 滴入最后一点标准液 后,溶液__由无色变红色___________________时,且 半分钟内不褪色 为止.
(5) ___A C____.
(6)若滴定开始和结束时,碱式滴定管中的液面如图所示,
则起始读数为_____0.00___mL,
终点读数为______25.90____________ mL;
所用盐酸溶液的浓度为_0.125______mol/L
(保留四位有效数字)
24.无答案