- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版一轮复习新课改省份专用版1-2一定物质的量浓度溶液的配制作业
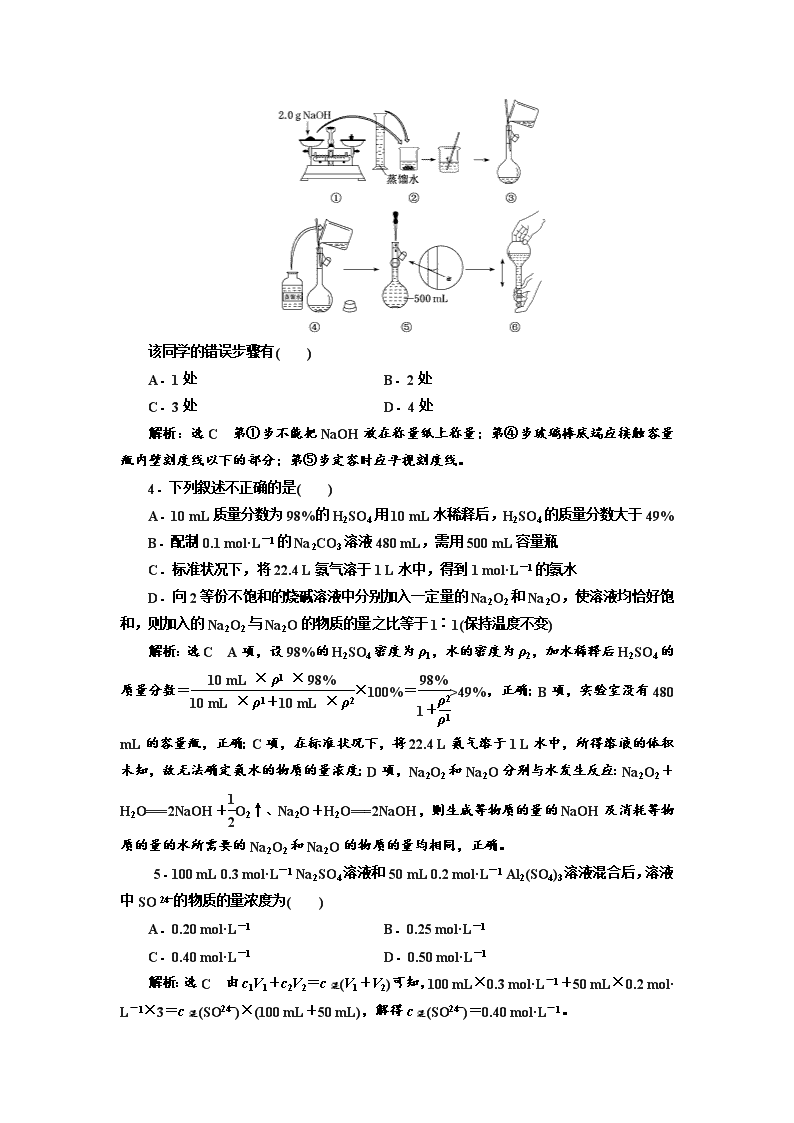
跟踪检测(二) 一定物质的量浓度溶液的配制 1.下列有关溶液的说法正确的是( ) A.将10 g CaCO3粉末加入100 mL水中,所得溶液的浓度为1 mol·L-1 B.将100 mL 2 mol·L-1盐酸加热蒸发至50 mL,所得溶液的浓度为4 mol·L-1 C.将10 mL 1.0 mol·L-1NaCl溶液与90 mL水混合,所得溶液的浓度为0.1 mol·L-1 D.将10 g CaO加入100 mL饱和石灰水中,充分搅拌,静置并恢复到原来的温度,所得溶液的浓度不变 解析:选D 将10 g CaCO3粉末加入100 mL水中,由于CaCO3难溶于水,且所得溶液体积不是100 mL,故无法判断所得溶液的浓度,A项错误;将100 mL 2 mol·L-1盐酸加热蒸发至50 mL,由于加热过程中HCl挥发,故所得溶液的浓度小于4 mol·L-1,B项错误;将10 mL 1.0 mol·L-1NaCl溶液与90 mL水混合,所得混合溶液的体积不是100 mL,故所得溶液的浓度不是0.1 mol·L-1,C项错误;将10 g CaO加入100 mL饱和石灰水中,充分搅拌,静置并恢复到原来的温度,所得溶液仍为饱和氢氧化钙溶液,温度不变,则所得溶液的浓度不变,D项正确。 2.关于0.1 mol·L-1 Na2CO3溶液的叙述错误的是( ) A.0.5 L该溶液中,Na+的物质的量浓度为0.2 mol·L-1 B.1 L该溶液中,含CO的数目小于0.1NA(NA是阿伏加德罗常数) C.从1 L该溶液中取出100 mL,则取出的溶液中Na2CO3的物质的量浓度为0.01 mol· L-1 D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol·L-1 解析:选C 由碳酸钠的化学式可知,溶液中Na+浓度为Na2CO3的2倍,所以0.1 mol· L-1 Na2CO3溶液中Na+浓度为0.2 mol·L-1,A项正确;1 L 0.1 mol·L-1 Na2CO3溶液中含有Na2CO3的物质的量为0.1 mol,CO在水中发生水解,因此该溶液中含CO的数目小于0.1NA,B项正确;溶液是均一稳定的体系,取出的100 mL Na2CO3溶液与原Na2CO3溶液浓度相同,为0.1 mol·L-1,C项错误;令稀释后的溶液浓度为c,根据稀释定律:溶液稀释前后溶质的物质的量不变,所以0.01 L×0.1 mol·L-1=0.1 L×c,解得c=0.01 mol·L-1,D项正确。 3.如图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程: 该同学的错误步骤有( ) A.1处 B.2处 C.3处 D.4处 解析:选C 第①步不能把NaOH放在称量纸上称量;第④步玻璃棒底端应接触容量瓶内壁刻度线以下的部分;第⑤步定容时应平视刻度线。 4.下列叙述不正确的是( ) A.10 mL质量分数为98%的H2SO4用10 mL水稀释后,H2SO4的质量分数大于49% B.配制0.1 mol·L-1的Na2CO3溶液480 mL,需用500 mL容量瓶 C.标准状况下,将22.4 L氨气溶于1 L水中,得到1 mol·L-1的氨水 D.向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1∶1(保持温度不变) 解析:选C A项,设98%的H2SO4密度为ρ1,水的密度为ρ2,加水稀释后H2SO4的质量分数=×100%=>49%,正确;B项,实验室没有480 mL的容量瓶,正确;C项,在标准状况下,将22.4 L氨气溶于1 L水中,所得溶液的体积未知,故无法确定氨水的物质的量浓度;D项,Na2O2和Na2O分别与水发生反应:Na2O2+H2O===2NaOH+O2↑、Na2O+H2O===2NaOH,则生成等物质的量的NaOH及消耗等物质的量的水所需要的Na2O2和Na2O的物质的量均相同,正确。 5.100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO的物质的量浓度为( ) A.0.20 mol·L-1 B.0.25 mol·L-1 C.0.40 mol·L-1 D.0.50 mol·L-1 解析:选C 由c1V1+c2V2=c混(V1+V2)可知,100 mL×0.3 mol·L-1+50 mL×0.2 mol· L-1×3=c混(SO)×(100 mL+50 mL),解得c混(SO)=0.40 mol·L-1。 6.相对分子质量为M的某物质在室温下的溶解度为S,此时测得饱和溶液的密度为d g·cm-3,则该饱和溶液的物质的量浓度是( ) A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1 解析:选A S g该物质溶解在100 g水中形成饱和溶液,则溶质的物质的量为 mol,所得溶液的体积为 mL= L,故该饱和溶液的物质的量浓度为= mol·L-1。 7.在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH的物质的量为b mol。下列叙述中正确的是( ) A.溶质的质量分数w=×100% B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w C.溶液中c(OH-)= mol·L-1 D.溶质的物质的量浓度c= mol·L-1 解析:选D 氨水中溶质为氨,该溶液的密度为ρ g·cm-3,体积为V mL,所以溶液质量为ρV g,溶质氨的质量为a g,溶质的质量分数为×100%,故A错误;水的密度比氨水的密度大,等体积的氨水与水相比,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨的质量不变,故等体积混合后所得溶液溶质的质量分数小于0.5w,故B错误;溶液中OH-来源于一水合氨、水的电离,NH的浓度为= mol·L-1,NH3·H2ONH+OH-,则一水合氨电离出的OH-为 mol·L-1,所以溶液中OH-的浓度大于 mol·L-1,故C错误;a g NH3的物质的量为= mol,溶液体积为V mL,所以溶质的物质的量浓度为= mol·L-1,故D正确。 8.某一元弱酸HX的相对分子质量为M。在t ℃时,将 a g HX完全溶解于水,得V mL饱和溶液,测得该溶液的密度为 ρg·cm-3,其中n(X-)为b mol。下列叙述不正确的是( ) A.物质的量浓度c(HX)= mol·L-1 B.t ℃时,HX的溶解度S= g C.溶液中c(H+)= D.HX的质量分数w(HX)=×100% 解析:选B a g HX的物质的量为 mol,溶于水得到V mL 饱和溶液,则c(HX)== mol·L-1,A正确;HX饱和溶液的质量分数为w(HX)=×100%=×100%,则有S= g,B错误,D正确;根据电荷守恒可得c(H+)=c(X-)+c(OH-)= mol·L-1+c(OH-)=,C正确。 9.实验室里需要配制480 mL 0.10 mol·L-1的硫酸铜溶液,下列实验用品及实验操作正确的是( ) 选项 容量瓶容积 溶质质量 实验操作 A 480 mL 硫酸铜:7.68 g 加入500 mL水 B 480 mL 胆矾:12.0 g 配成500 mL溶液 C 500 mL 硫酸铜:8.0 g 加入500 mL水 D 500 mL 胆矾:12.5 g 配成500 mL溶液 解析:选D 实验室里需要配制480 mL 0.1 mol·L-1 CuSO4溶液,由于没有480 mL规格的容量瓶,根据“大而近”的原则故需选择500 mL 容量瓶。溶质若为CuSO4则需要8.0 g,若为胆矾则需要12.5 g。应配成500 mL溶液而不是加入500 mL水。 10.下列叙述错误的是( ) A.10 mL质量分数为98%的H2SO4,用10 mL水稀释后,H2SO4的质量分数大于49% B.配制0.1 mol·L-1的Na2CO3溶液480 mL,需用500 mL 容量瓶 C.在标准状况下,将22.4 L氨气溶于1 L水中,得到1 mol·L-1的氨水 D.向2等份等浓度不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1∶1(保持温度不变) 解析:选C A项,浓硫酸的密度大于水的密度,浓度越大,密度越大,故加入等体积水稀释后,H2SO4的质量分数大于49%,正确;B项,实验室没有480 mL的容量瓶,应用500 mL 的容量瓶进行配制,正确;C项,根据c=,V指的是溶液的体积,而不是溶剂水的体积,错误;D项,发生反应:2Na2O2+2H2O===4NaOH+O2↑,Na2O+H 2O===2NaOH,由方程式可知,相同物质的量的Na2O2和Na2O消耗相同物质的量的水,生成相同物质的量的NaOH,保持温度不变,使溶液恰好饱和,故加入的Na2O2、Na2O的物质的量相等,正确。 11.用36.5%的浓盐酸(密度为1.2 g·cm-3)配制1 mol·L-1的稀盐酸100 mL,配制过程中需要用到的下列仪器有( ) ①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒 A.①③⑤⑥⑦ B.②③⑦⑤⑥ C.③⑤⑦⑥④ D.④③⑦⑤⑥ 解析:选B 先计算出需要量取的浓盐酸的体积,确定量筒的规格,所需36.5%的浓盐酸的体积为≈8.3 mL,故应选取10 mL量筒,还需要的仪器有50 mL烧杯、100 mL容量瓶、胶头滴管、玻璃棒。 12.下列说法正确的是( ) A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol·L-1 B.V L Fe2(SO4)3溶液中含a g SO,取此溶液 L用水稀释成2V L,则稀释后溶液中c(Fe3+)为 mol·L-1(不考虑Fe3+水解) C.已知某NaCl溶液的密度是1.17 g·cm-3,可求出此溶液的物质的量浓度 D.把100 mL 20%的NaOH溶液跟100 mL 10%的NaOH溶液混合后,可判断NaOH混合溶液的质量分数等于15% 解析:选B 1 L水中溶解了58.5 g(1 mol)NaCl,溶液的体积不等于1 L,故溶液的物质的量浓度不是1 mol·L-1,A项错误;V L Fe2(SO4)3溶液中含a g SO,则c(SO)= mol· L-1,又=,则该溶液中c(Fe3+)=×c(SO)= mol·L-1,取此溶液 L用水稀释成2V L,则稀释后溶液中c(Fe3+)= mol·L-1= mol·L-1,B项正确;该溶液中溶质的质量分数未知,故无法求出此溶液的物质的量浓度,C项错误;因为NaOH溶液的质量或密度未知,因此无法判断NaOH混合溶液的质量分数,D项错误。 13.用98%的浓H2SO4(密度为1.84 g·mL-1)配制1 mol·L-1的稀H2SO4 100 mL,配制过程中可能用到下列仪器:①100 mL量筒;②10 mL 量筒;③50 mL烧杯;④托盘天平;⑤100 mL 容量瓶;⑥胶头滴管;⑦玻璃棒。按使用的先后顺序排列正确的是( ) A.②⑥③⑦⑤ B.④③⑤⑦⑥ C.①③⑦⑤⑥ D.②⑤⑦⑥ 解析:选A 98%的浓H2SO4中溶质的物质的量浓度c== mol·L-1=18.4 mol·L-1,配制1 mol·L-1的稀H2SO4 100 mL需要浓硫酸的体积V=≈0.005 4 L,即5.4 mL。配制一定物质的量浓度的溶液的步骤为量取、稀释、转移、洗涤、定容、摇匀,量取浓硫酸时需要用到10 mL量筒和胶头滴管,稀释浓硫酸时需要用到烧杯和玻璃棒,转移溶液时需要用到玻璃棒,定容时需要用到100 mL容量瓶和胶头滴管,所以正确顺序为②⑥③⑦⑤。 14.某学生配制了100 mL 1 mol·L-1的硫酸,然后对溶液浓度做精确测定,且测定过程中一切操作都正确,但测得溶液的物质的量浓度小于1 mol·L-1。则在配制过程中,下列操作可能导致溶液浓度偏低的是( ) ①量筒用蒸馏水洗净后立即用来量取浓硫酸 ②将浓硫酸在烧杯中稀释,转移到100 mL的容量瓶中后,没有洗涤烧杯 ③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面 ④最后定容时,加水超过了刻度线,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切 A.只有②③④ B.只有③④ C.只有①②③ D.①②③④ 解析:选D ①量筒用蒸馏水洗净后未干燥立即量取浓硫酸,浓硫酸被稀释,所取溶质H2SO4偏少,导致溶液浓度偏低;②未洗涤烧杯,使溶质H2SO4损失,导致溶液浓度偏低;③少量溶液流到容量瓶外面,使溶质H2SO4损失,导致溶液浓度偏低;④加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失H2SO4,导致溶液浓度偏低。 15.已知某饱和NaCl溶液的体积为V mL,密度为 ρ g·cm-3,质量分数为w,物质的量浓度为 c mol·L-1,溶液中含NaCl的质量为m g。 (1)用m、V表示溶液的物质的量浓度:_________________________________________。 (2)用w、ρ表示溶液的物质的量浓度: _________________________________________。 (3)用c、ρ表示溶质的质量分数:_____________________________________________。 (4)用w表示该温度下NaCl的溶解度:___________________________________。 解析:(1)c== mol·L-1。 (2)c== mol·L-1。 (3)w=×100%=×100%。 (4)=,S= g。 答案:(1) mol·L-1 (2) mol·L-1 (3)×100% (4) g 16.实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: (1)如图所示的仪器中配制溶液肯定不需要的是________(填标号),配制上述溶液还需用到的玻璃仪器是________________(填仪器名称)。 (2)在配制NaOH溶液时: ①根据计算用托盘天平称取NaOH的质量为________g。 ②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”“<”或“=”)0.1 mol·L-1。 ③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”“<”或“=”)0.1 mol·L-1。 (3)在配制硫酸溶液时: ①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL。 ②如果实验室有15 mL、20 mL、50 mL量筒,应选用______mL量筒最好。 ③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________________________________________________。 解析:(1)配制溶液需要五种玻璃仪器:量筒、烧杯、玻璃棒、胶头滴管、500 mL容量瓶。(2)①因无450 mL的容量瓶,配制NaOH溶液要用500 mL的容量瓶,m(NaOH)=c·V·M=0.1 mol·L-1×0.5 L×40 g·mol-1=2.0 g。②移液过程中洒落少许,则NaOH物质的量减少,所得溶液浓度偏低。③NaOH溶于水放出大量热,应把它冷却至室温后再移入容量瓶中,否则定容后,溶液冷却到室温后,体积减小,浓度偏高。(3)①c(浓)·V(浓)=c(稀)·V(稀),即×V(浓)=0.5 mol·L-1×0.5 L,得V(浓)≈0.013 6 L=13.6 mL。② 选用15 mL量筒最好,误差小。③注意三点:酸入水、沿器壁、棒搅拌。 答案:(1)AC 烧杯、玻璃棒 (2)①2.0 ②< ③> (3)①13.6 ②15 ③将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌查看更多