- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广东省蕉岭县蕉岭中学高二上学期第二次质量检测化学试题 Word版
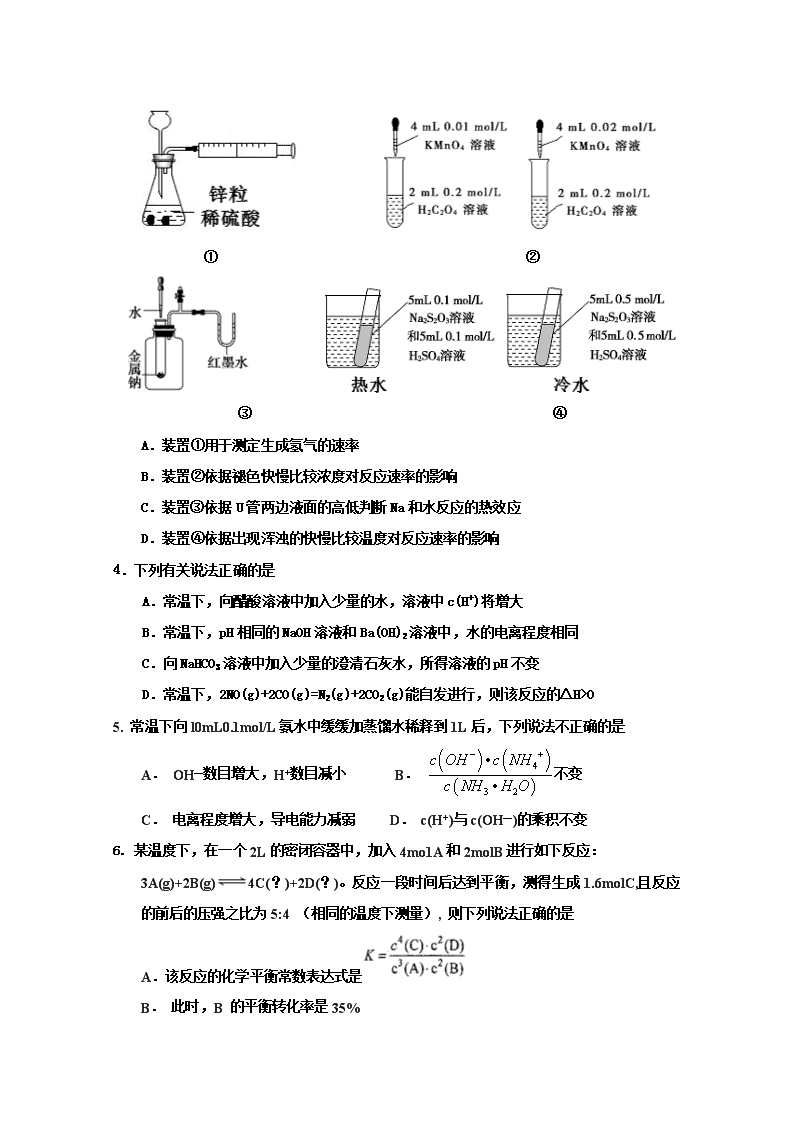
蕉岭中学2018学年第一学期高二级第二次质检 化 学 试 题 命题人:陈杏琼 审题人:刘婕 2018.11 注意:1、本试卷考试时间为90分钟,满分100分 2、请在答题卡密封线内填清楚试室号、座位号、学号、姓名、班级 3、考试结束交答题卡和答卷 可能用到的相对原子质量:H —1;C—12 ;N—14;O-16 ;Na—23; S—32; Cl—35.5;K—39 ; Fe—56;Mg —24;Al —27;Zn— 65;Cu— 64;Ba—137 第I卷 选择题(共48分) 一、选择题:(每小题只有一个正确答案。每小题3分,共48分) 1.下列热化学方程式及有关应用的叙述中,正确的是 A.甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJ•mol-1 B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJ•mol-1,则 1/2 H2SO4(aq)+ 1/2 Ba(OH)2(aq)═1/2 BaSO4(s)+H2O(l) △H = -57.3kJ•mol-1 C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g) + 3H2(g) 2NH3(g) △H = -38.6kJ•mol-1 D.已知25℃、101KPa条件下: 4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJ•mol-1, 4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJ•mol-1,则O2比O3稳定 2.下列说法正确的是 ①活化分子间的碰撞一定能发生化学反应 ②普通分子有时也能发生有效碰撞 ③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数 ④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多 ⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大 ⑥化学反应实质是活化分子有合适取向时的有效碰撞 A.①②⑤ B.③④⑥ C.③④⑤⑥ D.②③④ 3.下列装置或操作能达到目的的是 ① ② ③ ④ A.装置①用于测定生成氢气的速率 B.装置②依据褪色快慢比较浓度对反应速率的影响 C.装置③依据U管两边液面的高低判断Na和水反应的热效应 D.装置④依据出现浑浊的快慢比较温度对反应速率的影响 4.下列有关说法正确的是 A.常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 C.向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 D.常温下,2NO(g)+2CO(g)=N2(g)+2CO2(g)能自发进行,则该反应的△H>0 5. 常温下向l0mL0.1mol/L氨水中缓缓加蒸馏水稀释到1L后,下列说法不正确的是 A. OH—数目增大,H+数目减小 B. 不变 C. 电离程度增大,导电能力减弱 D. c(H+)与c(OH—)的乘积不变 6. 某温度下,在一个2L的密闭容器中,加入4mo1A和2molB进行如下反应: 3A(g)+2B(g)4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应的前后的压强之比为5:4 (相同的温度下测量), 则下列说法正确的是 A.该反应的化学平衡常数表达式是 B. 此时,B 的平衡转化率是35% C.增加C的量,B的平衡转化率不变 D.增大该体系的压强,平衡向右移动化学平衡常数增大 7.设NA为阿伏加德罗常数的值,下列说法正确的是 A.2.0gH218O与D2O的混合物中所含中子数为NA B.1L0.1mol/L氨水含有0.1NA个OH- C.1molNa被完全氧化生成Na2O2,失去2NA个电子 D.标准状况下,22.4L苯中所含的分子数为NA 8. 化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是 A.铝热反应中,反应物的总能量比生成物的总能量低 B.图I所示的装置能将化学能转变为电能 C.图II所示的反应为吸热反应 D.化学反应中能量变化的主要原因是化学键的断裂与生成 9. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是 A B C D 0~3s内,反应速率v(O3)=2mol·L-1·s-1 降低温度,平衡常数增大 t1时仅加入催化剂,平衡正向移动 达平衡时,仅改变x,则x为c(O2) 10.一定条件下,反应:C(s)+CO2(g)2CO(g),ΔH>0在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40 mol,则下列说法正确的是 A.反应20s,C的平均反应速率v (C) =0. 005 mol·L-1·s-1 B.反应平衡时,v (CO2): v (CO) =1:2 C.升高温度时,正反应速率增大,逆反应速率减小 D.充入N2使体系压强增大,能提高反应速率 11.H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如右图所示。下列说法正确是 A.有MnO2条件下的反应曲线是a曲线 B.a曲线变为b曲线,反应的活化分子百分数增大 C.a曲线变为b曲线,平衡时H2O2的转化率增大 D.b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2 )KJ •mol-1 12. 可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 A.使用催化剂,C的物质的量分数增加 B.升高温度,平衡向逆反应方向移动 C.化学方程式系数a>c+d D.根据图像无法确定改变温度后平衡移动方向 13. 在已达到电离平衡的0.1 mol/L醋酸溶液中,欲使平衡向电离方向移动,且同时使溶液的PH降低,可采取的措施是 A.加少量浓盐酸 B.加少量水 C.加少量醋酸钠晶体 D.加热 14. 常温下,下列各组离子在指定溶液中一定能大量共存的是 A.滴入酚酞溶液显红色的溶液中: K+、Na+、Cu2+、SO42- B.能使红色石蕊试纸变蓝色的溶液中: K+、CO32- 、NO3- 、AlO2- C.由水电离产生的(H+) = 10-13mol/L的溶液中:Na+、Cl-、NO3-、CH3COO- D. pH = l 的溶液中: Na+、Fe2+、NO3-、Cl- 15.对下列图像描述正确的是 A.图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化 B.根据图②可判断可逆反应A2(g)+3B2(g)2AB3(g)的ΔH>0 C.图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的锌粉发生反应产生氢气的体积(V)随时间的变化的示意图 D.图④可表示压强对可逆反应A(g)+B(g)2C(g)+D(g)的影响,乙的压强大 16.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是 A.配制标准溶液的固体KOH中混有NaOH杂质 B.滴定到终点读数时,仰视滴定管的刻度,其他操作正确 C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 第Ⅱ卷 非选择题(共52分) 17.(共12分) (1)一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸溶液.(用序号abc填空) ①当其物质的量浓度相同时,c(H+)由大到小的顺序是 . ②当其pH相同时,物质的量浓度由大到小的顺序为 .将其稀释10倍后,pH由大到小的顺序为 . (2)某温度下,纯水中的c (H+)= 4.0×10-7 mol/L, 则此温度下纯水中的c (OH-)= mol/L; 若温度不变, 滴入稀NaOH溶液, 使c (OH-)= 5.0×10-6 mol/L,则溶液的c (H+)= mol/L. (3)在25℃时,100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合, 混合后溶液的pH= _______________ 18.(10分)(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表: 物质 T/℃ n/mol NO CO E F 初始 0.100 0.100 0 0 T1 0.020 0.020 0.080 0.040 T2 0.010 0.010 0.090 0.045 ① 请结合上表数据,写出NO与CO反应的化学方程式 。 ② 根据表中数据判断,温度T1和T2的关系是(填序号)_________________________。 A.T1>T2 B.T1查看更多
相关文章
- 当前文档收益归属上传用户