- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西桂林市第十八中学2019-2020学年高一下学期开学考试化学试题
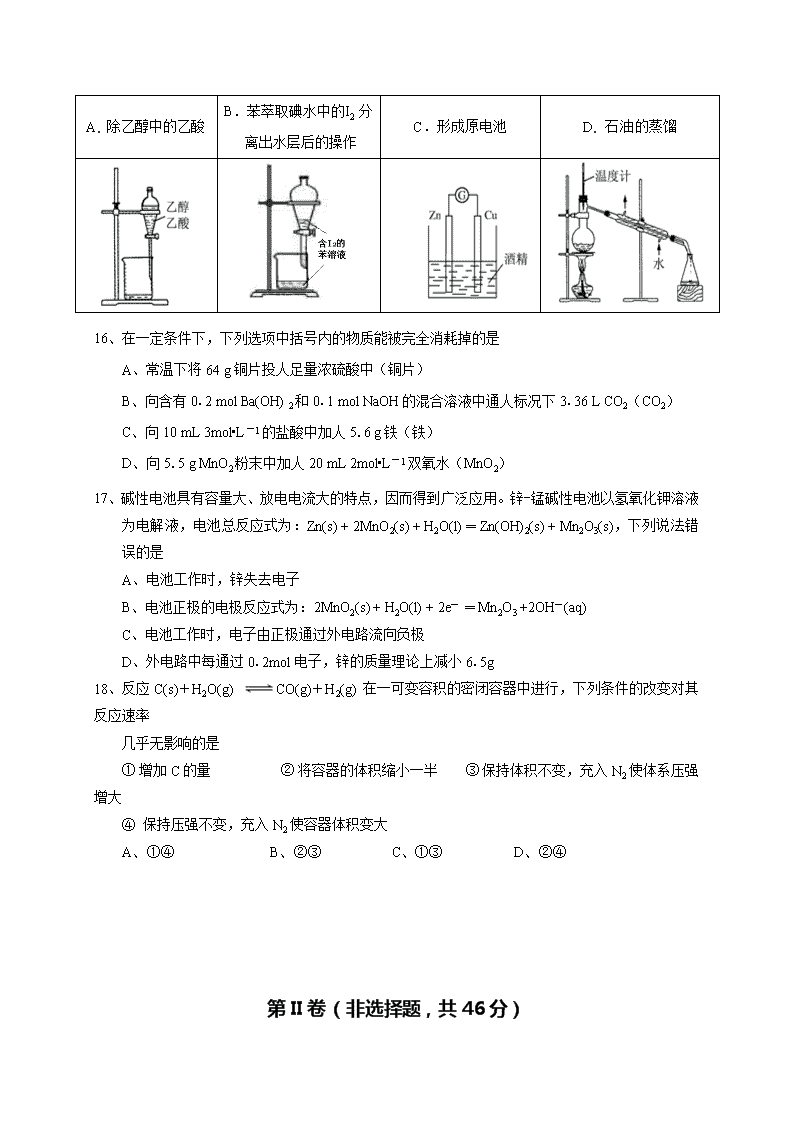
桂林十八中2019-2020学年度19级高一下学期开学考试卷 化 学 注意事项: ① 试卷共 6 页,答题卡2页。考试时间90分钟,满分100分; ② 正式开考前,请务必将自己的姓名、考号用黑色水性笔填写清楚并张贴条形码; ③ 请将所有答案填涂或填写在答题卡相应位置,直接在试卷上做答不得分。 可能用到的相对原子质量:H—1 C—12 O—16 Mn—55 Fe—56 Co—59 Cu—64 Zn—65 第I卷(选择题,共54分) 一、选择题(本题包括18小题,每小题3分,只有一个选项符合题意,共54分) 1、据报载我国最近合成新的同位素,其中一种是 (铪),它的中子数是 A、72 B、113 C、185 D、257 2、下列物质中属于有机物的是 ①酒精;②食盐;③石墨;④甲烷;⑤红糖;⑥水;⑦一氧化碳;⑧石灰石;⑨食用油;⑩醋酸 A、①②④⑤⑦⑨ B、①④⑤⑨⑩ C、①③④⑤⑦⑧⑨⑩ D、①④⑤⑥⑩ 3、某烷烃含200个氢原子,则该烃的分子式是 A、C97H200 B、C98H200 C、C99H200 D、C100H200 4、化学科学需要借助化学专用语言描述,下列有关化学用语正确的是 A、戊烷的分子式 C5H8 B、质量数为37的氯原子 17 37Cl C、乙烯的结构简式 C2H4 D、Cl-的结构示意图 5、随着卤素原子半径的增大,下列递变规律正确的是 A、单质的熔点逐渐降低 B、单质氧化性逐渐增强 C、气态氢化物稳定性逐渐增强 D、卤素离子还原性逐渐增强 光照 6、加成反应是有机化学中的一类重要的反应,下列属于加成反应的是 点燃 A、CH3Cl + Cl2 CH2Cl2 + HCl 高温高压 催化剂 B、CH4 + 2O2 CO2 +2H2O C、CH2=CH2 + H2O CH3—CH2OH 催化剂 D、 + Br2 HBr + 7、某元素气态氢化物的化学式为H2X,则此元素最高价氧化物水化物的化学式应是 A、H2XO3 B、H2XO4 C、H3XO4 D、HXO4 8、下列说法正确的是 A、含有离子键的化合物必是离子化合物 B、含有共价键的化合物就是共价化合物 C、共价化合物可能含离子键 D、离子化合物中一定含有共价键 9、下列各组顺序的排列不正确的是 A、原子半径:Na < Mg < Al B、热稳定性:HCl > H2S > PH3 C、酸性强弱:H2SiO3 < H2CO3 < HNO3 D、碱性强弱:KOH > NaOH > Mg(OH)2 10、下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是 编号 金属(粉末状) 酸的浓度 酸的体积 反应温度 A 0.1mol Mg 6mol/L硝酸 10mL 60℃ B 0.1mol Mg 3mol/L盐酸 10mL 60℃ C 0.1mol Fe 3mol/L盐酸 10mL 60℃ D 0.1mol Mg 3mol/L盐酸 10mL 30℃ 11、现在实验室中需要少量的一氯乙烷,下列制取方法中所得产物含量最高的是 A、乙烷与氯气光照反应 B、乙烯与氯气加成反应 C、乙烯与氢气、氯气混和气体反应 D、乙烯与氯化氢加成反应 12、阿伏加德罗常数的值为NA。下列说法正确的是 A、16 g 氧化铜和硫化亚铜的固体混合物中中含有铜原子数为0.2NA B、1 mol NaHSO4固体中阴阳离子总数为3NA C、22.4 L(标准状况下)辛烷的分子数为NA D、标准状态下NA个SO3分子的体积约为 22.4 L 13、对相同状况下的12C18O和14N2两种气体,下列说法正确的是 A、若质量相等,则质子数相等 B、若原子数相等,则中子数相等 C、若分子数相等,则体积相等 D、若体积相等,则密度相等 14、某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是 A、(A-N+m)mol B、(A-N)mol C、(A-N)mol D、(A-N+m)mol 15、下列操作或装置能达到实验目的的是 A. 除乙醇中的乙酸 B.苯萃取碘水中的I2 分 离出水层后的操作 C.形成原电池 D. 石油的蒸馏 16、在一定条件下,下列选项中括号内的物质能被完全消耗掉的是 A、常温下将64 g铜片投人足量浓硫酸中(铜片) B、向含有0.2 mol Ba(OH) 2和0.1 mol NaOH的混合溶液中通人标况下3.36 L CO2(CO2) C、向10 mL 3mol•L-1的盐酸中加人5.6 g铁(铁) D、向5.5 g MnO2粉末中加人20 mL 2mol•L-1双氧水(MnO2) 17、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s) + 2MnO2(s) + H2O(l) ═ Zn(OH)2(s) + Mn2O3(s),下列说法错误的是 A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s) + H2O(l) + 2e- ═ Mn2O3 +2OH-(aq) C、电池工作时,电子由正极通过外电路流向负极 D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g 18、反应C(s)+H2O(g) CO(g)+H2(g) 在一可变容积的密闭容器中进行,下列条件的改变对其反应速率 几乎无影响的是 ① 增加C的量 ② 将容器的体积缩小一半 ③ 保持体积不变,充入N2使体系压强增大 ④ 保持压强不变,充入N2使容器体积变大 A、①④ B、②③ C、①③ D、②④ 第II卷(非选择题,共46分) 二、填空题(本题包括4题,共46分) 19、(共8分)现有三种常见元素的性质或结构如下表: X 与Al同周期,金属性最强 Y 与Al同周期,最外层电子数是最内层电子数的3倍 Z 常温下单质为双原子分子,为黄绿色有毒气体 W 单质紫黑色,遇淀粉溶液显蓝色 ⑴ X元素的名称是 ; Y的原子结构示意图是 ; W在元素周期表中的位置是 ; ⑵ 请写出Z的单质与X元素最高价氧化物所对应水化物的溶液在常温下反应的离子方程式 ; ⑶ 判断非金属性Z Y(填“>”或“<”),请用离子方程式进行说明: 。 20、(10分)合成氨工业是贵州省开磷集团的重要支柱产业之一。氨是一种重要的化工原料,在工农业生产中有广泛的应用。 ⑴ 在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g) 2NH3(g)。该可逆反应达到平衡的标志是 。 a、3v正(H2)=2v逆(NH3) b、单位时间生成m mol N2的同时生成3m mol H2 c、容器内的总压强不再随时间而变化 d、混合气体的密度不再随时间变化 ⑵ 工业上可用天然气原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的 原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题: 时间/min CH4(mol) H2O(mol) CO(mol) H2(mol) 0 0.40 1.00 0 0 5 a 0.80 c 0.60 7 0.20 b 0.20 d 10 0.21 0.81 0.19 0.64 ① 写出工业用天然气原料制取氢气的化学方程式: 。 ② 分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。 ③ 反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。 a、减少CH4的物质的量 b、降低温度 c、升高温度 d、充入H2 21、(14分)某有机物 A 由 C、H、O 三种元素组成,在一定条件下,A、B、C、D、E 之间的转变关系如 下图所示,请根据图示回答下列问题: ⑴ C 的官能团名称是 ,D 的结构简式为: 。 ⑵ 图示反应中的①、③反应类型分别属于 、 。 ⑶ 下列说法不符合乙烯的是 (填写编号)。 a、乙烯在光照条件下易与氯气发生取代反应 b、乙烯分子中的所有原子处在同一平面上 c、可用燃烧法区分甲烷、乙烯和乙炔 ⑷ 图示中反应①和③的化学方程为: , 。 △ ⑸ A 的同分异构体中(不包括A本身)与 A 属于同类物质的有 种,其中只有一个甲基的同分异构体的结构简式为 。 22、(1 4分)钴(Co)的氧化物是一种重要的化工原料,工业上利用反应CoCO3 + O2 CoxOy + CO2 来 生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。△ 请填写下列空白: ⑴ 写出A装置的大试管里发生反应的化学方程式 ; ⑵ E装置的U形管里盛放的物质是 ; A、P2O5 B、无水CaCl2 C、碱石灰 D、无水CuSO4 ⑶ O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B 装置中所盛放的物质是 ; A、NaOH溶液 B、饱和NaHCO3溶液 C、饱和NaCl溶液 D、KI溶液 ⑷ 实验结束时,若先撤去A装置中的酒精灯,会引起 ; ⑸ 在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为 ;请写出详细的计算过程 。 ⑹ 此实验装置存在一个比较大的缺陷,如何完善 。 2019-2020学年度19级高一下学期开学考化学答案 1-5:BBCDD 6-10:CBAAB 11-15: DACDD 16-18:BCC 19、⑴ 钠(1分) ; (1分); 第五周期第ⅦA族 ;(1分) ⑵ Cl2 + 2 OH- = Cl-+ ClO- + H2O (2分) ⑶ >(1分) Cl2 + S2- = S↓+ 2 Cl- 或 Cl2 + H2S = S↓+ 2 Cl-+ 2 H+(2分) 20、⑴ c(2 分) ⑵ ① CH4(g)+H2O (g) CO(g) +3H2 (2分) ② 是(2 分) 0.020 mol·L-1·min-1 (2分) ③ d(2分) 21、⑴ 羧基(1 分) CH3CHO(1 分) ⑵ 取代或水解反应(1 分)氧化反应(1 分) ⑶ a(2 分) ⑷ CH3COOCH2CH3 + H2O CH3CH2OH + CH3COOH(2 分) 2CH3CH2OH + O2 2CH3CHO + 2H2O(2 分) ⑸ 3(2分) HCOOCH2CH2CH3 (2分) 22、⑴ 2KClO3 ===== 2KCl + 3O2↑ (2分) ⑵ C(2分) ⑶ D(2分) ⑷ 倒吸(2分) ⑸ Co2O3 (2分) n(Co)= n(CoCO3)= n(CO2)= =0.1mol n(O)==0.15mol x:y = 0.1:0.15 = 2:3(2分) ⑹ 在a处接一装有碱石灰的干燥管(2分。干燥剂若不能吸收CO2不给分) 查看更多