2019高考化学高分突破二轮复习专题八化学反应速率和化学平衡备考备查清单学案
备考备查清单
[知识体系]
1.化学反应速率
2.化学平衡
[规律方法]
1.通过数据比较反应速率大小的方法——“一看二转三比较”
第一步:看单位是否统一;
第二步:将不同物质表示的化学反应速率转化成用同一物质表示的化学反应速率;
第三步:比较数值确定大小。
2.惰性气体对化学反应速率的两种影响
(1)恒温恒容:充入“惰性气体”―→总压增大―→
物质浓度不变(活化分子浓度不变),反应速率不变。
(2)恒温恒压:充入“惰性气体”―→体积增大―→物质浓度减小(活化分子浓度减小)―→反应速率减慢。
3.判断平衡状态的方法——“逆向相等,变量不变”
(1)“逆向相等”:反应速率必须一个是正反应速率,一个是逆反应速率,且经过换算后同一种物质的消耗速率和生成速率相等。
(2)“变量不变”:如果一个量是随反应进行而改变的,当不变时为平衡状态;一个随反应的进行保持不变的量,不能作为是否平衡状态的判断依据。
(3)巧记“变量不变”判断法
①由“变”到“不变”,不变时达到平衡。
②由“不变”到“不变”,不变时无法判断。
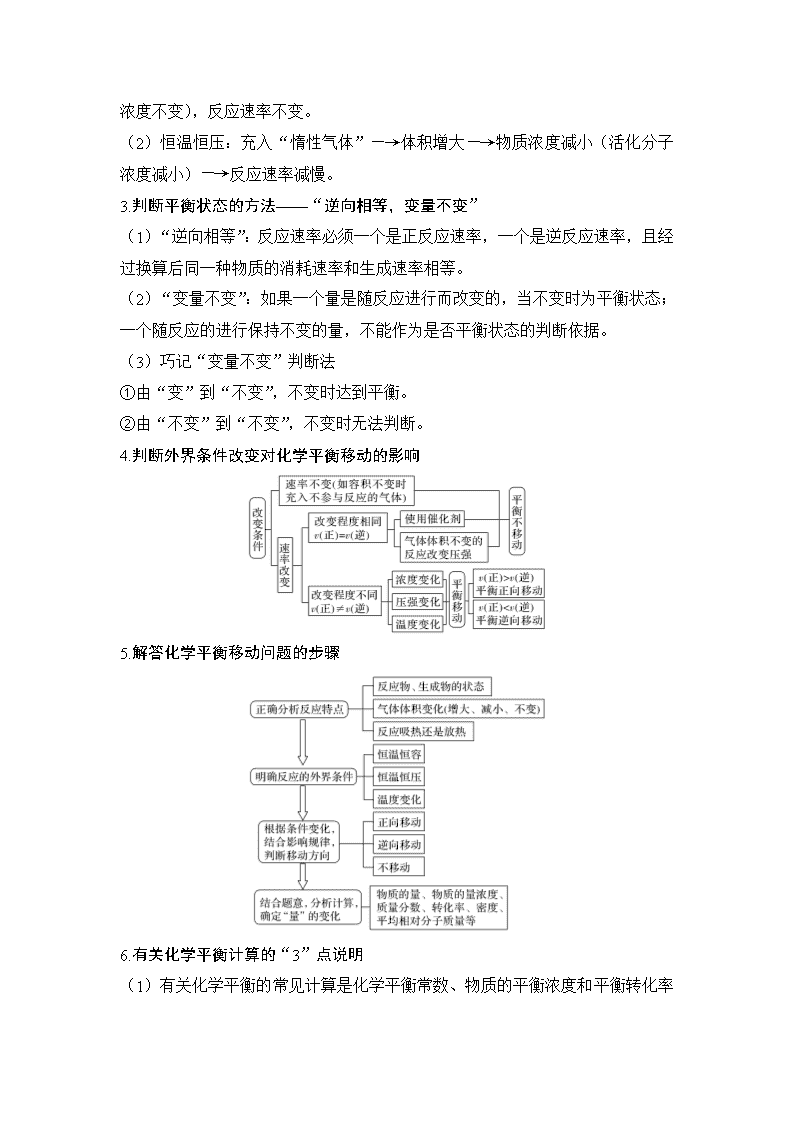
4.判断外界条件改变对化学平衡移动的影响
5.解答化学平衡移动问题的步骤
6.有关化学平衡计算的“3”点说明
(1)
有关化学平衡的常见计算是化学平衡常数、物质的平衡浓度和平衡转化率之间的相关计算。
(2)在进行有关化学平衡的“三段式”计算时,要注意各物质的起始量、平衡量和转化量三者单位的统一。
(3)凡是气体的压强变化、密度变化均必须转化为物质的量的变化或气体的体积变化才能进行相关计算。
7.理解化学平衡常数的三种关系
(1)与化学方程式书写形式的关系:
对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即:K正=。若化学方程式中的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会发生改变。两反应加和,得到的新反应,其化学平衡常数是两反应平衡常数的乘积;两反应相减,得到的新反应,其化学平衡常数是两反应平衡常数相除得到的商。
(2)与反应热的关系:
(3)与物质状态的关系:
由于固体或纯液体的浓度视为常数,所以在平衡常数表达式中不再写出。
①在稀溶液中进行的反应,如有水参加,由于水的浓度视为常数而不必出现在表达式中。
②在非水溶液中进行的反应,若有水参加或生成,则应出现在表达式中。如:
CH3COOH(l)+CH3CH2OH(l)CH3COOCH2CH3(l)+H2O(l)
K=
8.“三看”、“两法”突破化学平衡图像题
9.等效平衡判断“四步曲”
第一步,看:观察可逆反应特点(物质状态、气体分子数),判断反应是反应前后气体体积不变的可逆反应还是反应前后气体体积改变的可逆反应;
第二步,挖:挖掘反应条件,是恒温恒容还是恒温恒压,注意密闭容器不等于恒容容器;
第三步,倒:采用一边倒法,将起始物质按可逆反应化学计量数之比转化成同一边的物质;
第四步,联:联系等效平衡判断依据,结合题目条件判断是否达到等效平衡。
一、选择题
1.(2016·浙江台州中学高二下期中)下列说法中正确的是( )
A.放热反应均是自发反应
B.ΔS大于零的反应均是自发反应
C.若ΔH和ΔS均大于零,则高温时,反应能自发进行
D.物质的量增加的反应,ΔS大于零
解析 若ΔH<0、ΔS<0,则反应在低温下能自发进行,在高温下不能自发进行,故A项错误;若ΔH>0、ΔS>0,则在低温下ΔH-TΔS>0,反应不能自发进行,在高温下ΔH-TΔS<0,反应能自发进行,故B项错误,C项正确;气体物质的物质的量增加的反应,ΔS大于零,故D项错误。
答案 C
2.(2017·台州中学)已知:FeCl3(aq)+3KSCN(aq)3KCl(aq)+Fe(SCN)3(aq),其中Fe(SCN)3是弱电解质。平衡时Fe(SCN)3
的物质的量浓度与温度的关系如图所示,则下列说法正确的是( )
A.A点与B点相比,A点的c(Fe3+)大
B.加入KCl固体可以使溶液由D点变到C点
C.反应处于D点时,一定有v(正)
K2,D项错误;答案选C。
答案 C
3.(2018·浙江十校联盟)在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的恒温密闭容器中,发生如下反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol,测得n(CH4)随时间变化数据如下表,下列说法正确的是( )
时间min
温度
0
10
20
40
50
T1
0.50
0.35
0.25
0.10
0.10
T2
0.50
0.30
0.18
…
0.15
A.T1时0~10 min NO2的平均反应速率为0.015 mol/(L·min)
B.反应达到平衡时,CH4和NO2转化率相等
C.温度T2>Tl
D.反应达到平衡时,吸收或放出热量为a/2 kJ
解析 T1时0~10 min n(CH4)的变化量是0.15 mol,n(NO2)的变化量是0.3 mol,所以T1时0~10 min NO2的平均反应速率为=0.03
mol/(L·min),故A错误;反应达平衡时,CH4转化率×100%=80%、NO2转化率×100%=66.7%,故B错误;温度为T2时反应快,所以温度T2>Tl,故C正确;反应可逆,所以参加反应的CH4小于0.5 mol,反应达到平衡时,吸收或放出热量小于a/2 kJ,故D错误。
答案 C
4.(2018·浙江金华十校模拟)一定条件下,二氧化氮和四氧化二氮之间存在下列平衡:2NO2(g)N2O4(g) ΔH<0,在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( )
A.温度130 ℃,压强3.03×105 Pa
B.温度25 ℃、压强1.01×105Pa
C.温度130 ℃、压强5.05×104 Pa
D.温度0 ℃、压强5.05×104 Pa
解析 由于存在平衡2NO2(g)N2O4(g),N2O4的存在会影响二氧化氮的相对分子质量测定,故应采取措施使平衡向左移动,减小N2O4的含量,该反应正反应是体积减小的放热反应,减小压强平衡向逆反应移动,升高温度平衡向逆反应移动,故应采取高温低压,故选C。
答案 C
5.(2017·嘉兴一中)温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见表:下列说法正确的是( )
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
A.反应在前50 s的平均速率v(Cl2)=0.001 6 mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则该反应的ΔH<0
C.温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)<v(逆)
D.温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,PCl3的转化率小于80%
解析 A.由表中数据可知50 s内,Δn(PCl3)=0.16 mol,v(PCl3)==0.001 6 mol/(L·s),故A错误;B.由表中数据可知,平衡时n(PCl3)=0.2 mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2 L=0.22 mol,说明升高温度平衡正向移动,正反应为吸热反应,即ΔH>0,故B错误;
所以平衡常数K==0.025。
起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,起始时PCl5的浓度为0.5 mol/L、PCl3的浓度为0.1 mol/L、Cl2的浓度为0.1 mol/L,浓度商Qc==0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C错误;D.温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,相当于在加入0.5 mol PCl5。减小压强,平衡逆向移动,则达到平衡时,PCl3的物质的量大于0.1 mol,则转化的小于0.4 mol,PCl3的转化率小于80%,故D正确。
答案 D
6.t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
2 min末浓度/mol·L-1
0.08
a
b
平衡浓度/mol·L-1
0.05
0.05
0.1
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
解析 本题考查了化学平衡知识,意在考查考生的分析、计算能力。平衡时,X的转化率=×100%=50%,A项错误;t ℃时该反应的平衡常数K==1 600,B项错误;该反应是气体分子数减小的反应,增大平衡后的体系压强,v正增大,v逆增大,平衡向正反应方向移动,C项错误;
前2 min内,用Y的变化量表示的平均反应速率v(Y)==0.03 mol·L-1·min-1,D项正确。
答案 D
7.(2017·嘉兴教学测试)120 ℃时,1 mol CO2和3 mol H2通入1 L的密闭容器中反应生成CH3OH和水。测得CO2和CH3OH的浓度随时间的变化如图所示。下列有关说法中不正确的是( )
A.该反应的化学方程式:CO2(g)+3H2(g)CH3OH(g)+H2O(g)
B.0~3 min内,H2的平均反应速率为0.5 mol·L-1·min-1
C.容器内气体的密度不再变化时,反应到达平衡
D.10 min后,反应体系达到平衡
解析 CO2(g)和H2(g)生成CH3OH(g)和H2O(g),由图可知10 min到达平衡,为可逆反应,A项正确;v(H2)=3v(CO2)=3×=0.5 mol/(L·min),B项正确;反应物、生成物均为气体,m(气体)不变,容器体积不变,密度始终不变,C项错误;10 min后,各成分浓度保持不变,到达平衡,D项正确。
答案 C
8.(2018·浙江金华十校联盟)25 ℃时,在密闭容器中合成氨反应如下:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol,下列叙述正确的是( )
A.混合气体的质量不变时,说明该反应一定达到平衡状态
B.将容器的体积扩大到原来的2倍,v(正)减小,v(逆)增大,平衡向左移动
C.1 mol N2(g)和3 mol H2(g)的总键能大于2 mol NH3(g)的总键能
D.在密闭容器中通入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
解析 A.该反应前后气体的质量始终不变,因此混合气体的质量不变,不能说明该反应是否达到平衡状态,故A错误;B.将容器的体积扩大到原来的2倍,容器中气体的压强减小,平衡逆向移动,v(正)减小,v(逆)减小,故B错误;C.该反应为放热反应,说明1 mol N2(g)和3 mol H2(g)的总键能小于2 mol NH3(g)的总键能,故C错误;D.该反应为可逆反应,在密闭容器中通入1 mol N2和3 mol H2进行反应,不可能完全反应,反应放出的热量一定小于92.4 kJ,故D正确;故选D。
答案 D
9.(2017·绍兴诸暨中学)一定条件下合成乙烯6H2(g)+2CO2(g)CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法错误的是( )
A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM>KN
C.催化剂可能会影响CO2的平衡转化率
D.若投料比n(H2)∶n(CO2)=3∶1,则图中M点时,乙烯的体积分数为7.7%
解析 A.化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v
(M)有可能小于v(N),故A正确;B.升高温度二氧化碳的平衡转化率降低,则升温平衡逆向移动,所以M点化学平衡常数大于N点,故B正确;C.根据图像,当温度高于250 ℃,升高温度二氧化碳的平衡转化率降低,则平衡逆向移动,但催化剂只影响反应速率,不影响平衡移动和转化率,故C错误;D.设开始投料n(H2)为3 mol,则n(CO2)为1 mol,所以当在M点平衡时二氧化碳的转化率为50%。所以有
所以乙烯的体积分数为:×100%=7.7%,故D正确。
答案 C
10.(2018·浙江省十校联盟)向两个体积可变的密闭容器中均充入1 mol的A2 和2 mol的B2发生反应:A2(g)+2B2(g)2AB2(g) ΔH。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2 的体积分数随温度的变化如图所示。
已知: 图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上;Ⅳ点不在曲线上
下列叙述正确的是( )
A.Ⅰ点和Ⅱ点反应速率相等
B.Ⅳ点时反应未到达平衡v(正)p2, Ⅱ点比Ⅰ点温度高、压强大,所以反应速率Ⅱ点大于Ⅰ点,故A错误;Ⅳ
点对应的温度下,达到平衡AB2的体积分数减小,反应逆向进行,所以Ⅳ点时反应未到达平衡v(正)”、“<”或“=”)。
(4)平衡时A的转化率为 。
解析 (1)v(D)==0.1 mol·L-1·min-1=v(C),由此推知x=2。(2)v(B)===0.05 mol·L-1·min-1。(3)若升高温度,其他条件不变,平衡时D的浓度变为1.5 mol·L-1,则说明升高温度,平衡正向移动,故正反应为吸热反应。(4)设起始时A、B的浓度均为a mol·L-1,列出三段式如下:
由题意可知(a-0.75)∶(a-0.25)=3∶5,解得:a=1.5。所以,平衡时A的转化率为αA=×100%=50%。
答案 (1)2 (2)0.05 mol·L-1·min-1 (3)>
(4)50%
12.(2016·温州十校联考)温度一定时,在密闭容器中发生可逆反应:mA(g)+nB(g)pC(g),达到平衡后,若将混合气体的体积压缩到原来的,当再次达到平衡时,C的浓度是原平衡时的1.9倍,试判断:
(1)压缩体积时平衡向 (填“正反应”或“逆反应”)方向移动;
(2)反应再次达到平衡后,C气体的体积分数 (填“增大”、“减小”或“不变”);
(3)反应再次达到平衡后,A气体的转化率 (填“增大”、“减小”或“不变”);
(4)m+n p(填“>”、“<”或“=”)。
解析 将混合气体的体积压缩到原来的,则压强变为原来的2倍,若平衡不移动,则C的浓度为原平衡时的2倍,但实际上C的浓度是原平衡时的1.9倍,说明压缩体积(增大压强)平衡向逆反应方向移动,则m+n0,说明其正反应是自发进行,而逆反应为非自发进行;(2)本题考查化学反应条件的控制、化学平衡常数的计算,①A.根据图①反应Ⅰ的化学反应速率比反应Ⅱ快,说明相同条件下,反应Ⅰ的活化分子百分数大于反应Ⅱ活化分子百分数,故A说法正确;B.根据反应Ⅰ和反应Ⅱ的化学反应方程式,氯苯和硫化氢都是反应物,因为反应Ⅱ是不可逆反应,升高温度,反应Ⅱ中消耗氯苯和硫化氢,相当于减少反应Ⅰ中反应物的浓度,平衡向逆反应方向进行,苯硫酚的浓度降低,故B说法正确;C.根据图1,反应Ⅱ中氯苯的转化率随温度的升高而升高,故C说法错误;D.根据图2,在提高硫化氢与氯苯起始物质的量之比时,苯硫酚的浓度反而降低,故D说法错误;
开始时,氯苯的总物质的量为a mol= mol,硫化氢总物质的量为a mol=mol,达到平衡时,氯苯的物质的量为mol=mol,硫化氢物质的量为mol=mol,根据化学平衡常数的表达式,K==0.86;③根据图1和图2,随着反应的进行苯硫酚的浓度增加,然后降低。
答案 (1)反应Ⅱ ΔH2=-45.8 kJ/mol<0,ΔS>0,说明其正反应是自发反应,而逆反应为非自发反应,所以反应Ⅱ为不可逆反应 (2)①CD ②0.86
③如图