- 2021-07-02 发布 |
- 37.5 KB |
- 3页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第四章电化学基础1原电池真题导思含解析 人教版选修4
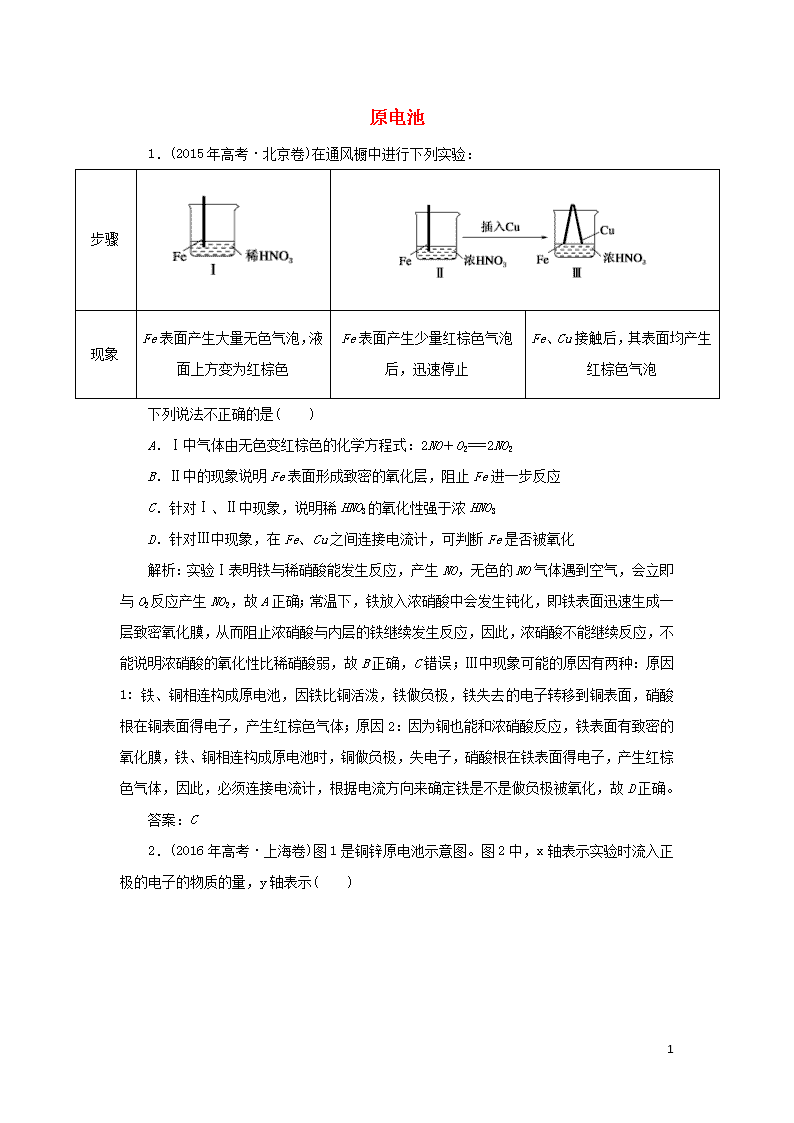
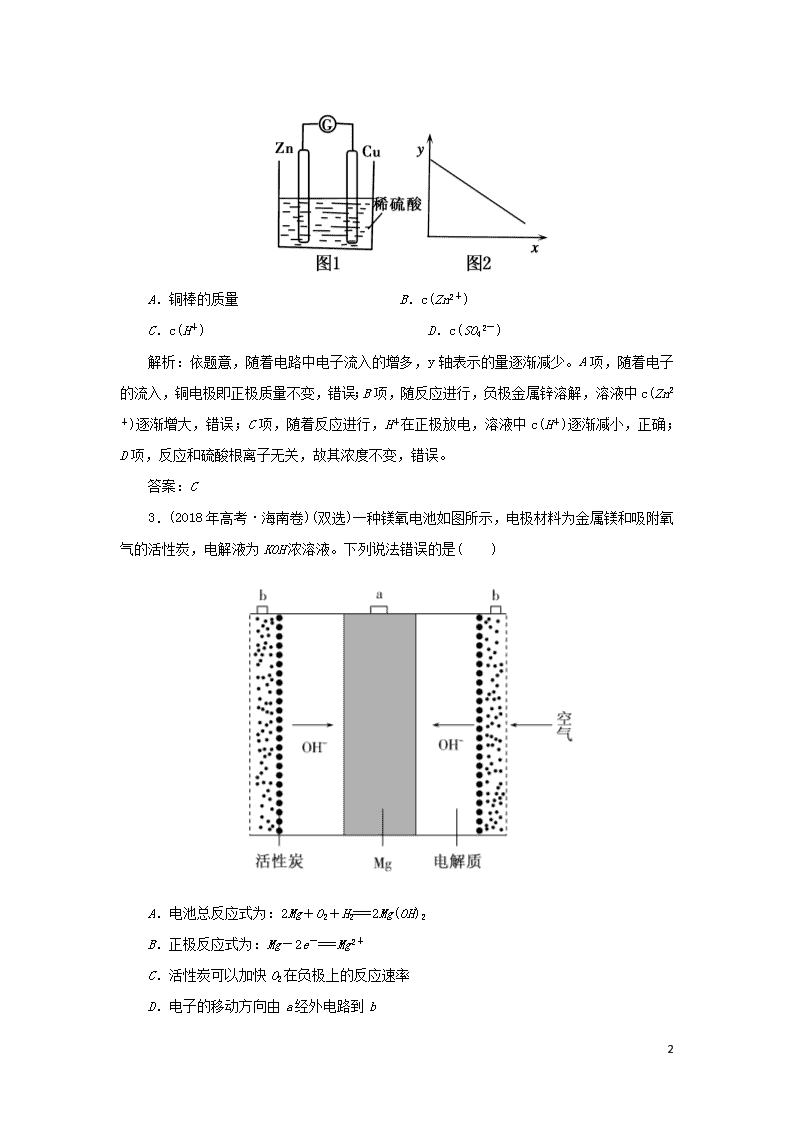
原电池 1.(2015年高考·北京卷)在通风橱中进行下列实验: 步骤 现象 Fe表面产生大量无色气泡,液面上方变为红棕色 Fe表面产生少量红棕色气泡后,迅速停止 Fe、Cu接触后,其表面均产生红棕色气泡 下列说法不正确的是( ) A.Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2===2NO2 B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 C.针对Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 解析:实验Ⅰ表明铁与稀硝酸能发生反应,产生NO,无色的NO气体遇到空气,会立即与O2反应产生NO2,故A正确;常温下,铁放入浓硝酸中会发生钝化,即铁表面迅速生成一层致密氧化膜,从而阻止浓硝酸与内层的铁继续发生反应,因此,浓硝酸不能继续反应,不能说明浓硝酸的氧化性比稀硝酸弱,故B正确,C错误;Ⅲ中现象可能的原因有两种:原因1: 铁、铜相连构成原电池,因铁比铜活泼,铁做负极,铁失去的电子转移到铜表面,硝酸根在铜表面得电子,产生红棕色气体;原因2:因为铜也能和浓硝酸反应,铁表面有致密的氧化膜,铁、铜相连构成原电池时,铜做负极,失电子,硝酸根在铁表面得电子,产生红棕色气体,因此,必须连接电流计,根据电流方向来确定铁是不是做负极被氧化,故D正确。 答案:C 2.(2016年高考·上海卷)图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) 3 A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42-) 解析:依题意,随着电路中电子流入的增多,y轴表示的量逐渐减少。A项,随着电子的流入,铜电极即正极质量不变,错误;B项,随反应进行,负极金属锌溶解,溶液中c(Zn2+)逐渐增大,错误;C项,随着反应进行,H+在正极放电,溶液中c(H+)逐渐减小,正确;D项,反应和硫酸根离子无关,故其浓度不变,错误。 答案:C 3.(2018年高考·海南卷)(双选)一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液。下列说法错误的是( ) A.电池总反应式为:2Mg+O2+H2===2Mg(OH)2 B.正极反应式为:Mg-2e-===Mg2+ C.活性炭可以加快O2在负极上的反应速率 D.电子的移动方向由a经外电路到b 3 解析:B镁应该为负极材料,而不是正极;而活性炭为正极,所以B、C错误。 答案:BC 3查看更多