- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省荆州市公安县2019-2020学年高一上学期期末考试化学试题
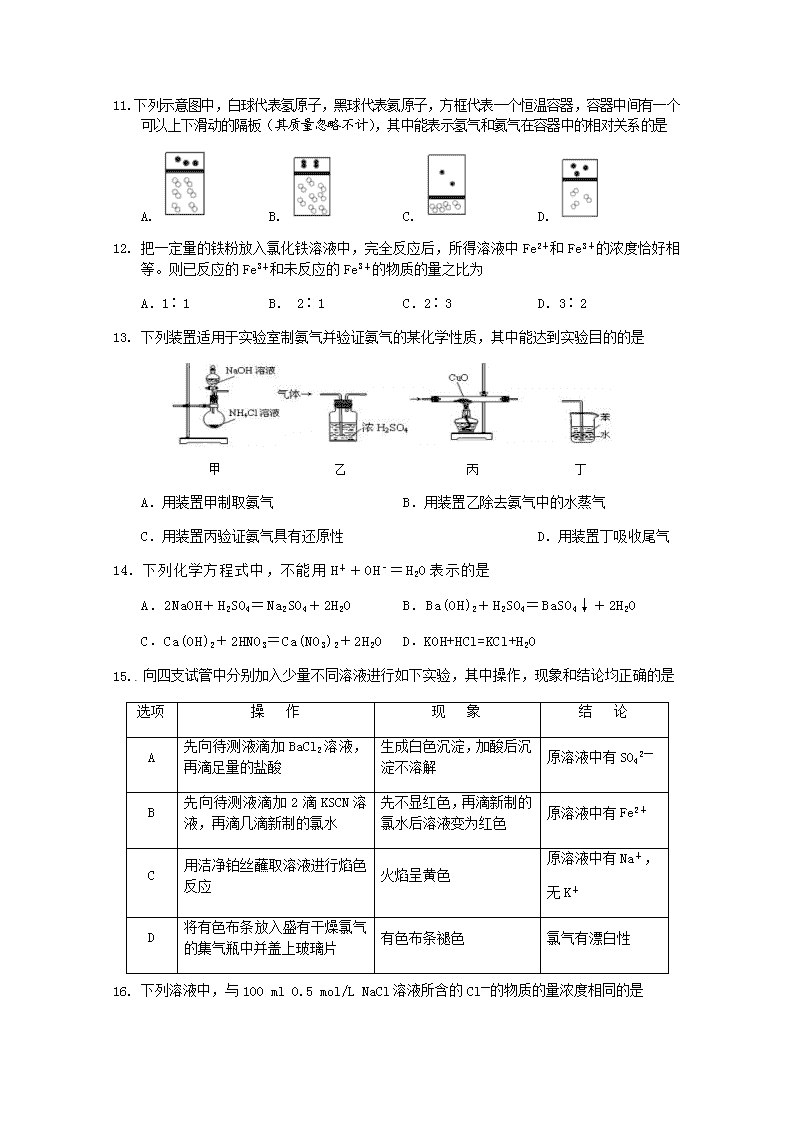
www.ks5u.com 2019—2020学年度上学期期末考试 高 一 化 学 试 题 命题人:朱敬华 审题人:齐 丽 本试卷共6页,25题,全卷满分100分,考试用时90分钟。 ★祝考试顺利★ 注意事项: 1.本试卷分为试题卷和答题卡,答题前请先将自己的姓名、学校、班级填写在答题卡上对应的位置。 2. 选择题的答案请用2B铅笔以正确的填涂方式填写在答题卡上对应的位置,非选择题请将答案填写在相应的答题栏内,写在试题卷上的答案无效。 3. 考试结束后,将答题卡收回。 相关相对原子质量:H-1 Si-28 Cu-64 Mg-24 P-31 Al-27 S-32 Cl-35.5 Fe-56 N-14 第I卷(选择题,共47分) 一、选择题(本题共有16个小题,每小题只有一个选项符合题意,每小题2分,共32分) 1.我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。下列物品中用到硅单质的是 A.陶瓷餐具 B.计算机芯片 C.石英钟表 D.光导纤维 2. 胶体区别于溶液等其它分散系的本质特征是 A.胶粒可以导电 B.胶体是混合物 C.胶体粒子大小在1~100nm之间 D.胶体的分散剂为气体 3.下列关于钠、铝、铁、铜和氧气的反应,不正确的是 A. 铁在氧气中燃烧,产物为四氧化三铁 B. 铝表面很容易被氧气氧化,生成致密的氧化物保护膜 C. 钠常温下和氧气反应,生成淡黄色的过氧化钠 D. 铜可以在加热的条件下和氧气反应,生成氧化铜 4.用NA表示阿伏加德罗常数,下列叙述正确的是 A.标准状况下,22.4LH2O含有的分子数为NA B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA[来源:Zxxk.Com] C.通常状况下,NA 个CO2分子占有的体积为22.4L D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA 5.对于下列事实的解释正确的是 A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性 B.浓硝酸在光照下颜色变黄,说明浓硝酸具有挥发性 C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 D.氨气可以完成喷泉实验,说明氨气极易溶于水 6.下列叙述正确的是 ①根据组成物质的元素种类是否相同将物质分为纯净物和混合物 ②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 ③根据是否有丁达尔现象将分散系分为溶液、胶体和浊液 ④根据水溶液是否能导电将化合物分为电解质和非电解质 ⑤树状分类法是唯一能表示物质分类的方法 A.②③ B.②④⑤ C.② D.①③④ 7.从氧化还原角度分析,下列反应中水的作用相同的是 ①铁和水蒸气反应 ②过氧化钠和水反应 ③氯气和水反应 ④二氧化氮和水反应 A.①②③ B.①②④ C.②③④ D.①③④ 8. 下列各组离子在水溶液中一定能大量共存的是 A. 含有大量 Ba2+的溶液中:Cl-、K+、SO42-、CO32- B. 含有大量H+的溶液中:Mg2+、Na+、SO42-、HCO3- C. 含有大量OH-的溶液中:Mg2+、NO3-、SO42-、CO32- D. 含有大量Na+的溶液中:H+、K+、NO3-、SO42- 9. 下列化学反应的离子方程式正确的是 A.盐酸和石灰石制CO2:CO32- + 2H+ = H2O + CO2↑ B.氢氧化铜与稀盐酸反应:Cu(OH)2 + 2H+ = Cu2+ + 2H2O C.铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag D.往澄清石灰水中通入少量的二氧化碳气体:CO2 + Ca(OH)2 = CaCO3↓ + H2O 10.下列两种气体的分子数一定相等的是 A.质量相等、密度不等的N2和C2H4 B.等压等体积的N2和CO2 C.等温等体积的O2和N2 D.不同体积等密度的CO和C2H4 11. 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表一个恒温容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计),其中能表示氢气和氦气在容器中的相对关系的是 A. B. C. D. 12. 把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为 A.1∶1 B. 2∶1 C.2∶3 D.3∶2 13. 下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是 甲 乙 丙 丁 A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气 C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气 14. 下列化学方程式中,不能用H++OH﹣=H2O表示的是 A.2NaOH+H2SO4=Na2SO4+2H2O B.Ba(OH)2+H2SO4=BaSO4↓+2H2O C.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O D.KOH+HCl=KCl+H2O 15. 向四支试管中分别加入少量不同溶液进行如下实验,其中操作,现象和结论均正确的是 选项 操 作 现 象 结 论 A 先向待测液滴加BaCl2溶液,再滴足量的盐酸 生成白色沉淀,加酸后沉淀不溶解 原溶液中有SO42— B 先向待测液滴加2滴KSCN溶液,再滴几滴新制的氯水 先不显红色,再滴新制的氯水后溶液变为红色 原溶液中有Fe2+ C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+, 无K+ D 将有色布条放入盛有干燥氯气的集气瓶中并盖上玻璃片 有色布条褪色 氯气有漂白性 16. 下列溶液中,与100 ml 0.5 mol/L NaCl溶液所含的Cl—的物质的量浓度相同的是 A. 100ml 0.5 mol/L MgCl2溶液 B. 200ml 0.25 mol/L HCl溶液 C. 50ml 1mol/L NaCl溶液 D. 200ml 0.25 mol/L CaCl2溶液 二、不定项选择题(本题有5小题,每小题3分,共15分,每小题有1-2个正确答案,只选一个正确答案得2分,错选或多选不得分) 17.每年10月23日上午6∶02到晚上6∶02被誉为“摩尔日”(Mole Day),这个时间的美式写法为6∶0210/23,外观与阿伏加德罗常数6.02×1023相似,下列说法中不正确的是 A.常温常压下,22.4L Cl2含有的分子数目为NA B.NA个一氧化碳分子和0.5mol甲烷的质量比为7:3 C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA D.1mol Na与O2完全反应生成Na2O和Na2O2,转移的电子数为NA个 18.某工厂,在山坡坑道的仓库里贮有氯气钢瓶。一天一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取的措施正确的是 A.把钢瓶推到坡下的小河里 B.把钢瓶扔到农田中 C.把钢瓶丢到深坑里,用石灰填埋 D.钢瓶处理后,工人应转移到坡上 19. 除去下列物质中的杂质,所用试剂和方法正确的是 选项 物质 杂质 除杂质所用试剂和方法 A Na2CO3固体 NaHCO3 加热 B[来源:学科网] KNO3 K2SO4 BaCl2溶液,过滤 C Cu CuO 稀硫酸,过滤 D CaCO3 CaO 盐酸,过滤 20. 用右图中装置进行实验,实验一段时间后,现象与预测不一致的是 选项 ①中物质 ②中物质 实验预测 A 浓氨水 酚酞试液 ②中溶液变为红色 B 浓硝酸 淀粉KI溶液 ②中溶液变为蓝色 C 浓盐酸 浓氨水 大烧杯中有白烟 D 饱和的亚硫酸溶液 稀溴水[来源:学.科.网] ②中无明显变化 21. 工业上冶炼锡的第一步反应原理为 2SnO2+3C2Sn+a M↑+CO2↑,则下列说法中错误的是 A.a 的值为 2 B.反应中 SnO2 被还原 C.每生成 1 mol M 转移电子 8 mol D.反应后只有一种氧化产物 第Ⅱ卷(非选择题,满分53分) 注意事项: 1.请用蓝黑钢笔或圆珠笔在第Ⅱ卷答题卡上作答,不能答在此试卷上。 2.试卷中横线及框内注有“▲”的地方,是需要你在第Ⅱ卷答题卡上作答。 三、填空题(共53分) 22.(15分)化学与人类生活密切相关。请按要求,回答下列问题: (1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式 ▲ ,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)= ▲ ,气体V= ▲ 。 (2) “84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为 ▲ ,若有2mol氯气参与该反应,则此时转移的电子数为 ▲ NA。 (3) 小苏打可用于治疗胃酸过多,其反应的离子方程式为 ▲ 。 (4) 长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为 ▲ 。 (5) 葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为 ▲ g(请保留两位小数)。 9 白球比 1.6 10 乳酸脱氢酶 161 U/L 11 磷酸肌酸激酶 56 U/L 12 甘油三酯 0.52 mmol/L 13 总胆固醇 4.27 mmol/L 14 高密度脂蛋白胆固醇 1.57 mmol/L 15 低密度脂蛋白胆固醇 1.40 mmol/L 16 葡萄糖 4.94 mmol/L 23.(12分)氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。 Ⅰ.(1)NaClO中Cl的化合价为 ▲ ,有较强的 ▲ (填氧化、还原)性。 (2)黄色气体ClO2可用于污水杀菌和饮用水净化。 ①KClO3与SO2在强酸性溶液中反应可制得ClO2 ,SO2被氧化为SO42-,此反应的离子方程式为 ▲ 。 ②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 ▲ 。 Ⅱ.某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题: (1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式 ▲ ; (2)C装置的作用是 ▲ 。 (3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 ▲ 。 ②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进 ▲ 。 24.(12分)铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官。铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。 (1)【铁元素的分离】 称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。在坩埚中高温灼烧黑木耳,使之完全灰化。用酸充分浸泡溶解,过滤,滤液备用。 ① 浸泡液检测不出铁元素的原因是 ▲ 。 ② 滤液中铁元素的存在形式是Fe2+、 ▲ 。 (2)【配制溶液】 将滤液配制成100 mL 溶液。实验时需要选择合适的仪器完成【铁元素的分离】、【配制溶液】2个实验,下列仪器不必使用的是 ▲ 。 (3)【铁元素含量测定】 研学小组提出如下测量方案: Ⅰ. 沉淀法:向溶液中加入足量NaOH溶液,搅拌使Fe(OH)2全部转化为Fe(OH)3然后过滤、洗涤沉淀、加热烘干、称量Fe(OH)3的质量进行分析。 请指出该测量方案是否可行及其理由 ▲ 。 Ⅱ. 比色法:流程示意如下: ① 用离子方程式解释加入H2O2的目的是 ▲ 。 ② 溶液a的颜色是 ▲ 。 ③ 溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量 ▲ (填“偏大”或“偏小”)。[来源:学科网] (4)亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。 可见,氧化还原反应能否发生与 ▲ 有关。 25.(14分)氮元素的单质和常见的化合物在工、农业生产中用途广泛。 (1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:[来源:学§科§网Z§X§X§K] N2 O2 Ar CO2 -196℃ -183℃ -186℃ -78℃ 现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是 ▲ 。 (2)雷雨时空气中的N2转化为NO,生成物NO是 ▲ 色的气体, ▲ (填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为 ▲ 。 (3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。 ①制取氨气的化学方程式为 ▲ ; ②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为 ▲ g。 (4)已知:4NH3+6NO = 5N2+6H2O 化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。 若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。 ①NH3与稀硫酸溶液反应的离子方程式为 ▲ ; ②为了比较不同催化剂的催化性能,需要测量并记录的数据是 ▲ 。四县市2019级第一学期教学水平监测 化学试题参考答案及评分意见 一、 选择题(每小题只有一个选项,请将正确的选项涂答题卡内。1-17题,每小题2分,[来源:学科网] 1 2 3 4 5 6 7 8 9[来源:学#科#网] 10 B C C B D C C D B A 11 12 13 14 15 16 17[来源:Z。xx。k.Com] 18 19 20 A C C B B D AB CD AC D 21 [来源:学§科§网] CD 二、填空 22.(共15分)(1)Na2CO3 + H2O + CO2 = 2NaHCO3 ; 0.2mol ; 6.72 (2) Cl2+2OH=Cl—+ ClO—+H2O;2 (3) HCO3—+H+=CO2↑+H2O (4) K2O·Al2O3·6SiO2 [来源:学_科_网Z_X_X_K] (5) 0.89g 23.(共12分) Ⅰ.(1)+1,氧化 (2)①2ClO3-+SO2=2ClO2+SO42- ②2:5 Ⅱ.(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O (2)吸收未反应的Cl2,防止污染空气 (3)①将B装置冷却(或将B装置放入冷水液中),②A、B之间接一个盛饱和NaCl溶液的洗气瓶。 24.(共12分)(1)① 黑木耳中含铁元素的物质不溶于水 ② Fe3+ (其他答案合理给分) (2) b、f (3)Ⅰ.不可行, Fe(OH)3受热易分解,且沉淀法操作步骤多误差大 Ⅱ.① H2O2 + 2H+ +2Fe2+ =2Fe3+ +2H2O ②红色 ③偏小 (4)水(环境或介质等,合理即可) 25. (共14分) (1)N2; (2)无;难;3NO2+H2O=2HNO3+NO; (3)①2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑;②10.7g (4) ①NH3+H+=NH4+ ② 溶液显色所需时间.查看更多