- 2021-07-02 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省师范大学附属中学2019-2020学年高二上学期期中考试化学(选考)试题 (1)
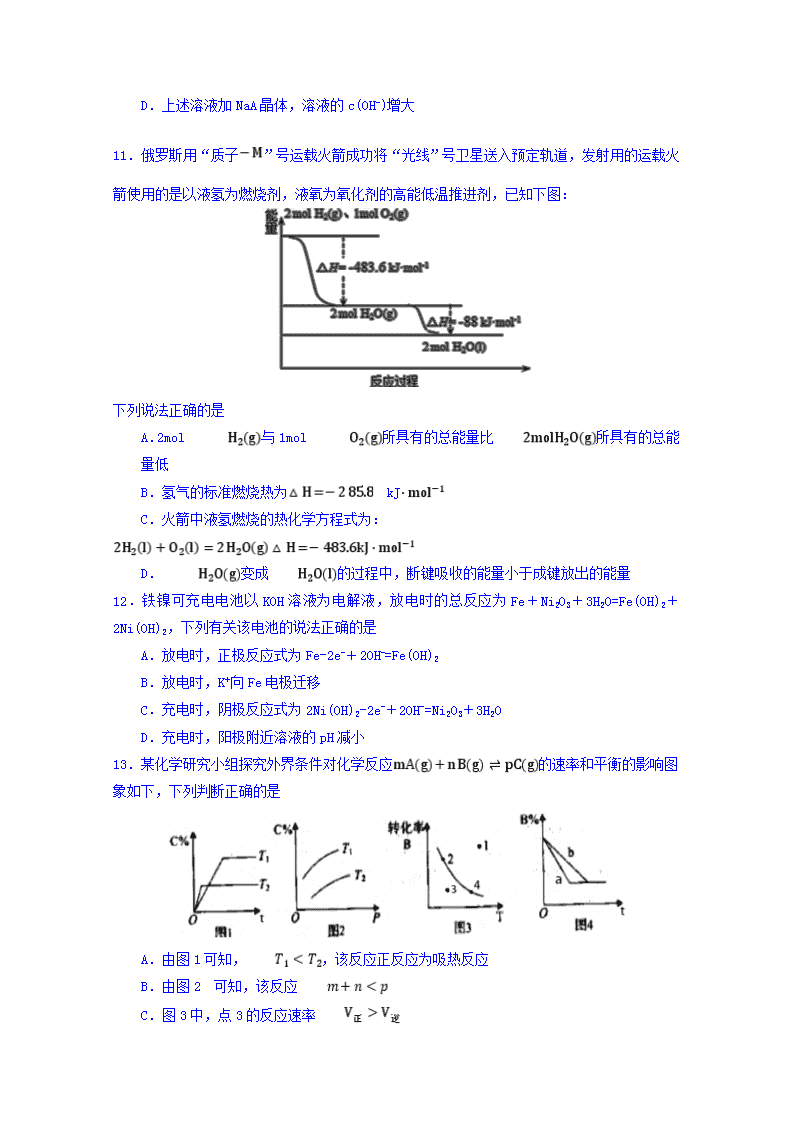
福建师大附中2019-2020学年上学期期中考试 高二(选考班)化学试卷 试卷说明: (1)本卷两大部分,共20小题,解答写在答卷的指定位置上,考试结束后,只交答卷。 (2)考试过程中不得使用计算器或具有计算功能的电子设备。 第Ⅰ卷(选择题,共48分) 一、 选择题:(只有一个正确选项,16小题,每小题3分,共48分) 1.下列能源中,大量使用会导致全球进一步变暖、雾霾天气增多的是 A.化石能源 B.太阳能 C.氢能 D.地热能 2.下列物质中,属于弱电解质的是 A.SO2 B.HClO C.Cl2 D.CaCO3 3.在一定条件下,对于反应来说,以下化学反应速率的表示中,化学反应速率最快的是 A. B. C. D. 4.室温下,可逆反应:C(s)+CO2(g) 2CO(g)的平衡常数K=1.25,若在室温及恒容的条件下,CO2和CO的浓度均为0.5mol/L,则此反应将会 A.向逆反应方向进行 B.向正反应方向进行 C.处于平衡状态 D.无法判断 5.用铁片与稀硫酸反应制取氢气时,下列措施会加快氢气产生速率的是 A.加少量醋酸钠固体 B.不用稀硫酸,改用98%浓硫酸 C.滴加少量CuSO4溶液 D.加少量硫酸钠固体 6.下列事实能用勒夏特列原理解释的是 A.工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量 B.合成氨工业中使用铁触媒做催化剂 C.用饱和食盐水除去氯气中氯化氢杂质 D.容器中有,增大压强颜色变深 7.关于下列装置的说法,正确的是 A.装置①中盐桥内的K+移向CuSO4溶液 B.装置①将电能转变为化学能 C.若装置②用于铁棒镀铜,则N极为铁棒 D.若装置②用于电解精炼铜,精炼过程溶液中的Cu2+浓度保持不变 8.一密闭容器中,反应aA bB 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 A.平衡向逆反应方向移动了 B.物质A的转化率减少了 C.物质A的质量分数增加了 D. 9.一定条件下,在密闭容器里进行如下可逆反应:橙黄色液体气 鲜红色液体下列说法正确的是 A.增大压强,平衡常数将增大 B.达到平衡时,单位时间里消耗n mol 的同时也生成n C.达到平衡时,若升高温度,氯气的百分含量减小 D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 10.常温下,0.1mol·L-1某一元酸(HA)溶液中=1×10-8,下列叙述正确的是 A.溶液中水电离出的c(H+)=10-10mol·L-1 B.溶液中c(H+)+c(A-)=0.2mol·L-1 C.常温下将HA稀释十倍,氢离子浓度变为原来的十分之一 D.上述溶液加NaA晶体,溶液的c(OH-)增大 11.俄罗斯用“质子”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火 箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知下图: 下列说法正确的是 A.2mol 与1mol 所具有的总能量比所具有的总能量低 B.氢气的标准燃烧热为 kJ C.火箭中液氢燃烧的热化学方程式为: D. 变成的过程中,断键吸收的能量小于成键放出的能量 12.铁镍可充电电池以KOH溶液为电解液,放电时的总反应为Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法正确的是 A.放电时,正极反应式为Fe-2e-+2OH-=Fe(OH)2 B.放电时,K+向Fe电极迁移 C.充电时,阴极反应式为2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O D.充电时,阳极附近溶液的pH减小 13.某化学研究小组探究外界条件对化学反应的速率和平衡的影响图象如下,下列判断正确的是 A.由图1可知,,该反应正反应为吸热反应 B.由图2 可知,该反应 C.图3中,点3的反应速率 D.图4中,若,则a曲线一定使用了催化剂 14.在一定温度下,向2L体积固定的密闭容器中加入1mol HI,发生反应:,测得的物质的量随时间变化如表,下列说法正确的是 1 2 3 A.2 min内的HI的分解速度为 B.该温度下,平衡时HI的转化率为1 C.该温度下的平衡常数为,温度升高后平衡常数为,则 D.达平衡后其他条件不变,压缩容器体积,平衡不移动,不变 15.氮气是制备含氮化合物的一种重要物质。两个常见的固氮反应:,其平衡常数对数值 与温度的关系如图。根据图中的数据判断下列说法正确的是 A.反应和均为放热反应 B.升高温度,反应的反应速率减小 C.在1 时,反应和反应体系中的浓度一定相等 D.在常温下,利用反应固氮和利用反应固氮,反应程度相差很大 16.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是 A.b为直流电源的负极 B.阴极反应式为 C.工作时,乙池中溶液的pH减小 D.若有1 mol离子通过A膜,理论上阳极生成5.6mL气体 第Ⅱ卷(非选择题,共52分) 二、填空题(4小题,共52分) 17.(12 分)一定温度下,在固定容积为 5L 的密闭容器中发生可逆反应:C(s)+H2O(g)CO(g)+H2(g)。 (1)请写出该反应的化学平衡常数表达式 K= 。 (2)不能判断该反应一定达到化学平衡状态的依据是 (填字母) A.υ正(H2O)=υ逆(H2) B.消耗 n mol H2 的同时消耗 n mol CO C.容器中混合气体的密度不随时间而变化 D.混合气体的压强不再变化 (3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),△H<0,t1 秒时,H2 的物质的量为 0.2 mol,到 t2 秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。 ①t1∽t2这段时间内的反应速率υ(H2O)= ;达到平衡时,H2的体积分数为 。 ②若继续加入 2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1molH2O再次达到平衡后,H2的物质的量为 。 ③该反应的逆反应速率随时间变化的关系如右图: t1时改变了某种条件,改变的条件可能是 。 18.(8分)电解质溶液中存在多种平衡。请回答下列问题: (1)已知: 化学式 CH3COOH HClO 电离常数(25℃) 1.8×10-5 3.0×10-8 物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者 C(H+)的大小:a b(填“>”、“<”或“=”)。 (2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 (填字母)。 A. B. C. (3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= —lgC(H+),则: ①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”) ②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”) 19.(16分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验: 【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O 【实验内容及记录】 实验编号 室温下,试管中所加试剂及其用量 / mL 室温下溶液颜色褪至无色所需时间 / min 0.6 mol/L H2C2O4溶液 H2O 3 mol/L 稀硫酸 0.05mol/L KMnO4溶液 1 3.0 2.0 2.0 3.0 1.5 2 2.0 3.0 2.0 V1 2.7 3 1.0 V2 2.0 3.0 3.9 请回答:(1)表中V1= ,V2= 。 (2)根据上表中的实验数据,可以得到的结论是 。 (3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为: υ(KMnO4)= 。 (4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。(忽略反应过程中温度变化) ① 该小组同学提出的假设是 。 ② 请你帮助该小组同学完成实验方案。 实验编号 室温下,试管中所加试剂及其用量 / mL 再向试管中加入少量固体 室温下溶液颜色褪至无色所需时间 / min 0.6 mol/L H2C2O4溶液 H2O 3 mol/L 稀硫酸 0.05 mol/L KMnO4溶液 4 3.0 2.0 2.0 3.0 A t 表中加入的固体A是 。(写化学式) ③若该小组同学提出的假设成立,应观察到的现象是 (5)工业上可用电解K2MnO4溶液的方法制取KMnO4,则电解时,阳极发生的电极反应式为 。 20.(16分)合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)2CO(g) ∆H,测得压强、温度对CO、CO2的平衡组成的影响如右图所示,回答下列问题: (1)p1、p2、p3的大小关系是________,图中a、b、c三点对应的平衡常数大小关系是______________________。 (2)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:反应1:CO(g)+3H2(g)CH4(g)+H2O(g) ∆H1= a kJ/mol 反应2:CO(g)+H2O(g)CO2(g)+H2(g) ∆H2= b kJ/mol ① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是_________ 。 ② 已知298 K时相关化学键键能数据为: 化学键 H—H O—H C—H E/(kJ·mol-1) 436 465 413 1076 则根据键能计算,∆H1=________________。反应1自发进行的条件是___________。(填“较高温度”、“较低温度”、“任意温度”) (3)一定条件下,CO2(g) +3H2(g)CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K =_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”) (4)如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。 ① 甲中负极的电极反应式为______ ,丙中C极的电极反应式为 。 ② 乙中A极析出的气体在标准状况下的体积为______ 。 福建师大附中2019-2020学年上学期期中考试 高二(选考班)化学答案 一、选择题:(只有一个正确选项,16小题,每小题3分,共48分) 1-5:ABABC 6-10:CADBD 11-16:BDCADC 二、填空题(4小题,共52分) 17.(12分) (1)K=C(CO)·C(H2)/C(H2O)(1分); (2)B (2分) (3)①0.03/(t2-t1)mol/(L·s)(2分);35% (2分) ②不(1分);0.7 (2分) ③增大 H2O(g)的浓度(2分) 18.(8分) (1)> (2分) (2)B(2分) (3)①<(2分)② <(2分) 19.(16分) (1)3.0(2分),4.0(2分) (2)其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大(2分) (3)1.0×10-2 mol / (L·min) (2分) (4) ①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)(2分) ② MnSO4 (2分) ③ 与实验1比较,溶液褪色所需时间短 或:所用时间(t)小于1.5min(2分) (5)MnO42--e-=MnO4- (2分); 20. (16分) (1) p1查看更多
相关文章
- 当前文档收益归属上传用户