- 2021-07-02 发布 |
- 37.5 KB |
- 6页

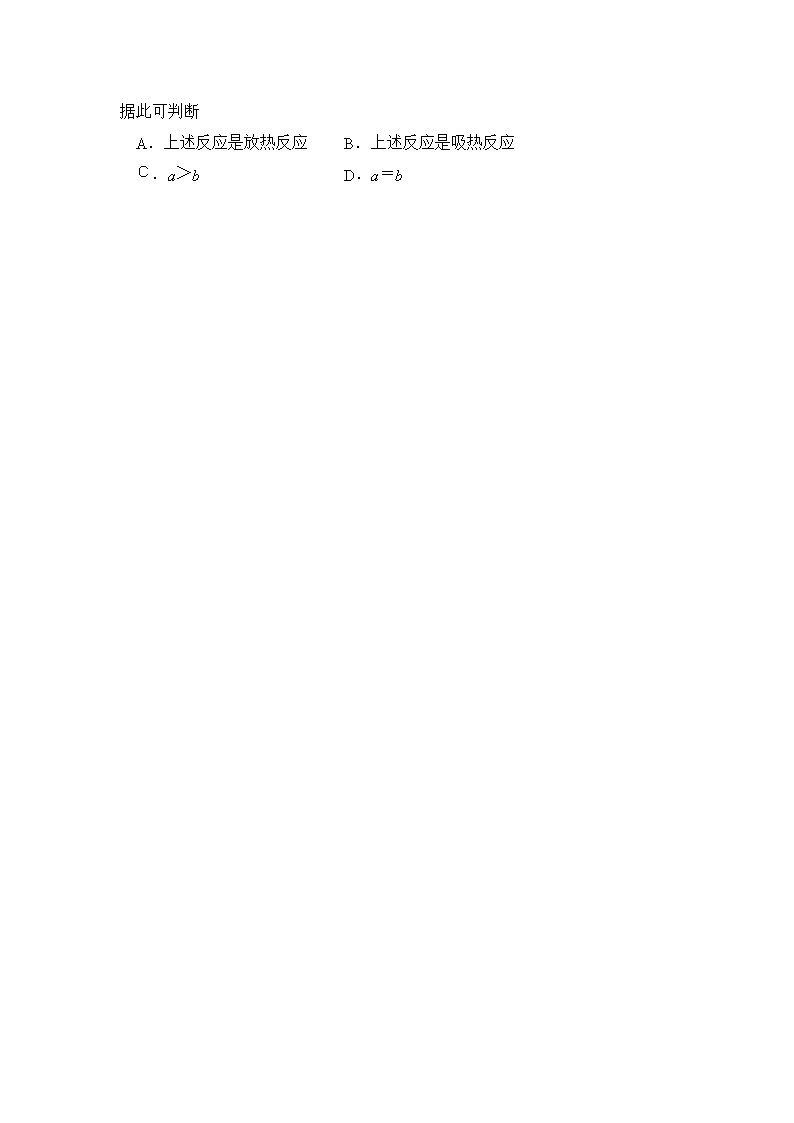
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学理卷·2018届福建省漳浦县第三中学高二上学期第二次调研考试(2016
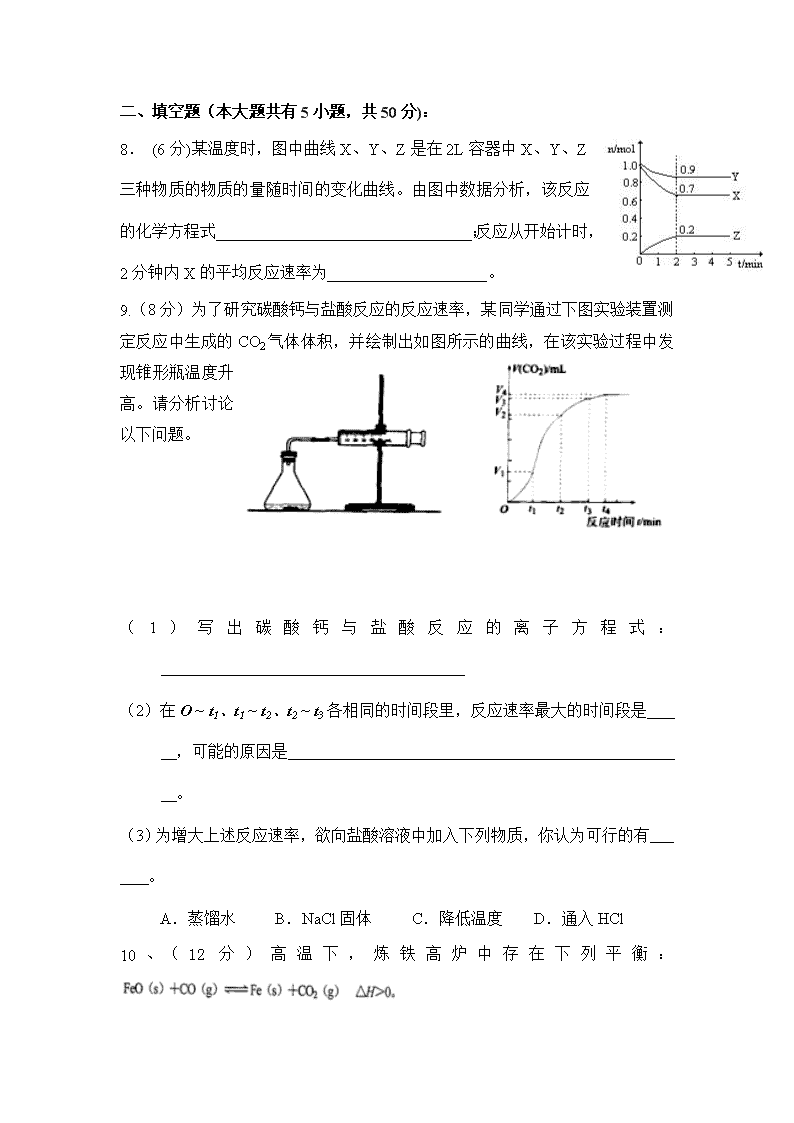
漳浦三中2016-2017学年第一学期第二次调研考 高二化学(理科)试卷 一、 选择题(本大题有7小题,每小题6分,共42分) 1.在2A+B 3C+4D反应中,表示该反应速率最快的是 A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s) C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s) 2、某化学反应的△H= 122 kJ·mol-1,∆S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( ) A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行 C.仅在高温下自发进行 D.仅在低温下自发进行 3、对于100mL1mol/L盐酸与铁片的反应,采取下列措施:①升高温度;②改用98%的硫酸; ③改用300mL1mol/L盐酸;④用等量铁粉代替铁片。其中能使反应速率加快的是 A.①③④ B.①④ C.①② D.①②③ 4.不能用化学平衡移动原理说明的事实是: A. 合成氨在高压下进行是有利的 B. 使用催化剂能使合成氨速率加快 C. 温度过高对合成氨不利 D. 及时分离从合成塔中出来的混合气体,有利于合成氨 5.已知反应A2(g)+2B2(g)2AB2(g)△H <0,下列说法正确的 A.升高温度,正向反应速率增加,逆向反应速率减小 B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 6. 在2升的密闭容器中,发生以下反应:2A(g)+ B(g) 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是 A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol y x p1 p2 7.反应:L(s)+aG(g)bR(g) 达到平衡时, 温度和压强对该反应的影响如图所示:图中压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。 据此可判断 A.上述反应是放热反应 B.上述反应是吸热反应 C.a>b D.a=b 二、填空题(本大题共有5小题,共50分): 8. (6分)某温度时,图中曲线X、Y、Z是在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线。由图中数据分析,该反应的化学方程式________________________________;反应从开始计时,2分钟内X的平均反应速率为____________________。 9.(8分)为了研究碳酸钙与盐酸反应的反应速率,某同学通过下图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线,在该实验过程中发现锥形瓶温度升高。请分析讨论以下问题。 (1)写出碳酸钙与盐酸反应的离子方程式:______________________________________ (2)在O ~ t1、t1 ~ t2、t2 ~ t3各相同的时间段里,反应速率最大的时间段是 ,可能的原因是 。 (3)为增大上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有 。 A.蒸馏水 B.NaCl固体 C.降低温度 D.通入HCl 10、(12分)高温下,炼铁高炉中存在下列平衡: 试回答下列问题: (1)写出该反应的平衡常数表达式 。 (2)升高温度,该反应的平衡常数K值将 (填“增大”、“减小”、“不变”),平衡体系中固体的质量将 填“增大”、“减小”、“不变”)。 (3)已知1100℃时该反应的平衡常数K=0.263。在该温度测得高炉中c(CO2)=0.035mol·L-1, c(CO)=0.1mol·L-1,此时该的化学反应速度是v(正) (填“>”、“<”、“=”)v(逆),原因是 。 (4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值 (填”>”、“<”、“=”)0.263。 11、(13分)可逆反应2SO2+O2 2SO3 △H<0是工业制硫酸的重要反应之一。回答下列问题: (1)生产过程中,该反应在恒容的密闭容器中达到平衡的标志是( ) ①容器内SO2、O2、SO3浓度不再改变 ②容器中SO2、O2、SO3浓度比恰为2∶1∶2 ③容器内密度不再发生变化 (2)下图是条件发生改变,引起速率和平衡变化的情况 (v-t图) V v(正) v(正) v(逆) v(逆) v(逆) v(正) 0 t1 t2 t3 t4 t5 t6 t7 t8 t ①请指t2—t6哪些时间段该反应处于平衡状态 ; ②分析t2改变的反应条件是 ③在t7处画出降温时V的变化的图像。 (3)达到平衡状态时,混合气体中SO2、O2、SO3的浓度分别为0.20.1mol·L-1、0.20.1mol·L-1、0.20.1mol·L-1则平衡常数K的数值为 ; 若升高温度,SO2的转化率将 ____________(填“增大”、“减小”或“不变”)。 12.(每空2分共10分)某化学反应 3 A 2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表: 实验 序号 0 10 20 30 40 50 1 500 2.0 1.6 1.3 1.0 0.8 0.8 2 500 C2 1.2 0.8 0.8 0.8 0.8 3 500 C3 1.7 1.3 1.0 1.0 1.0 4 600 2.0 1.1 0.9 0.9 0.9 0.9 根据上述数据,完成下列填空: (1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L·min) (2)在实验 2 ,A 的初始浓度 C2 _______ mol / L (3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3 ____v1 (填 <、>或=),且C3 ______ 2.0 mol / L (填 <、>或=) (4)比较实验 4 和实验 1,可推测正反应是______反应(填吸热或放热) 三、实验题(本大题包括1小题,共9分) 13.(9分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应: CH3COOH+C2H5OHCH3COOC2H5+H2O。 请根据要求回答下列问题: (1)欲提高乙酸的转化率,可采取的措施有 、 等。 (2)若用右图所示装置来制备少量乙酸乙酯,产率往往偏低,其可能原因为 (只需填一种) (3)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。 同一反应时间 同一反应温度 反应温度/℃ 转化率(%) 选择性(%)* 反应时间/h 转化率(%) 选择性(%)* 40 77.8 100 2 80.2 100 60 92.3 100 3 87.8 100 80 92.6 100 4 92.3 100 根据表中数据,下列反应条件最合适的是 (填字母)。 A.60 ℃,2 h B.60 ℃,4 h C. 80 ℃,2 h D.40 ℃,3 h查看更多