- 2021-07-02 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
铁、铜的获取及应用单元小结
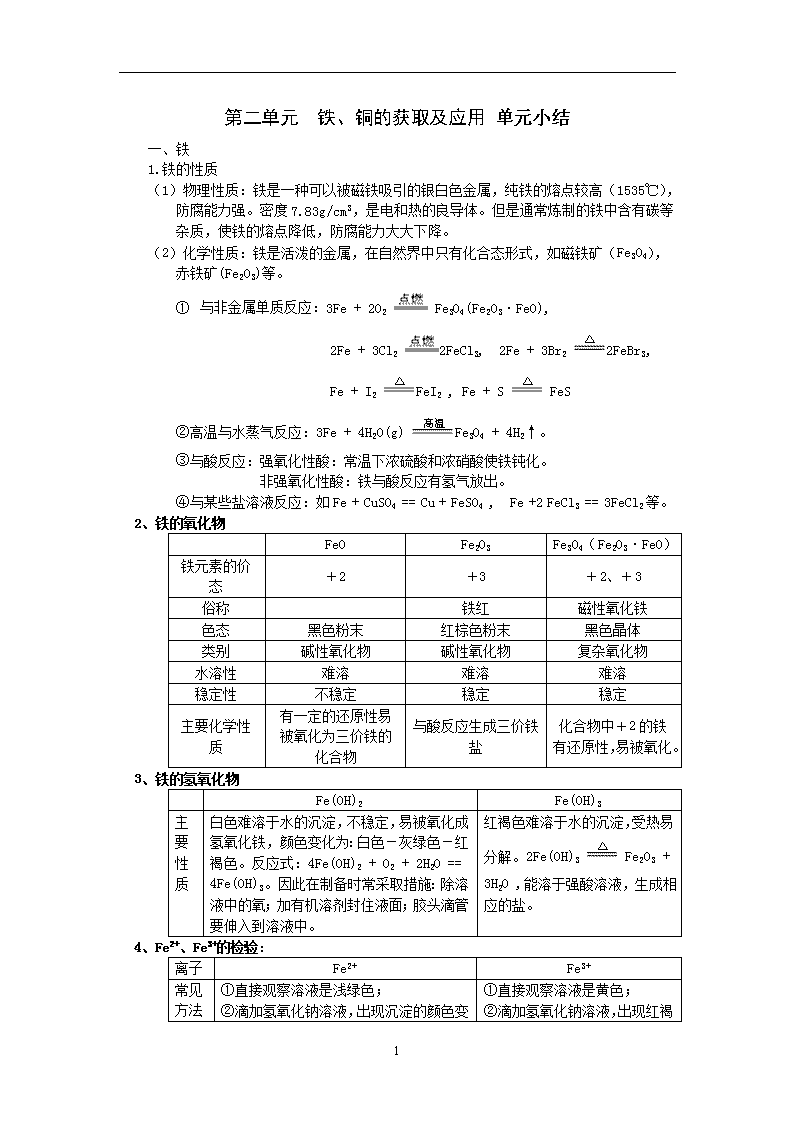
第二单元 铁、铜的获取及应用 单元小结 一、铁 1.铁的性质 (1)物理性质:铁是一种可以被磁铁吸引的银白色金属,纯铁的熔点较高(1535℃),防腐能力强。密度7.83g/cm3,是电和热的良导体。但是通常炼制的铁中含有碳等杂质,使铁的熔点降低,防腐能力大大下降。 (2)化学性质:铁是活泼的金属,在自然界中只有化合态形式,如磁铁矿(Fe3O4),赤铁矿(Fe2O3)等。 ① 与非金属单质反应:3Fe + 2O2 Fe3O4(Fe2O3·FeO), 2Fe + 3Cl2 2FeCl3, 2Fe + 3Br2 2FeBr3, Fe + I2 FeI2 , Fe + S FeS ②高温与水蒸气反应:3Fe + 4H2O(g) Fe3O4 + 4H2↑。 ③与酸反应:强氧化性酸:常温下浓硫酸和浓硝酸使铁钝化。 非强氧化性酸:铁与酸反应有氢气放出。 ④与某些盐溶液反应:如Fe + CuSO4 == Cu + FeSO4 , Fe +2 FeCl3 == 3FeCl2等。 2、铁的氧化物 FeO Fe2O3 Fe3O4(Fe2O3·FeO) 铁元素的价态 +2 +3 +2、+3 俗称 铁红 磁性氧化铁 色态 黑色粉末 红棕色粉末 黑色晶体 类别 碱性氧化物 碱性氧化物 复杂氧化物 水溶性 难溶 难溶 难溶 稳定性 不稳定 稳定 稳定 主要化学性质 有一定的还原性易被氧化为三价铁的化合物 与酸反应生成三价铁盐 化合物中+2的铁有还原性,易被氧化。 3、铁的氢氧化物 Fe(OH)2 Fe(OH)3 主要性质 白色难溶于水的沉淀,不稳定,易被氧化成氢氧化铁,颜色变化为:白色-灰绿色-红褐色。反应式:4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3。因此在制备时常采取措施:除溶液中的氧;加有机溶剂封住液面;胶头滴管要伸入到溶液中。 红褐色难溶于水的沉淀,受热易分解。2Fe(OH)3 Fe2O3 + 3H2O ,能溶于强酸溶液,生成相应的盐。 4、Fe2+、Fe3+的检验: 离子 Fe2+ Fe3+ 常见方法 ①直接观察溶液是浅绿色; ② ①直接观察溶液是黄色; ② 3 滴加氢氧化钠溶液,出现沉淀的颜色变化是:白色-灰绿色-红褐色; ③滴加KSCN溶液,无明显变化,再加氯水,溶液变血红色。 滴加氢氧化钠溶液,出现红褐色沉淀; ③滴加KSCN溶液,有血红色溶液出现。 5、Fe、Fe2+、Fe3+的相互转化 (一)“铁三角”关系 (二)具体方程式: 6、铁的冶炼 原料:铁矿石(提供铁元素)、焦炭(提供热量和还原剂)、空气(提供氧气)、石灰石(除去铁矿石中的二氧化硅杂质)。 设备:高炉。 主要反应:C + O2 CO2 , C + CO2 2CO (这两个反应是制造还原剂并提供热量), 3CO + Fe2O3 2Fe + 3CO2 , CaCO3 CaO + CO2↑ , CaO + SiO2 CaSiO3. 从高炉中出来的铁含有2-4.5%的C和其他杂质,性能差,需进一步的炼制得到性能较好的钢。高炉的尾气常含有CO有毒气体,常采取净化后循环使用的方法。 7、钢铁的腐蚀及防腐 (1)钢铁的腐蚀有化学腐蚀和电化腐蚀。 3 化学腐蚀:是指钢铁等金属遇周围的物质接触直接发生化学反应而引起的腐蚀。如铁与氯气的反应腐蚀。 电化腐蚀:是指钢铁在表面有电解质的环境下,铁失去电子,钢铁内的碳周围的氧气和水或氢离子得到电子而引起的腐蚀。如是氧气和水得到电子的腐蚀称吸氧腐蚀;而氢离子得电子的腐蚀称析氢腐蚀。我们在生活中常见到得铁锈就是钢铁得吸氧腐蚀得结果。吸氧腐蚀是钢铁电化腐蚀的主要形式。 (2)防腐措施: ①在钢铁表面覆盖保护层; ②在钢铁中加入一定量得铬、镍元素,改变钢铁内部结构; ③在钢铁表面镶嵌比铁活泼得金属如锌;在腐蚀时,锌先失去电子; ④将需要保护得钢铁接在不断有电子输出得电源得负极,使铁不可能失去电子。 二、铜 1、铜的性质 (1)物理性质 铜是紫红色的金属,是电和热的良导体,广泛用作导线,密度8.9g/cm3。 (2)化学性质 铜是较不活泼的金属,自然界中有少量的单质铜存在,大部分是化合态如黄铜矿(CuFeS2),孔雀石(CuCO3·Cu(OH)2)等。 铜在一定条件下可发生如下反应: ①与非金属单质反应:2Cu + O2 2CuO(黑色),Cu + Cl2 CuCl2(棕黄色的烟) 2Cu + S Cu2S(黑色) ②与某些盐溶液反应:Cu + 2FeCl3 == 2FeCl2 + CuCl2 ,Cu + 2AgNO3 == Ag + Cu(NO3)2。 2、铜的冶炼 工业上是高温冶炼黄铜矿得到粗铜,然后用电解方法精练得到纯度很高的精铜,电解中将粗铜连在电源的正极,精铜连在电源的负极,用可溶性的铜盐做电解液。这样通电一段时间后,粗铜上的铜就不断溶下,在精铜表面析出。www.ks5u.com w.w.w.k.s.5.u.c.o.m www.ks5u.com 3查看更多