- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届重庆市万州分水中学高二9月月考(2017
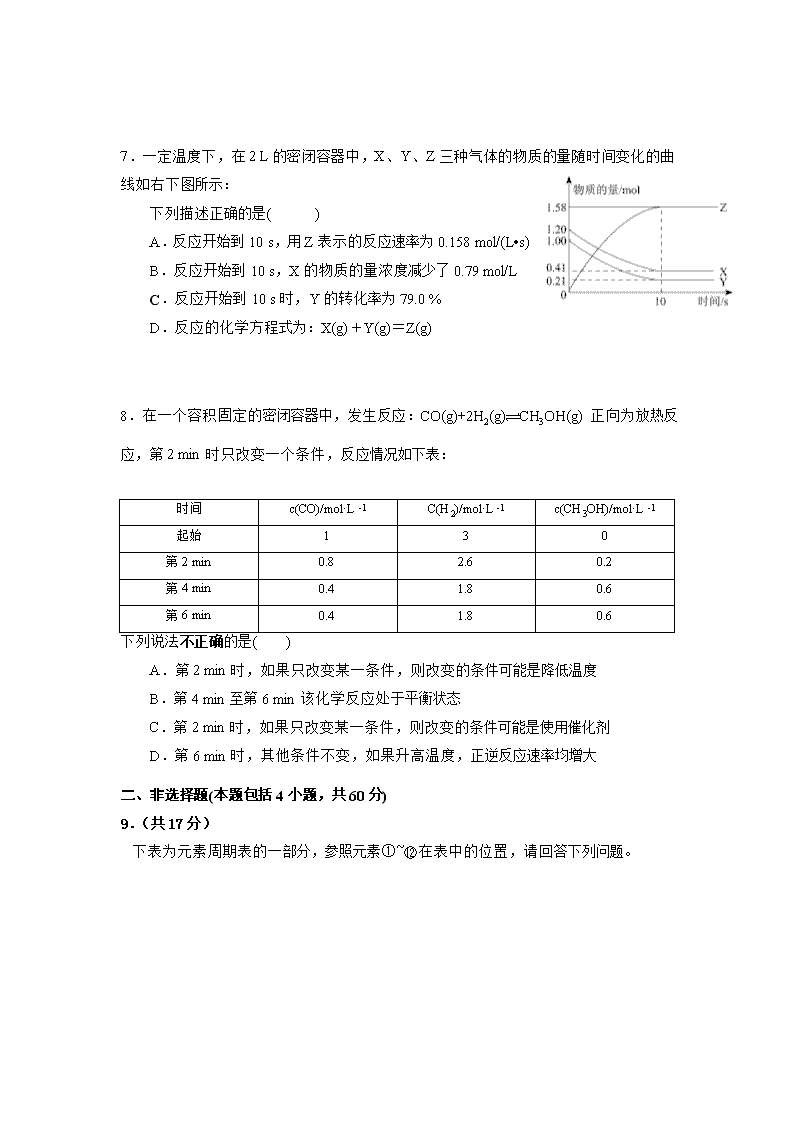
2017-2018学年度重庆市万州分水中学高二9月月考卷 化学试题卷 一、选择题(本题包括8小题,每小题5分,共40分) 1.下列溶液中导电性最强的是( ) A.1 L 0.1 mol/L醋酸 B.0.1 L 0.1 mol/L H2SO4溶液 C.0.5 L 0.1 mol/L盐酸 D.2 L 0.1 mol/L H2SO3溶液 2.室温下向10 mL 0.1 mol/L的醋酸溶液中加水稀释后,下列说法正确的是( ) A.溶液中导电粒子的数目减小 B.溶液中不变 C.醋酸的电离程度增大,c(H+)亦增大 D.醋酸的电离常数K随醋酸浓度减小而减小 3.对反应A+3B2C来说,下列反应速率中最快的是( ) A.v(A)=0.3 mol/(L·min) B.v(B)=0.6 mol/(L·min) C.v(C)=0.5 mol/(L·min) D.v(A)=0.01 mol/(L·s) 4.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均是具有相同电子层结构的短周期元素形成的简单离子,下列说法正确的是( ) A.原子半径C>D>A>B B.原子序数b>a>c>d C.离子半径D>C>B>A D.单质的还原性A>B>C>D 5.在一定温度下体积固定的密闭容器中,当下列物理量不再变化时,能表明可逆反应A(s)+2B(g) C(g)+D(g)已达平衡的是( ) ①混合气体的压强 ②气体的总物质的量 ③混合气体的密度 ④B的物质的量浓度 A.①② B.③④ C.①④ D.只有④ 6.对于可逆反应:A(g) + 2B(g) 2C(g) △H>0,下列图像中正确的是( ) 逆 正 逆 逆 正 正 7.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右下图所示: 下列描述正确的是( ) A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L C.反应开始到10 s时,Y的转化率为79.0 % D.反应的化学方程式为:X(g)+Y(g)=Z(g) 8.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g) CH3OH(g) 正向为放热反应,第2 min时只改变一个条件,反应情况如下表: 时间 c(CO)/mol·L-1 C(H2)/mol·L-1 c(CH3OH)/mol·L-1 起始 1 3 0 第2 min 0.8 2.6 0.2 第4 min 0.4 1.8 0.6 第6 min 0.4 1.8 0.6 下列说法不正确的是( ) A.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 B.第4 min至第6 min该化学反应处于平衡状态 C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 D.第6 min时,其他条件不变,如果升高温度,正逆反应速率均增大 二、非选择题(本题包括4小题,共60分) 9.(共17分) 下表为元素周期表的一部分,参照元素①~⑫在表中的位置,请回答下列问题。 族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 一 ① 二 ② ③ ④ ⑤ 三 ⑥ ⑦ ⑧ ⑨ ⑩ ⑪ ⑫ (1) 画出⑦的离子结构示意图________________________。 (2) ⑤、⑥、⑪的原子中半径最大的是______________(写编号)。 (3) ⑥和⑧的最高价氧化物对应的水化物中碱性弱些的是________。(填化学式) (4) ④、⑩的气态氢化物中稳定性较强的是_______。(填化学式) (5) ④与⑥以原子个数比为1:1形成的化合物的电子式为 ,将0.6mol该化合物投入到100mL3mol/L ACl3溶液中的离子方程式为 、 。 (6) ③的氢化物是由 (极性或非极性)键形成的极性分子,写出实验室制备该氢化物的化学方程式 。 (7) ③的最高价含氧酸的稀溶液与铜粉反应的离子方程式 。 (8) 利用较强酸能制出较弱酸的原理,写出一个能证明②和⑨非金属性强弱的一个常见反应的化学方程式 。 稀盐酸 10.(共14分) Ⅰ)、 如右图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答: (1)实验中能观察到的现象是 。(选填代号) A.试管中镁片逐渐溶解 B.试管中产生无色气泡 镁片 饱和 石灰水 C.烧杯外壁变冷 D.烧杯底部析出少量白色固体 (2)由实验推知,MgCl2溶液和H2的总能量 (填“大于” “小于”“等于”)镁片和盐酸的总能量。 温度计 硬纸板 碎纸条 Ⅱ)、用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: (1)从实验装置上看,图中尚缺少的一种玻璃用品是 。 (2)大烧杯上如不盖硬纸板,求得的中和热数值(绝对值) (填“偏大、偏小、无影响”)。 Ⅲ)、(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为: a.C(s)+O2(g)===CO2(g) ΔH=E1 ① b.C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2 ② H2(g)+O2(g)===H2O(g) ΔH=E3 ③ CO(g)+O2(g)===CO2(g) ΔH=E4 ④ 请表达E1、E2、E3、E4之间的关系为E2=_________________。 (2)如右图所示是1摩尔NO2 和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。 (3)化学反应的焓变与反应物和生成物的键能有关。已知某些化学键的键能如下表所示: 共价键 H—H Cl—Cl H—Cl 键能/(kJ·mol-1) 436 247 434 则反应:H2(g)+Cl2(g)===2HCl(g)的焓变ΔH = 。 11、(共16分) Ⅰ)、(8分)某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,为弱酸,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。该小组通过实验探究其原因。 (1)该反应的离子方程式为 (2)该实验中反应速率明显加快的原因可能是 A.反应放热导致温度升高 B.反应物接触面积增大 C.生成物的催化作用 D.压强增大 (3)为验证该反应速率明显加快的原因,甲同学继续进行了下列实验,请完成下表。 编号 温度/℃ 酸化的H2C2O4溶液/mL KMnO4溶液/mL 溶液褪色所需时间/s 1 25 5.0 2.0 40 2 25 (另加少量可溶于水的MnSO4粉末) 4 3 60 25 氨氮废水 低浓度氨氮废水 含HNO3废水 达标废水 Ⅱ Ⅰ Ⅲ Ⅱ)、(8分)某氮肥厂氨氮废水中氮元素多以和NH3·H2O的形式存在,该废水的处理流程如下: (1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用 (2)过程Ⅱ:在微生物作用的条件下,经过两步反应被氧化成。两步反应的能量变化示意图如下: 第一步反应是 反应(选填“放热”或“吸热”),判断依据是 。1 mol (aq)完全转化成 (aq)共与环境交换了 kJ热量。 (3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3 还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 12.(共13分) 已知:CO(g)+H2O (g) CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示: 温度/℃ 400 500 850 平衡常数 9.94 9 1 请回答下列问题: (1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。 (2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率(CO)= 。 (3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。 (4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。 (5)有人提出可以设计反应2CO(g)=2C(s)+O2(g) ΔH>0来消除CO的污染,请判断该反应能否自发进行 (填“能”或“否”),理由是 。 分水中学高2019级高二上期九月月考化学答题卷 完卷时间:50分钟 满 分:100分 一、选择题:(每小题5分,共40分) 题号 1 2 3 4 5 6 7 8 答案 二、非选择题:(共60分) 9.(共17分) (1).________________________。 (2).______ ________。 (3).___ _____。 (4).___ ____。 (5). , 、 。 (6). , 。 (7)._________________ ______。 (8).______________________ _______________________________。 10.(共14分) Ⅰ).(1)____________________。 (2)_____ ___。 Ⅱ).(1) 。 (2) 。 Ⅲ). (1) E2=_________________。 (2) 。 (3)ΔH = 。 11.(共16分) Ι:(8分) (1) (2) (3) 编号 温度/℃ 酸化的H2C2O4溶液/mL KMnO4溶液/mL 溶液褪色所需时间/s 1 25 5.0 2.0 40 2 25 (加MnSO4粉末) 4 3 60 25 Ⅱ:(8分) (1) (2) , 。 。 (3) 12.(共13分) (1) , Q 0。 (2)(CO)= 。 (3) 。 (4) 。 (5) ,理由是 。 参考答案 1 B 2. B 3. D 4. B5.B6. D 7.C8.A 9.(共17分) (1). 1分 (2).⑥ 1分 (3).Al(OH)3 1分 (4).H2O 1分 (5). (2分) 2Na2O2+2H2O=4Na++4OH-+ O2↑(2分), Al3++4OH-= AlO2-+2H2O(2分) (6).极性(1分) 2NH4Cl+ Ca(OH)2 CaCl2+2NH3↑+2H2O(2分) (7).3Cu + 8H+ +2NO3- = 3Cu2+ +2NO↑+ 4H2O 2分 (8).Na2SiO3 + H2O + CO2 = H2SiO3↓+ Na2CO3 2分 10.(每项2分,共14分) Ⅰ).(1)A B D(选填代号) (2)小于 Ⅱ). (1)环形玻璃搅拌棒(其它合适答案给分) (2)偏小 Ⅲ). (1)请表达E1、E2、E3、E4之间的关系为E2=E1-E3-E4 (2) NO2(g)+CO(g)===NO(g)+CO2(g) ΔH=-234 kJ·mol-1 (3ΔH =-185 kJ·mol-1 11.(1)5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O (2分) (2)AC (2分) (3)② 5.0 2.0 (2分) ③5.0 2.0 (共2分) (1) NH4+ + OH— NH3↑+ H2O (2分) (2)放热(1分) 反应物总能量高于生成物总能量(或ΔH<0) (1分) 346 (2分) (3)5∶6 (2分) 13.(每空2分,共13分) (1)K= 2分 < 2分 (2)0.03 mol/(L·min) 2分 (3)75% 2分 (4)y=x 2分 (5)否; 1分 ΔH>0吸热且ΔS<0 或依据吉布斯自由能判断反应不能自发进行 2分 查看更多