- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省林州市第一中学高二上学期开学考试化学试题
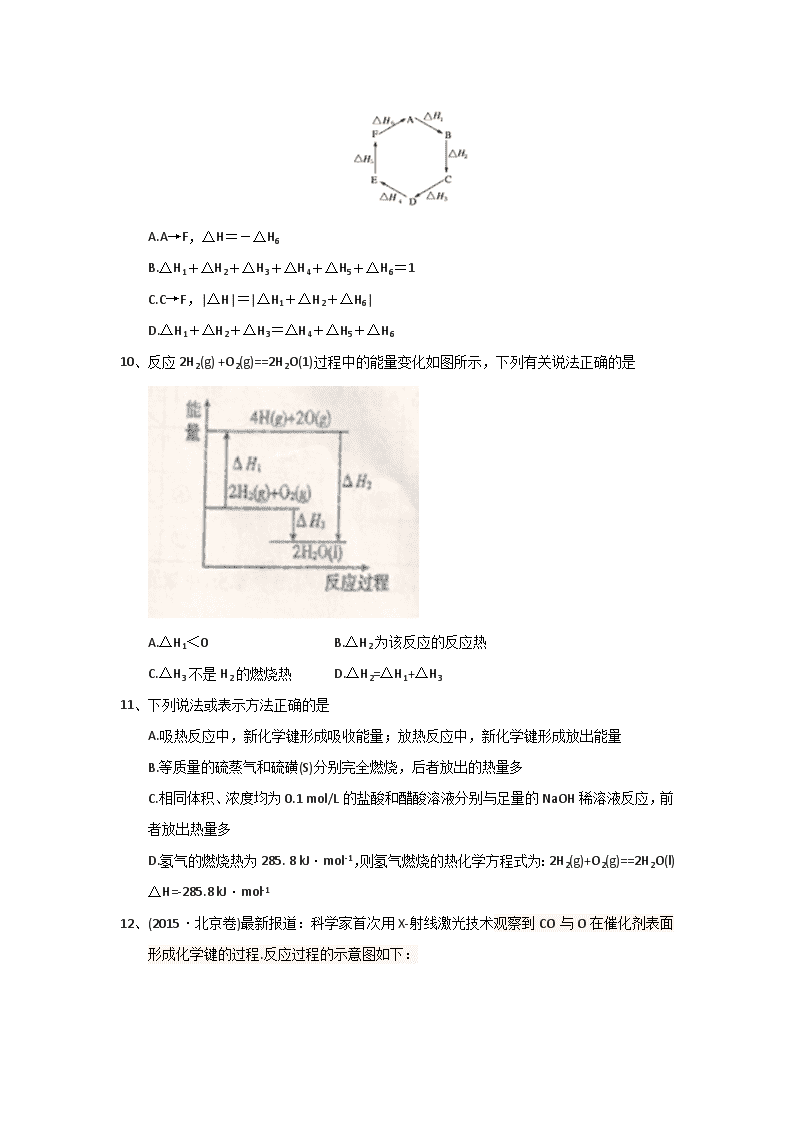
2017-2018学年河南省林州市第一中学高二上学期开学考试化学试题 一、选择题(每小题3分,共21小题,共63分) 1、设阿伏加德罗常数的数值为NA,下列说法正确的是 A.1 molCl2与足量Fe反应,转移的电子数为3NA B.1.5 mol NO2与足量H2O反应,转移的电子数为1.5NA C.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA D.0.10 mo Na2O2粉末与足量水反应生成的O2分子数为0.10NA 2、用固体样品配制—定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是 3、(2016 •高考四川卷)下列关于离子共存或离子反应的说法正确的是 A.某无色溶液中可能大量存在H+,Cl-、MnO4- B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32- C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O 4、向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是 操作 现象 结论 A 滴加BaCl2溶液 生成白色沉淀 原溶液中有SO42- B 滴加氯水和 CCl4振荡、静置 下层溶液显紫色 原溶液中有I- C 用洁净铂丝蘸取溶液进行焰色反应 火焰至黄色 原溶液中有Na+, 无K+ D 滴加稀NaOH溶液,将湿润红 色石蕊试纸置于试管口 试纸不变蓝 原溶液中 无NH4+ 5、下列关于元素周期律和元素周期表的说法错误的是 A.Na、Mg、Al元素的原子核外电子层数随着核电荷数的增加而增加 B.第2周期元素从Li到F,元素原子得电子能力逐渐增强 C.同一周期从左到右,随着元素原子序数的递增,其气态氢化物的稳定性增强 D. C、N、O、F的单质与H2化合越来越容易 6、已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 A.原子序数 d>c>b>a B.原子半径:r(A)>r(B)>r(D)>r(C) C.单质的还原性:A>B>D>C D.离子半径:r(C3-)> r(D-)> r(B+)> r(A2+) 7、下列能说明氯原子得电子能力比硫原子强的是 ①HC1的溶解度比H2S大 ②HC1的酸性比H2S强 ③HCl的稳定性比H2S强 ④HC1的还原性比H2S强 ⑤HC1O的酸性比H2SO4强 8、(2016·高考新课标I卷)下列关于有机化合物的说法正确的是 A.2-甲基丁烷也称异丁烷 B.由乙烯生成乙醇属于加成反应 C.C4H9Cl有3中同分异构体 D.油脂和蛋白质都属于高分子化合物 9、(2015·湖州中学期中)盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是 A.A→F,ΔH=-ΔH6 B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1 C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6| D.ΔH1+ΔH2+ΔH3=ΔH4+ΔH5+ΔH6 10、反应2H2(g) +O2(g)==2H2O(1)过程中的能量变化如图所示,下列有关说法正确的是 A.△H1<0 B.△H2为该反应的反应热 C.△H3不是H2的燃烧热 D.△H2=△H1+△H3 11、下列说法或表示方法正确的是 A.吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量 B.等质量的硫蒸气和硫磺(S)分别完全燃烧,后者放出的热量多 C.相同体积、浓度均为0.1 mol/L的盐酸和醋酸溶液分别与足量的NaOH稀溶液反应,前者放出热量多 D.氢气的燃烧热为285. 8 kJ·mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-285.8 kJ·mol-1 12、(2015·北京卷)最新报道:科学家首次用X-射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下: 下列说法正确的是 A. CO和O生成CO2是吸热反应 B..在该过程中,CO断键形成C和O C. CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 13、(2017·四川眉山中学月考)已知:①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=+494kJ·mol-1 ②CO(g)+1/2O2(g) ===CO2(g) ΔH=-283 kJ·mol-1 ③C(s)+1/2O2(g)===CO(g) ΔH=-110kJ·mol-1 则反应Fe2O3(s)+3C(s)+ 3/2O2(g) ===2Fe(s)+3CO2(g)的焓变是 A. -355 kJ B.+355 kJ C.-355 kJ • mol-1 D.+355 kJ • mol-1 14、(2014·重庆卷)已知:①C(s)+H2O(g)===CO(g)+H2(g) ΔH=-akJ·mol-1 ②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol−1 H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462kJ•mol−1,则a为 A.-332 B.-118 C.+350 D.+130 15、在一定容量的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2,H2,NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。当反应达到平衡时,可能存在的数据是 A .N2为0.2mol/L,H2为0.6mol/L B.N2为0.15mol/L C.N2,H2均为0.18mol/L D.NH3为0.4mol/L 16、(江西南昌摸底)已知:(CH3COOH)22CH3COOOH,实验测得不同压强下体系平均相对分子质量() 随温度(T)变化曲线如图所示。下列说法正确的是 A.该过程△H<0 B.平衡常数:K (a) =K (b)查看更多
相关文章
- 当前文档收益归属上传用户