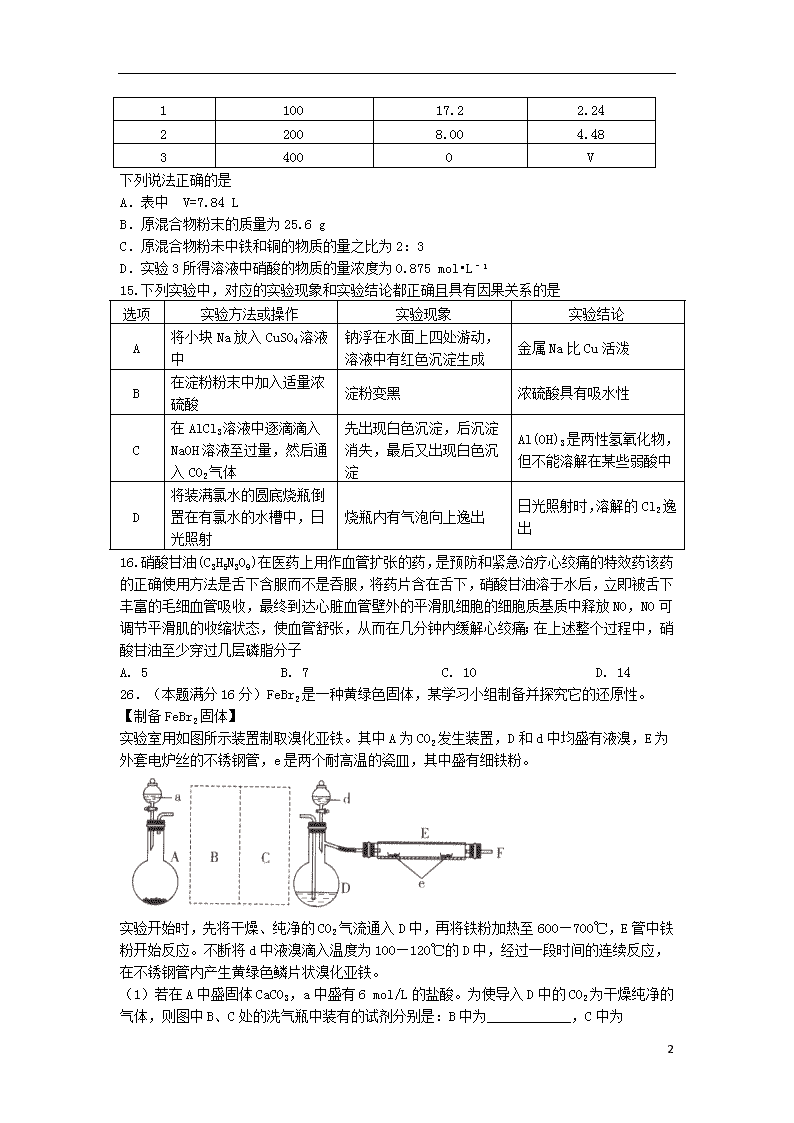
2019学年高二化学下学期期末结业考试试题(实验班) 新目标A版
2019学年高二化学下学期期末结业考试试题(实验班)
9.下列叙述正确的是
A. 常温常压下,4.6gNO2气体约含有1.81×1023 个原子
B. 标准状况下,80gSO3所占的体积约为22.4 L
C. 标准状况下,22.4LCCl4中含有的CCl4 分子数为NA
D. 标准状况下,22.4L氢气与足量氧气反应,转移的电子数为1NA
10.下列有关物质性质的比较顺序中,不正确的是
A. 热稳定性:HF
Na+>Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 最外层电子数:Li”或“<”)。
(5)若在40 mL上述FeBr2溶液中通入标准状况下67.2 mL的 C12,取少量反应后的溶液加入CCl4,振荡后下层液体呈_____色,写出该反应的离子方程式_______________________________。
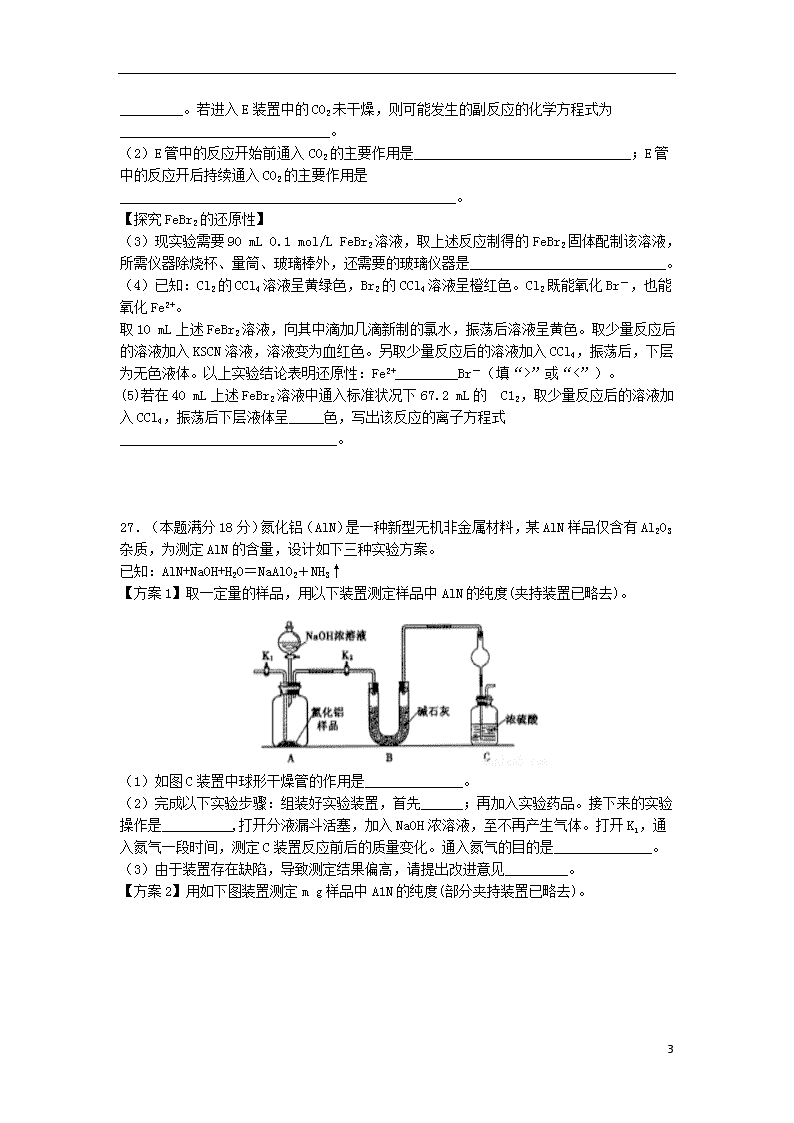
27.(本题满分18分)氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是__________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
【方案2】用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
6
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.
(6)若m g样品完全反应,测得生成气体的体积为Vml,(已转换为标准状况),则A1N的质量分数为_____________(用含V、m的代数式表示)。
28.(本题满分24分)氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:
(1)已知氢气的燃烧热为285.8kJ/mol。
4NH3 (g) +5O2 (g) 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则工业合成氨的热化学方程式为 。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中 T表示温度, n表示物质的量)
①图像中 T2和 T1的关系是: T2 T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是 (填字母)。
6
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1L, n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K= 。
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2N2O4 ∆H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是 。
A.b点的操作是压缩注射器
B.c点与a点相比, c(NO2)增大, c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)> v(逆)
(4)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为 极,其电极反应式为 。
②当有0.1 mol NO2被处理时,转移电子为 mol。
③为使电池持续放电,该离子交换膜需选用 交换膜。
9
10
A
A
11
12
13
14
15
16
B
C
A
A
C
D
26.
(1)饱和NaHCO3溶液 浓硫酸 3Fe+4H2OFe3O4+4H2↑
(2) 排尽装置中原有的空气 将溴蒸气带入E装置中进行反应
(3)胶头滴管 100mL容量瓶
6
(4)> (5) 橙红 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
27.
(1)防止倒吸
(2)检查装置气密性 关闭K1,打开K2 把装置中残留的氨气全部赶入C装置
(3)C装置出口处连接一个干燥装置
(4)保持气压恒定,使NaOH浓溶液容易流下
(5)ad
(6)[41V/22400m]×100%
28.
(1) N2(g)+3H2(g)2NH3(g) △H = -92.4kJ/mol
(2)
①低于
② C
③25/12 或2.08或2.1
(3)AC
(4)
①负 2NH3—6e—+6OH—=N2+6H2O
②0.4
③阴离子
6