- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年湖北省宜昌市葛洲坝中学高一上学期期末考试试题 化学 (word版)
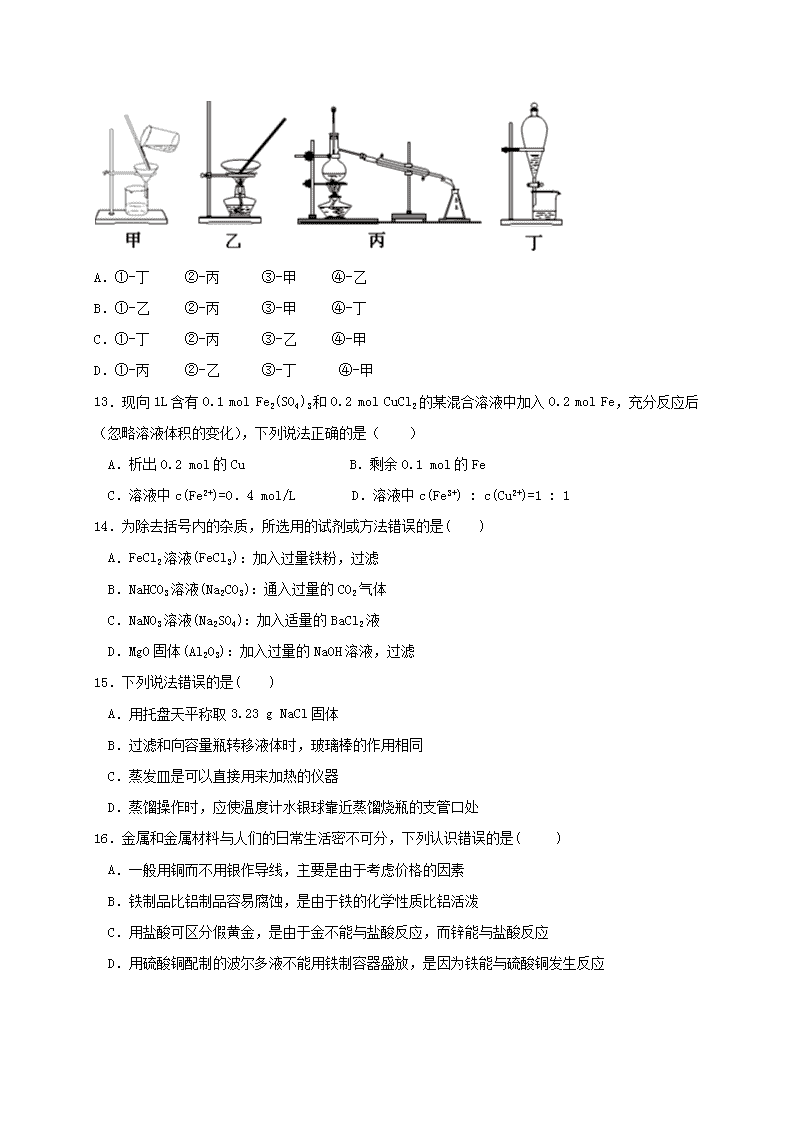
宜昌市葛洲坝中学2018-2019学年第一学期 高一年级期末考试试卷化学试题 满分:100分 时限:90分钟 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Cu-64 Fe-56 第Ⅰ卷(选择题,共54分) 一、选择题(本题包括18小题,每小题3分,共计54分。每小题只有一个选项符合题意。) 1.下列叙述正确的是( ) A.胶体的本质特征是丁达尔效应 B.利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 D.宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是氢氧化铜 2.为了火车客运安全,下列药品:①NH4NO3 ②(NH4)2SO4 ③食盐 ④油漆 ⑤汽油 ⑥黑火药 ⑦生石灰,从化学性质判断,由于易燃易爆而不能带上火车的是 ( ) A.③④⑤⑥⑦ B.①②⑦ C.①④⑤⑥ D.①④⑦ 3.用NA表示阿伏加德罗常数,下列叙述正确的是( ) A.标准状况下,22.4LH2O含有的分子数为NA B.常温常压下,NA个CO2分子占有的体积为22.4L C.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA 4.分类法在化学发展中起到了非常重要的作用,下列分类标准合理的是 ( ) A.根据是否含有氧元素,将物质分为氧化剂和还原剂 B.根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 C.根据水溶液是否能够导电,将物质分为电解质和非电解质 D.根据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 5.下列离子可大量共存且溶液无色的是( ) A.Cu2+、SO42-、Fe3+、Cl- B.Ba2+、Na+、NO3-、CO32- C.MnO4-、Fe2+、Na+、SO42- D.Na+、NO3-、K+、SO42- 6.下列有关铁、铜及其化合物的说法正确的是( ) A.FeSO4 可用于生产缺铁性贫血的药剂 B.硫酸铜常用于饮用水的消毒剂 C.常温下铁与浓硫酸不反应 D.铁丝不能代替铂丝来做焰色反应实验 7.下列物质的主要成分不属于硅酸盐的是( ) A.陶瓷 B.玻璃 C.水泥 D.玛瑙 8.标准状况下有:①6.72LCH4 ②3.01×1023个HCl ③10.8gH2O ④0.7molNH3 下列对这四种物质的大小关系表示错误的是( ) A.体积:④>③>②>① B.分子数:④>③>②>① C.氢原子数:④>①=③>② D.质量:②>④>③>① 9.下列叙述错误的是( ) A.节假日燃放的五彩缤纷的烟花,和一些金属元素的焰色反应有关 B.硅胶常作实验室和袋装食品等的干燥剂 C.正常雨水的pH是5.6,酸雨的pH大于5.6 D.二氧化硅是现代光纤的原料 10.下列指定反应的离子方程式正确的是( ) A.金属钠和水反应:Na+2H2O=Na++2OH-+H2 ↑ B.硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ C.用氢氧化钠溶液吸收少量二氧化硫气体:SO2+OH-= HSO3- D.碳酸氢钠溶液和过量的澄清石灰水混合:HCO3-+Ca2++OH-=CaCO3↓+ H2O 11.钛和钛合金在航空工业有重要的应用。冶炼钛的过程中发生反应之一是: TiO2+2C+2Cl2=TiCl4+2CO。下列说法错误的是( ) A.生成1 mol TiCl4时,转移电子4 mol B.C是还原剂 C.尾气必须净化处理 D.TiO2是氧化剂 12.下列操作中选择的仪器正确的是( ) ①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水③分离氯化钾和二氧化锰混合物 ④从氯化钠溶液中得到氯化钠晶体 A.①-丁 ②-丙 ③-甲 ④-乙 B.①-乙 ②-丙 ③-甲 ④-丁 C.①-丁 ②-丙 ③-乙 ④-甲 D.①-丙 ②-乙 ③-丁 ④-甲 13.现向1L含有0.1 mol Fe2(SO4)3和0.2 mol CuCl2的某混合溶液中加入0.2 mol Fe,充分反应后(忽略溶液体积的变化),下列说法正确的是( ) A.析出0.2 mol的Cu B.剩余0.1 mol的Fe C.溶液中c(Fe2+)=0.4 mol/L D.溶液中c(Fe3+) : c(Cu2+)=1 : 1 14.为除去括号内的杂质,所选用的试剂或方法错误的是( ) A.FeCl2溶液(FeCl3):加入过量铁粉,过滤 B.NaHCO3溶液(Na2CO3):通入过量的CO2气体 C.NaNO3溶液(Na2SO4):加入适量的BaCl2液 D.MgO固体(Al2O3):加入过量的NaOH溶液,过滤 15.下列说法错误的是( ) A.用托盘天平称取3.23 g NaCl固体 B.过滤和向容量瓶转移液体时,玻璃棒的作用相同 C.蒸发皿是可以直接用来加热的仪器 D.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 16.金属和金属材料与人们的日常生活密不可分,下列认识错误的是( ) A.一般用铜而不用银作导线,主要是由于考虑价格的因素 B.铁制品比铝制品容易腐蚀,是由于铁的化学性质比铝活泼 C.用盐酸可区分假黄金,是由于金不能与盐酸反应,而锌能与盐酸反应 D.用硫酸铜配制的波尔多液不能用铁制容器盛放,是因为铁能与硫酸铜发生反应 17.今有下列三个氧化还原反应:①2FeCl3+2KI = 2FeCl2+2KCl+I2 ②2FeCl2+Cl2 = 2FeCl3 ③2KMnO4+16HCl(浓) =2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+和I—共存,要氧化除去I—而又不影响Fe2+,可加入的试剂是( ) A.Cl2 B.KMnO4 C.FeCl3 D.FeCl2 18.某溶液X呈无色,且仅可能含有Ba2+、Na+、NH4+、H+、Cl-、I-、SO32-、SO42-八种离子中的几种(不考虑水的电离,且溶液中各离子浓度均为0.1 mol·L-1,向该溶液中滴加少量新制氯水,所得溶液仍为无色。下列关于溶液X的分析中错误的是( ) A.肯定不含Cl- B.肯定不含H+ C.肯定不含NH4+ D.肯定含有SO32- 第Ⅱ卷(非选择题共46分) 二、填空题(本题包括4大题,共46分) 19.(10分)(1)0.5 mol Na2CO3中含有___________个Na+。 (2)质量都是50 g的 HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是____________。(填化学式) (3)实验室配制90 mL 0.1 mol/L CuSO4溶液,需要胆矾________g。 (4) 粗盐的提纯实验中每步所加试剂均需过量,如何判断除杂过程中所加BaCl2溶液是否过量?_____________________________________________________________________________。 (5)现有下列8种物质:①H2O、②Mg、③CH3COOH、④NaOH溶液、⑤CuSO4·5H2O、⑥碘酒、⑦C2H5OH、⑧盐酸,其中属于电解质的是_____________。(填序号) 20.(14分)氧化还原反应是一类重要的反应。 (1)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______________________________________。 (2)过氧化钠与二氧化碳的反应常作为潜水艇中氧气的来源,写出该反应的化学方程式__________________________,若该反应转移3mol电子,则所产生的氧气在标准状况下的体积为______。 (3)在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是___________。 A.m=y,R3+是还原剂 B.m=2y,R2+被氧化 C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂 (4)实验室中所用少量氯气是用下列方法制取的:4HCl(浓)+MnO2Cl2↑+MnCl2+2H2O其中氧化剂与还原剂的物质的量之比_____________,写出该反应的离子方程式__________________________ (5)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式: KMnO4+ H2SO4+ H2C2O4 = MnSO4+ K2SO4 + CO2↑+ H2O, 21.(11分)实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。 (1)为了安全,在点燃D处的酒精灯之前,在b处必须________________。 (2)装置B的作用是_______________ ,装置C中盛装的液体是________________。 (3)在硬质双通玻璃管中发生的化学反应方程式是________________________________、__________________________。 (4)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U型管的质量增加7.2 g,则混合物中Fe2O3的质量为______________。 (5)U型管E右边连接干燥管F的目的是________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”“偏小”或“无影响”)。 22.(11分)(1)将0.1 mol镁铝的混合物溶于100 mL 2 mol·L-1 H2SO4溶液中,产生的2.688 LH2(标准状况)。计算镁、铝的物质的量分别是多少? _______、_______、 (2)铁粉和氧化铁粉末的混合物共13.6 g,加入到200 mL的稀硫酸中,固体完全溶解,得到标准状况下1.12 L氢气。经测定,反应后的溶液中c(H+)为0.200 mol·L-1,且无Fe3+(忽略反应前后溶液体积变化)。请计算: ①反应中发生的离子方程式有___________________________________________________________。 ②原混合物中铁和氧化铁的物质的量之比为___________________。 ③原稀硫酸的物质的量浓度为________________ mol·L-1。 宜昌市葛洲坝中学2018-2019学年第一学期 高一年级期末考试试卷化学答案 1-18 BCCDD ADACD DACCA BCC 19.(10分,每空2分)(1) NA (2) NH3 (3) 2.5 (4) 取上层清液于试管中,继续滴加BaCl2溶液,如果有沉淀生成说明BaCl2溶液少量,反之没有沉淀说明BaCl2溶液已过量。 (5)①③⑤ 20.(14分,每空2分)(1)2Fe3++Cu=2Fe2++Cu2+ (2)2Na2O2+2CO2=2Na2CO3+O2 33.6L (3)D (4) 1:2 4H++2Cl-+MnO2Cl2↑+Mn2++2H2O (5) 2 KMnO4+ 3 H2SO4+ 5 H2C2O4 = 2MnSO4+ 1 K2SO4 + 10 CO2↑+ 8 H2O 21.(11分)(1)验纯(1分) (2) 除HCl (1分) 浓H2SO4 (1分) (3)Fe2O3+3H22Fe+3H2O FeO+H2Fe+H2O (每个1分) (4)16 g (2分) (5)防止空气中水蒸气进入(2分) 偏大(2分) 22.(11分)(1)0.06mol;(2分) 0.04mol(2分) (2)①Fe+2H+ = Fe2++H2↑ Fe2O3+6H+=2Fe3++6H2O Fe+2Fe3+=3Fe2+ (每个1分) ②2∶1 (2分) ③ 1.10 (2分) 查看更多