福建省莆田第一中学2019-2020学年高二上学期期末考试化学试题
莆田一中2019-2020学年度上学期期末考试试卷
高二 化学选修4
命题人: 审核人:刘
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Cu 64 I 127
温馨提示:(完卷时间:90分钟 分值:100分)
第Ⅰ卷(选择题 54分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共54分)
1.化学与生活生产密切相关。下列说法中错误的是( )
A.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
B.钡中毒患者可尽快使用苏打溶液洗胃,将Ba2+转化为BaCO3而排出
C.夏天冰箱保鲜食品的原理是降低温度,减慢化学反应速率
D.纯碱溶液显碱性,加热去油污效果更佳。
2.下列说法中正确的是( )
A.在同温同压下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.将pH=3的CH3COOH加水稀释到体积为原来的10倍,测得其pH=4
C.FeCl2溶液经加热蒸干,充分灼烧,最后得到Fe2O3固体
D.已知2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,
则可知C的燃烧热ΔH=-110.5 kJ·mol-1
3. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在c(H+)/c(OH-)=106 mol/L的溶液中 Al3+、NH4+、Cl-、SO42-
B. 由水电离的的c(H+)=10-13 mol/L溶液中Ca2+、K+、Cl-、HCO3-
C. pH=1的溶液中: Fe2+、Na+ 、SO42-、NO3-
D. 使酚酞呈红色的溶液; Mg2+、ClO-、AlO2-、Na+
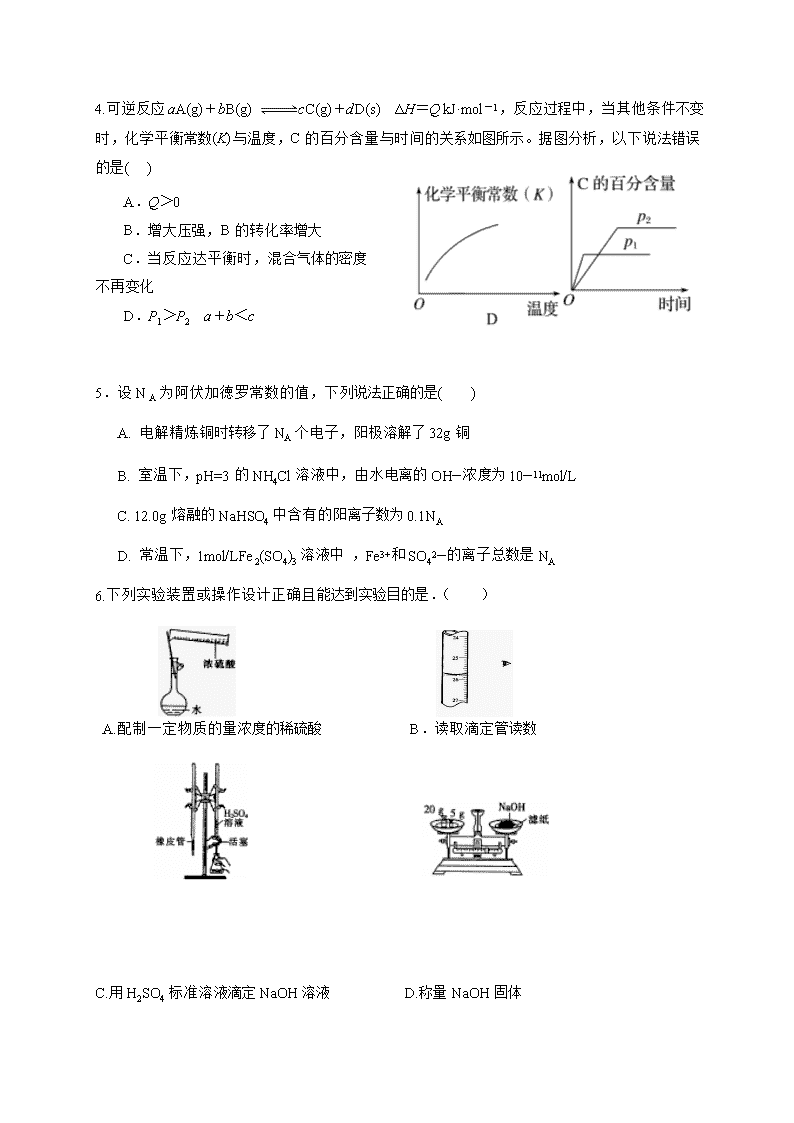
4.可逆反应aA(g)+bB(g) cC(g)+dD(s) ΔH=Q kJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是( )
A.Q>0
B.增大压强,B的转化率增大
C.当反应达平衡时,混合气体的密度不再变化
D.P1>P2 a+b<c
5.设N A为阿伏加徳罗常数的值,下列说法正确的是( )
A. 电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B. 室温下,pH=3的NH4Cl溶液中,由水电离的OH—浓度为10—11mol/L
C. 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
D. 常温下,1mol/LFe2(SO4)3溶液中 ,Fe3+和SO42—的离子总数是NA
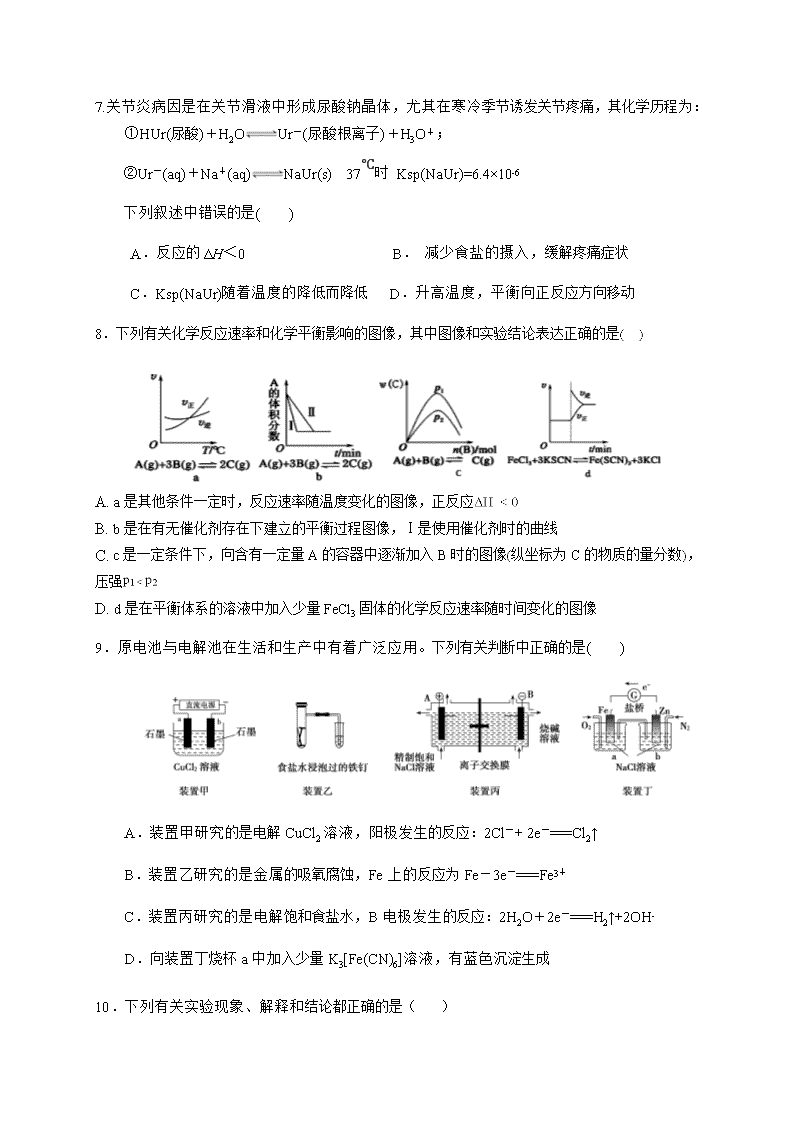
6.下列实验装置或操作设计正确且能达到实验目的是.( )
A.配制一定物质的量浓度的稀硫酸 B.读取滴定管读数
C.用H2SO4标准溶液滴定NaOH溶液 D.称量NaOH固体
7.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节诱发关节疼痛,其化学历程为:①HUr(尿酸)+H2OUr-(尿酸根离子)+H3O+;
②Ur-(aq)+Na+(aq)NaUr(s) 37℃时 Ksp(NaUr)=6.4×10-6
下列叙述中错误的是( )
A.反应的ΔH<0 B. 减少食盐的摄入,缓解疼痛症状
C.Ksp(NaUr)随着温度的降低而降低 D.升高温度,平衡向正反应方向移动
8.下列有关化学反应速率和化学平衡影响的图像,其中图像和实验结论表达正确的是
A. a是其他条件一定时,反应速率随温度变化的图像,正反应
B. b是在有无催化剂存在下建立的平衡过程图像,Ⅰ是使用催化剂时的曲线
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图像纵坐标为C的物质的量分数,压强
D. d是在平衡体系的溶液中加入少量FeCl3固体的化学反应速率随时间变化的图像
9.原电池与电解池在生活和生产中有着广泛应用。下列有关判断中正确的是( )
A.装置甲研究的是电解CuCl2溶液,阳极发生的反应:2Cl-+ 2e-===Cl2↑
B.装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe-3e-===Fe3+
C.装置丙研究的是电解饱和食盐水,B电极发生的反应:2H2O+2e-===H2↑+2OH-
D.向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
10.下列有关实验现象、解释和结论都正确的是( )
选项
实验操作
实验现象
解释或结论
A
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变深
反应2NO2N2O4的△H>0
B
等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体
HX放出的氢气多且反应速率快
酸的强弱:HX<HY
C
常温下,用pH计分别测定0.1moI/L NaA溶液的0.1moI/L NaB溶液的pH
pH:NaA>NaB
能证明酸性:HA>HB
D
向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 mol/L的NaI溶液,再振荡,
先生成白色沉淀,后产生黄色沉淀
Ksp(AgI)
④>③>①>⑤
16.下列离子方程式中,属于盐类水解且离子方程式正确的是( )
A.Na2CO3溶液: CO32- +2H2O H2CO3+ 2OH-
B.NaHCO3溶液:HCO3-+H2O CO32-+ H3O+
C.NaHS溶液:HS-+ H2O H2S + OH-
D.KF溶液:F-+H2O = HF+OH-
17.下列图示与对应的叙述相符的是
A. 图1表示相同温度下的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中在b点对应温度下,将的与的NaOH溶液等体积混合后,溶液显中性
C. 图1中,b点酸的总浓度大于a点酸的总浓度
D. 图2中纯水仅升高温度,就可以从a点变到c点
18.用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3
溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
第Ⅱ卷(非选择题46分)
二、填空题
19. (14分) CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
已知化学键键能数据如表:
化学健
C﹣H
C=O
H﹣H
C≡O(CO)
键能(kJ/mol)
413
745
436
1075
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g)。
则该反应的△H= 。
②在恒容绝热条件下,一定能说明该反应已达平衡状态的是 。(填字母)
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.容器内的温度不再变化 D.v正(CH4)=2v逆(H2)
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g);
△H= - 49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2 mol CO2和6mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)= ;该温度下的平衡常数数值= (保留三位有效数字)。
(3)下列措施能使n(CH3OH)/n(CO2)增大的是________。
A.降低温度
B.恒温恒容下,再充入2 mol CO2、6 mol H2
C.使用高效催化剂
D.恒温恒容充入He(g)使体系压强增大
(4)一种熔融碳酸盐燃料电池原理示意如图2。
①该电池的负极反应式为
②电池工作时,CO32﹣向电极__________移动(填A或者B)。
20.(12分) 实验室以蛇纹石酸浸出液主要含,还有一定量的、、、等为原料制备高纯氧化铁,流程如图1:
氨水
H2O2
氨水
Na F
试剂X
Na2S
高纯
氧化铁
后续操作
调PH
过滤
沉铁
氧化
除铝
沉锰
还原
浸出液
滤渣
图1
已知流程中相关金属离子生成氢氧化物沉淀的pH如表:
氢氧化物
开始沉淀的pH
沉淀完全的pH
已知:在该温度下, Ksp(CaF2)=2.0×10-10 Ksp(MnF2)=5.0×10-3 Ksp(MgF2)=7.4×10-11
“还原”时,应选择______填字母.
A.Zn粉 溶液 粉
“滤渣”的主要成分除含有少量外,还含有______填化学式.
“沉锰”时,已知: 为确保沉锰完全即溶液中
,应保持溶液中______.
“除铝”时,控制溶液pH的范围为
“氧化”时,常用酸性溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为
“沉铁”时,反应温度为条件下,反应时间和反应终点pH
对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是______.
21.(20分)砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2 和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:
(1)装置连接的顺序为a→ (填接口字母顺序);M仪器在实验过程中的作用是: ;
(2)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________;③关闭弹簧夹,打开分液漏斗塞子及活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2 ,⑤取下D装置,……
步骤④中继续通入N2的目的是
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取 25.00mL 用0.20 mol·L-1 Na2S2O3 标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(3)Na2S2O3 标准液应装在_____________(填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是____________ ______________;
(4)用Na2S2O3 溶液滴定I2时,应用 作为指示剂。滴定终点的现象是:
(5)滴定实验重复四次得到数据如下:
实验
①
②
③
④
消耗的标准液的体积/mL
18.37
20.05
19.95
20.00
①若实验开始时,向D 装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________%。
②若Na2S2O3 标准液已部分氧化变质,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。
莆田一中2019-2020学年度上学期期末考试试卷答案
题序
1
2
3
4
5
6
7
8
9
答案
B
C
A
B
C
C
D
B
C
题序
10
11
12
13
14
15
16
17
18
答案
B
A
B
B
C
A
C
B
C
19(14分 各2分)(1)+120kJ/mol; ②BC
(2) 0.225mol/(L.min);5.33
(3)AB
(4)H2﹣2e﹣+CO32﹣=H2O+CO2;
CO﹣2e﹣+CO32﹣=2CO2; A
20.(12分 各2分)
(1)C; (2)、;
(3); (4);
(5);
(6)反应时间30min、终点
21.(12分 各2分)
(1)d→e→i→h→g→f→b→(c) 平衡内外气压,防止压强过大
(2)打开弹簧夹,通入氮气 将装置中的SO2全部赶入B装置中吸收
(3) 碱式 使所有剩余的碘均进入滤液,测量结果更准确
21(8分 各2分)
(4)淀粉 当滴入最后一滴标准液时,溶液由蓝色突变为无色,且半分钟不复原
(5)①7.2% ②偏低