- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省师大附中高二上学期期中考试化学(理)试题 Word版
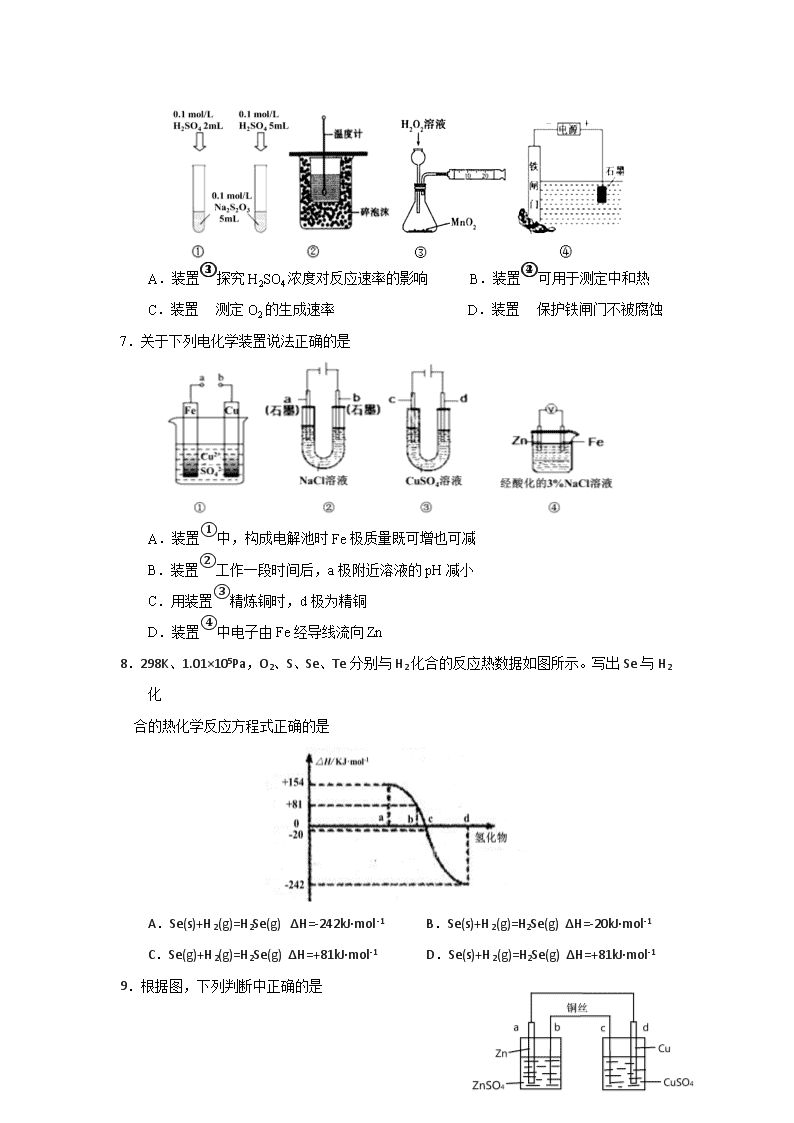
福建师大附中2018-2019学年第一学期期中考试卷 高二化学(理) 时间:90分钟 满分:100分 命题:高二备课组 审核:高二备课组 试卷说明: (1) 本卷两大部分,共22题,解答写在答卷的指定位置上,考试结束后,只交答卷。 (2) 考试过程中不得使用计算器或具有计算功能的电子设备。 (3) 可能用到的相对原子质量:Li-7 H-1 O-16 Cu-64 C-12 N-14 第 Ⅰ卷(选择题,共45分) 一、单项选择题(只有一个正确选项,1-6每小题2分,7-17每小题3分,共45分) 1.已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应中,在任何温度下都不自发进行的是 A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0 C.N2(g)+3H2(g)=2NH3(g ) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0 2.对于平衡CO2(g) CO2(aq) △H= —19.75 kJ • mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是 A.升温增压 B.降温减压 C.升温减压 D.降温增压 3.下列对钢铁制品采取的措施不能防止钢铁腐蚀的是 A.保持表面干燥 B.表面镀锌 C.表面形成烤蓝 D.表面镶嵌铜块 4.用铁片与稀硫酸反应制取氢气时,下列措施几乎不影响氢气产生速率的是 A.加少量醋酸钠固体 B.不用稀硫酸,改用98%浓硫酸 C.滴加少量CuSO4溶液 D.加少量硫酸钠固体 5.一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)Y(g)+ Z(s),以下不能说明该反应达到化学平衡状态的是 A.混合气体的密度不再变化 B.反应容器中Y的质量分数不变 C.体系压强不再变化 D.2v逆(X)=v正(Y) 6. 下列装置或操作能达到目的是 A.装置①探究H2SO4浓度对反应速率的影响 B.装置②可用于测定中和热 C.装置③测定O2的生成速率 D.装置④保护铁闸门不被腐蚀 7.关于下列电化学装置说法正确的是 A.装置①中,构成电解池时Fe极质量既可增也可减 B.装置②工作一段时间后,a极附近溶液的pH减小 C.用装置③精炼铜时,d极为精铜 D.装置④中电子由Fe经导线流向Zn 8.298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化 合的热化学反应方程式正确的是 A.Se(s)+H2(g)=H2Se(g) ΔH=-242kJ·mol-1 B.Se(s)+H2(g)=H2Se(g) ΔH=-20kJ·mol-1 C.Se(g)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1 D.Se(s)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1 9.根据图,下列判断中正确的是 A.电路中电子的流动方向:a−d−CuSO4(aq) −c−b B.该原电池原理:Zn+CuSO4 ═ZnSO4+Cu C.c电极质量减少量等于d电极质量增加量 D.d电极反应:Cu2++2e− = Cu,反应后CuSO4溶液浓度下降 10. 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如右,该电池工作时反应为: 4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是 A.电极a 为电池正极 B.图中选择性透过膜为阴离子透过性膜 C.电池工作过程中,电极a附近区域pH减小 D.VB2极发生的电极反应为: 2VB2 +22OH——22e- = V2O5 + 2B2O3 + 11H2O 11. 一定条件下对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、 c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是 A.c1∶c2=1∶3 B.平衡时Y和Z的生成速率之比为2∶3 C.X、Y的转化率之比为1:3 D.c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1 12.对于可逆反应:2A(g)+B(g) 2C(g) △H< 0,下列图像正确的是 13.下列有关图像,其中说法正确的是 A.由图Ⅰ知,反应在 T1、T3 处达到平衡 B.由图Ⅰ知,该反应的△H<0 C.由图Ⅱ知,t3时采取降低反应温度的措施 D.由图Ⅱ知,反应在 t6时,NH3 体积分数最大 14.高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为: 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是 A.放电时负极反应为:Zn-2e-+2OH- = Zn (OH)2 B.充电时阳极发生氧化反应,附近溶液碱性增强 C.充电时每转移3mol电子,阴极有1.5mol Zn生成 D.放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH- 15.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g) 化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断 正确的是 A.达到平衡,AB3的物质的量大小为:c>b>a B.若T2>T1,则正反应一定是放热反应 C.达到平衡时A2的转化率大小为:b>a>c D. 若T2>T1,达到平衡时b、d点的反应速率为vd > vb 16.在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g), 所得实验数 据如下表,下列说法不正确的是 实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol n(X) n(Y) n(M) ① 700 0.10 0.10 0.09 ② 800 0.20 0.20 0.10 ③ 900 0.10 0.15 a A.正反应为放热反应 B.实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速 率v(N)= 0.01mol/(L•min) C.实验②中,该反应的平衡常数K=1.0 D.实验③中,达到平衡时,a大于0.06 17.在一定温度下,二氧化硫与氧气反应的热化学方程式为 2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 A.上述反应达到平衡时,二氧化硫和氧气的转化率都是20% B.上述反应达到平衡后,向容器中充入1.0 mol Ar,平衡正向移动 C.起始时向容器中充入1.0 mol SO3,保持温度不变,达到平衡时共吸收19.6 kJ的热量 D.起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,反应达到平衡前 v正<v逆 第Ⅱ卷(非选择题,共55分) 二、填空题(5小题,共55分) 18.(10分) (1)化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4 与H2C2O4反应中,可通过观察单位时间内 变化来测定该反应的速率;在Na2S2O3+H2SO4==Na2SO4+S↓+SO2↑+H2O反应中,该反应速率的快慢可通过 来判断。 (2)已知:Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓+ H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验: 实验序号 反应温度 Na2S2O3浓度 稀硫酸 H2O V/mL c/(mol/L) V/mL c/(mol/L) V/mL ① 20 10.0 0.10 10.0 0.50 0 ② 40 V1 0.10 V2 0.50 V3 ③ 20 V4 0.10 4.0 0.50 V5 该实验①、②可探究 对反应速率的影响,因此V1、V2和V3分别是 、 、 。实验①、③可探究 对反应速率的影响,因此V4、V5分别是 、 。 19. (8分) (1)已知:P4(s)+6Cl2(g)4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)4PCl5(g) ΔH=bkJ·mol-1;;破坏PCl5中1mol P—Cl键所需能量为ckJ·mol-1,破坏PCl3中1molP—Cl键所需能量为1.2ckJ·mol-1。则破坏Cl2中1molCl—Cl键所需的能量为 。 (2) 工业合成氨时,合成塔中每生成1molNH3放出46kJ的热量。其反应过程的能量变化如图。b值为 kJ。加入催化剂,a值 (填“增大”“减小”或“不变”,下同)。压缩容器体积,b值 。 (3) “嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C2H8N2)作推进剂。N2O4与偏二甲肼燃烧产物只有CO2(g)、H2O(g)、N2(g),并放出大量热,已知10.0 g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为____________________________ ____________________________________________。 20.(14分) (1)图1中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为 ,乙池中石墨电极上发生的反应为 。甲池中么每消耗0.1 mol N2H4,乙池电极上则会析出 g固体。 (2) 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的 极(填“正”或“负”)。F电极上的电极反应式为 。 (3) 图3为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为 。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有 (任写一条) 0.1 0.2 0.3 0.4 0.5 0.6 物质的量(mol) 21.(12分)氨是重要的氮肥,合成原理为: N2(g)+3H2(g)2NH3(g) △H= —92.4 kJ/mol。在 500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如右图,回答下列问题: (1)10 min内以NH3表示的平均反应速率: ; (2)在10 ~20 min内:NH3浓度变化的原因可能是 A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量 (3)第1次平衡的平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数= (小数点后保留一位); (4)在反应进行至25 min时:①曲线发生变化的原因 , ② 达第二次平衡时,新平衡的平衡常数K2 K1(填“大于”“等于”或“小于”)。 22.(13分) (1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表: 热化学方程式 平衡常数 ① 2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) ΔH1=a kJ∙mol-1 K1 ② 4NO2(g)+2NaCl(s)2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ∙mol-1 K2 ③ 2NO(g)+Cl2(g)2NOCl(g) ΔH3 K3 则该温度下,ΔH3= kJ∙mol-1;K3= (用K1和K2表示)。 (2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是 (填“甲”或“乙”),a值为 。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正 v逆(填“>”“<”或“=”) (3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 福建师大附中2018-2019学年第一学期期中考参考答案 高二化学(理) 1-5 BDDDD 6-10 DADCC 11-15 AABBA 16-17 DC 18.(10分) (1)时间,溶液颜色,出现浑浊所需要的时间(3分) (2)温度,10.0、10.0、0(4分);浓度,10.0、6.0 (3分) 19.(8分) (1)错误!未找到引用源。(2分) (2)92 (2分) 减小(1分) 不变(1分) (3)C2H8N2(l)+2N2O4(l)===2CO2(g)+4H2O(g)+3N2(g) ΔH=-2 550.0 kJ·mol-1 (2分) 20.(12分) (1)N2H4+4OH--4e-===N2+4H2O (2分);2H2O-4e-===O2↑+4H+或4OH--4e-===2H2O+O2↑ (2分);12.8(2分) (2) 负 (1分) ClO- + 2e- + H2O = Cl-+ 2OH- (2分) (3)S- 6e- +3O2- = SO3 (2分);硫磺(二氧化硫)循环使用;用稀硫酸吸收SO3(减小生成物浓度,有利于提高S转化率) (1分) 21.(12分) (1)v = 0. 005 mol/(L min) (2分) ;(2) AB (2分) ; (3) (2分) ;45.5 %(2分) (4)移走0.1 mol NH3(2分) , ②等于(2分) 22.(13分) (1)2a-b (2分) (1分) (2)<(2分) 加入催化剂(1分) 增大(1分) 乙(1分) 2 (2分) >(1分) (3) (2分)查看更多