辽宁铁岭市清河第二中学2020届高三12月月考化学试题
辽宁铁岭市清河第二中学2019-2020学年度高三12月化学测试题(word版有答案)
试卷满分100分,考试时间90分钟。试卷包括Ⅰ卷和Ⅱ卷两部分。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 Fe:56 Cu:64
Ag:108
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案)
1. 下图所示为工业合成氨的流程图。有关说法不正确的是
107
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤③、④、⑤均有利于提高原料平衡的转化率
D.产品液氨除可生产化肥外,还可用作制冷剂
2.下列说法正确的是
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)===2Fe2O3(s)常温下可自发进行,该反应ΔH>0
C.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
D.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
3. CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器
起始物质的量/mol
CO2平衡转化率(α)
编号
容积/L
条件
CH4(g)
CO2(g)
CO(g)
H2(g)
Ⅰ
2
恒温恒容
2
1
0
0
50%
Ⅱ
1
0.5
1
0
0
Ⅲ
1
绝热恒容
1
0.5
0
0
-
下列说法正确的是
A. T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B. 容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C. 容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D. 容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)
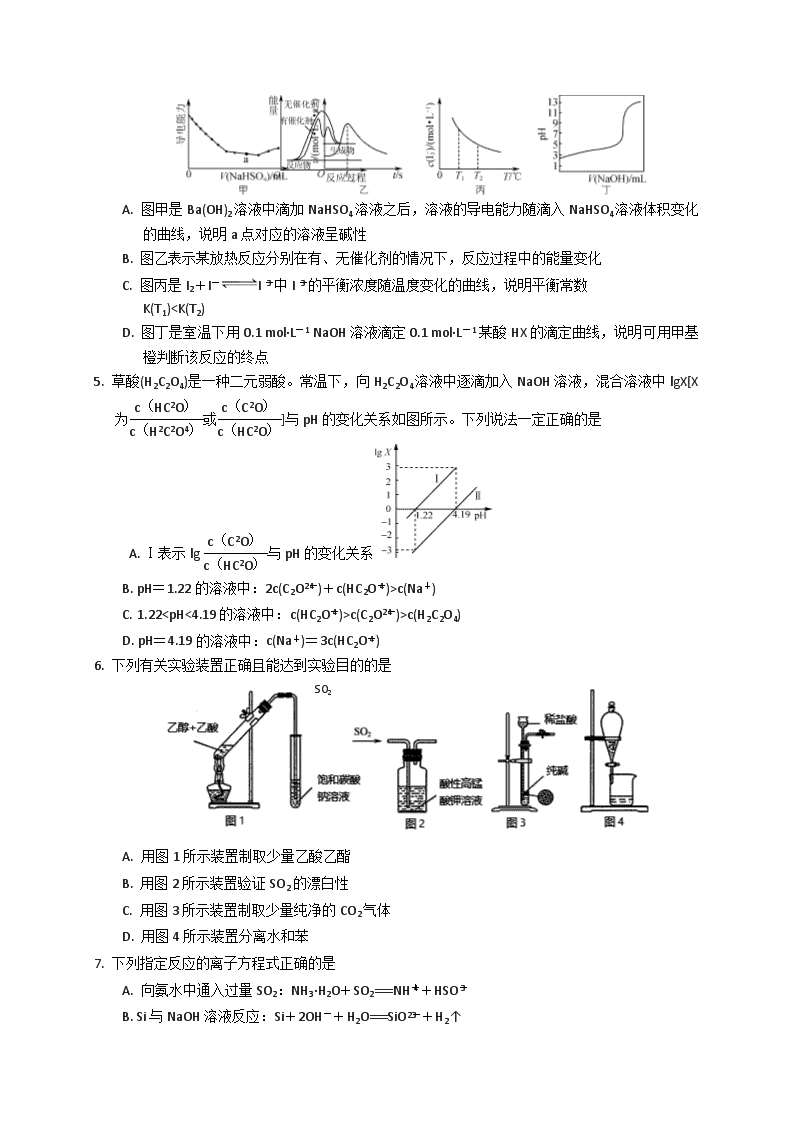
c(Na+)
C. 1.22c(C2O)>c(H2C2O4)
D. pH=4.19的溶液中:c(Na+)=3c(HC2O)
6. 下列有关实验装置正确且能达到实验目的的是
SO2
A. 用图1所示装置制取少量乙酸乙酯
B. 用图2所示装置验证SO2的漂白性
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离水和苯
7. 下列指定反应的离子方程式正确的是
A. 向氨水中通入过量SO2:NH3·H2O+SO2===NH+HSO
B. Si与NaOH溶液反应:Si+2OH-+H2O===SiO+H2↑
C. 电解MgCl2溶液:2H2O+2Cl-2OH-+H2↑+Cl2↑
D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:
Ba2++2OH-+2H++SO===BaSO4↓+2H2O
8. 短周期主族元素X、Y、Z、W的原子序数依次增大,且位于三个不同周期,X与W同主族,W元素金属性在短周期中最强,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
A. 原子半径:r(W)>r(Z)>r(Y)>r(X)
B. 元素Y的简单气态氢化物的热稳定性比Z的强
C. 仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性也可能呈酸性
D. 化合物X2Z2与W2Z2所含化学键类型完全相同
9. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L-1FeCl3溶液:Mg2+、Al3+、MnO、SCN-
B. 能使紫色石蕊试液变蓝的溶液:Ca2+、Na+、ClO-、I-
C. 0.1 mol·L-1 NH4HCO3溶液:Ba2+、K+、OH-、NO
D. =10-12的溶液:NH、Na+、SO、Cl-
10. 根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
将适量苯加入溴水中,充分振荡后,水层接近无色
苯能与溴水发生加成反应
B
室温下,向FeCl3溶液中滴加少量KI溶液,再滴加2滴淀粉溶液,溶液变蓝色
Fe3+的氧化性比I2的强
C
室温下,向10 mL 0.2 mol·L-1 NaOH溶液中滴入2滴0.1 mol·L-1 MgCl2溶液,产生白色沉淀,再滴加2滴0.1 mol·L-1 FeCl3溶液,有红褐色沉淀生成
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
D
常温下,分别测定浓度均为0.1 mol·L-1 NaF和NaClO溶液的pH,后者的pH大
酸性:HF7.6时,水体中总氮去除率反而下降,可能的原因是__ __。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
20.(14分)某小组用实验 1验证FeCl3与 Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
1滴0.1 mol/L
KSCN溶液
振荡、静置
0.15g铜粉
2 mL 0.1 mol/L FeCl3溶液 溶液变为红色 红色褪去,产生白色沉淀
实验1:
资料:ⅰ. CuSCN、CuCl 均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO4 2-、Cu2+与Cl-。
ⅱ. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与溴单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为 。
(2)下列由实验1得到的推论中,合理的是 。(填字母序号)
a.Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(Ⅰ)(Ⅰ表示+1 价铜元素)可能是由 Fe3+氧化Cu 得到的
(3)为探究实验 1中白色沉淀的成分,小组同学实施了实验2:
0.1mol/L AgNO3
溶液
0.1mol/L BaCl2
溶液
少量白色沉淀
大量白色沉淀
实验1中
白色沉淀
蓝色溶液
加入3滴
加入3滴
分为
两等分
稀硝酸
加入过量
由实验2可知,实验1中白色沉淀的成分是 。
(4)该小组欲进一步探究实验 1中白色沉淀产生的原因,实施了实验3:
步骤
实验操作
实验现象
Ⅰ
向2mL 0.1mol/L的FeCl3溶液中加入0.15g Cu粉
溶液变为蓝色,澄清透明,底部只有少量红色固体剩余
Ⅱ
取Ⅰ中上层清液于试管中,滴加 1滴 0.1mol/L KSCN溶液
有白色沉淀生成,且溶液出现红色
Ⅲ
振荡Ⅱ中试管,静置
白色沉淀变多,红色逐渐褪去
① 步骤Ⅰ中反应的离子方程式为 。
② 根据实验 3 的现象,小组同学认为 Fe3+与Cu 反应的氧化产物不含Cu(Ⅰ),他们的判断依据是 。
③ 步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是 。
④解释步骤Ⅲ中实验现象产生的可能原因: 。
参考答案及评分标准
一、选择题(每小题3分,共48分)
1.C 2.D 3.A 4.A 5.B 6.D 7.A 8.C 9.D 10.B
11.B 12.D 13.A 14.C 15.B 16.C
二、非选择题(共52分)
6分
17.(12分)
(1)温度低于70 ℃,反应速率降低,温度高于80 ℃,HNO3分解(或挥发)加快(2分)
(2) 2Fe2++H2O2+2H+===2Fe3++2H2O(2分)
(3) 3.3≤pH<4.4 (2分)
6分
(4) CuS (2分)
(5) ①xNiCO3·yNi(OH)2(x+y)NiO+xCO2↑+yH2O(2分)
② Ni(OH)2中Ni含量高于NiCO3,pH越大,碱式碳酸镍中Ni(OH)2比例增大(2分)
18.(14分)
8分
(1)Na2SO4(1分)
(2)NaHCO3 NaClO或CH3COONa (2分)
(3)①A(1分); ②1.8×10-5(或10-4.74)(2分)
6分
③2×10-5-2×10-9(2分)
(4) 100mL容量瓶、胶头滴管、(量筒)(2分)
(5) 溶液变为红色且半分钟内不褪色(2分);85%(2分)
6分
19. (12分)
(1) 8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=(2c-7a-3b)kJ·mol-1(2分)
(2) ① 2NH3+3NaClO===N2+3NaCl+3H2O (2分);
6分
温度过高,HClO发生分解,氨氮去除率随之降低 (2分)
②有部分NH3被氧化成NO2-或NO3-(2分)
(3) ①2NO3-+10H===N2↑+2OH-+4H2O (2分) ② 0.08(2分)
20.(14分)(1)Fe3++3SCN-⇌Fe(SCN)3(2分)
8分
(2)abc(2分)
(3)CuCl、CuSCN(2分)
(4)①2Fe3++Cu==2Fe2++Cu2+(2分)
②Ⅰ中没有白色沉淀CuCl 生成(2分)
6分
③Cu2+氧化SCN-生成(SCN)2,(SCN)2将Fe2+氧化为Fe3+,Fe3+与SCN-结合,溶液变红。(或 Fe2+被空气中O2氧化为Fe3+)(2分)
④2Cu2+ +4SCN- ==2CuSCN+(SCN)2,导致 SCN-浓度下降,使Fe3++3SCN-⇌Fe(SCN)3平衡逆移,红色褪去(2分)