- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
甘肃省甘谷第一中学2020届高三上学期第四次检测考试化学试题
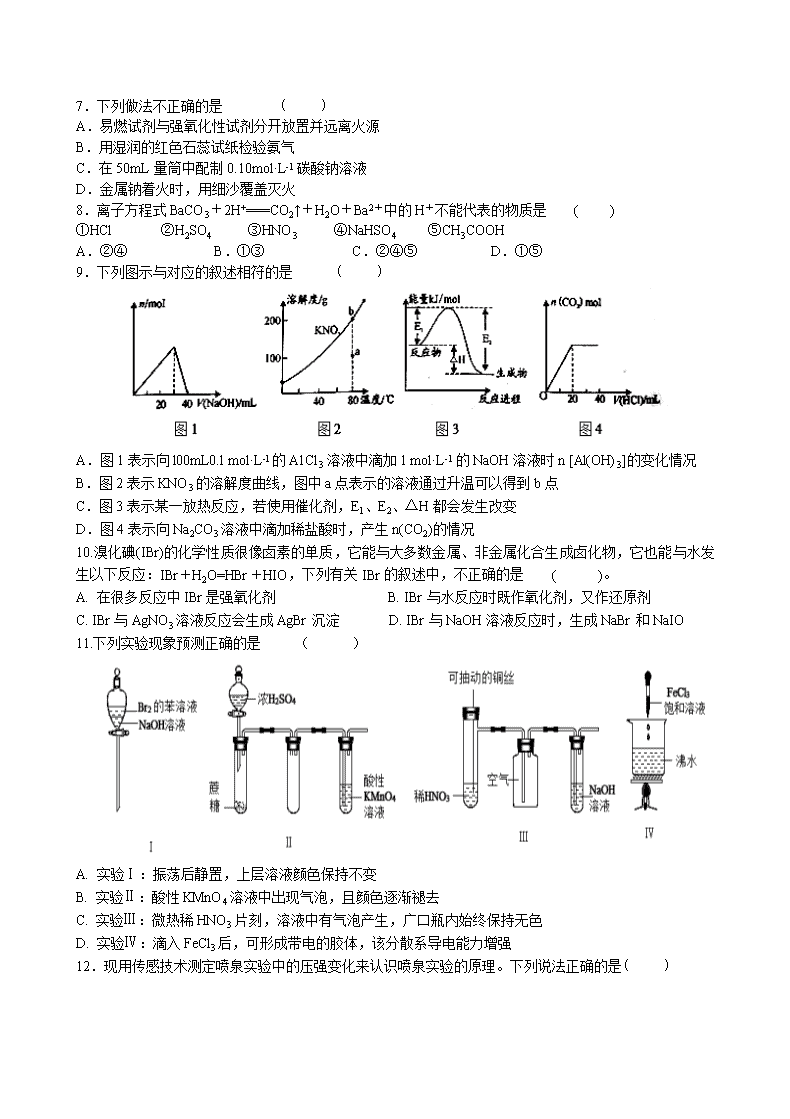
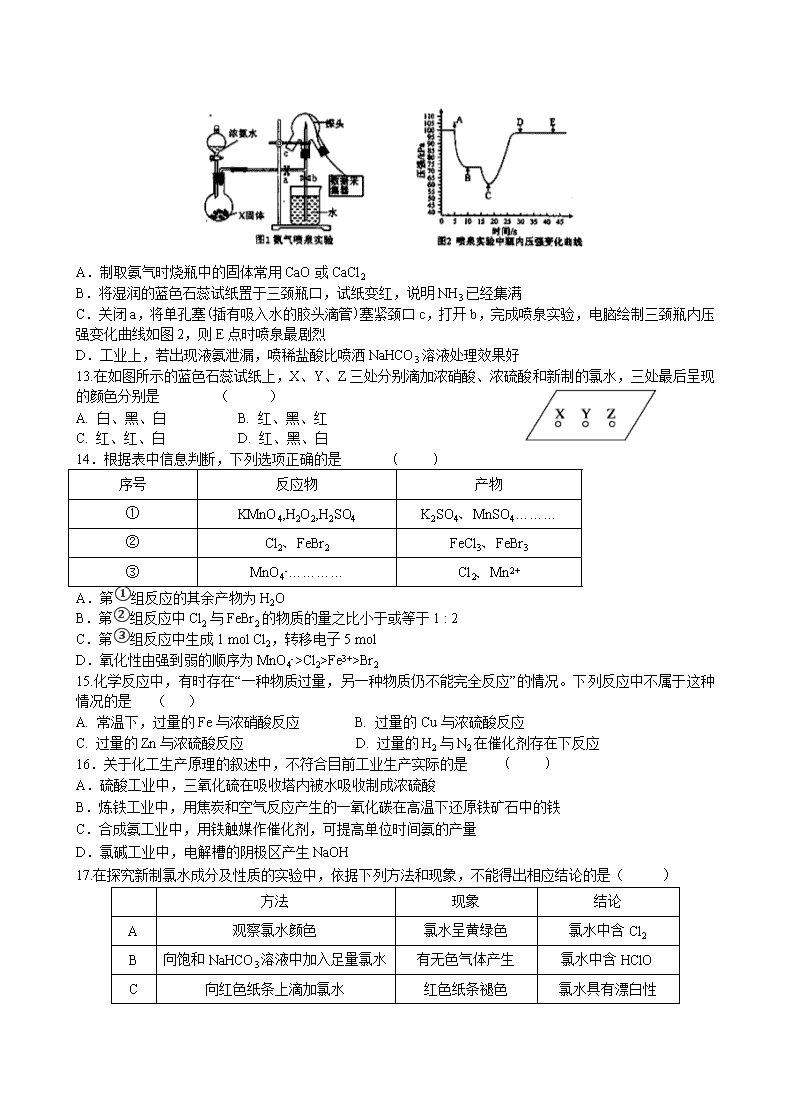
甘谷一中2019—2020学年高三级第四次检测 化学试卷 相对原子量:Cl:35.5 C:12 S:32 Cu:64 N:14 H:1 O:16 Fe: 56 第Ⅰ卷(选择题,60分) 一、选择题(每小题只有一个选项符合题意,每题2分,共60分) 1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成性质与化学有着密切关系。下列说法错误的是 ( ) A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 2.已知NA是阿伏加德罗常数的值,下列说法错误的是 ( ) A.3g 3He含有的中子数为1NA B.1 L 0.1 mol·L−1磷酸钠溶液含有的数目为0.1NA C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA 3.下列化学方程式中,不能正确表达反应颜色变化的是 ( ) A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4Cu+ZnSO4 B.澄清的石灰水久置后出现白色固体Ca(OH)2+CO2CaCO3↓+H2O C.Na2O2在空气中放置后由淡黄色变为白色2Na2O22Na2O+O2↑ D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl32Fe(OH)3+3MgCl2 4.常温下,1mol化学键断裂形成气态原子所需的能量用E表示。结合表中信息判断下列说法错误的是 ( ) 共价键 H-H F-F H-F H-Cl H-I E(kJ/mol) 436 157 568 432 298 A.432kJ/mol >E(H-Br) >298kJ/mol B.表中最稳定的共价键是H-F键 C.H2(g)→2H(g) △H=+436kJ/mol D.H2(g)+F2(g)=2HF(g) △H=-25kJ/mol 5.下列说法正确的是 ( ) A.将NaOH溶液分多次缓慢注入盐酸中,还是一次性快速注入盐酸中,都不影响中和热测定 B.已知反应的中和热为ΔH= -57.3 kJ·mol-1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热ΔH= -2×57.3 kJ·mol-1 C.燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量,故S(s)+3/2O2(g)═SO3(g) ΔH= -315 kJ·mol-1 即为硫的燃烧热 D.化学键断裂时吸收能量,形成时释放能量 6.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是 ( ) A.苹果放在空气中久置变黄和纸张久置变黄原理相似 B.用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 C.SO2 具有漂白性,可用于食品增白 D.奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 7.下列做法不正确的是 ( ) A.易燃试剂与强氧化性试剂分开放置并远离火源 B.用湿润的红色石蕊试纸检验氨气 C.在50mL量筒中配制0.10mol·L-1碳酸钠溶液 D.金属钠着火时,用细沙覆盖灭火 8.离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是 ( ) ①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH A.②④ B.①③ C.②④⑤ D.①⑤ 9.下列图示与对应的叙述相符的是 ( ) A.图1表示向l00mL0.l mol·L-l的A1Cl3溶液中滴加1 mol·L-1的NaOH溶液时n [Al(OH)3]的变化情况 B.图2表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 C.图3表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变 D.图4表示向Na2CO3溶液中滴加稀盐酸时,产生n(CO2)的情况 10.溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )。 A. 在很多反应中IBr是强氧化剂 B. IBr与水反应时既作氧化剂,又作还原剂 C. IBr与AgNO3溶液反应会生成AgBr沉淀 D. IBr与NaOH溶液反应时,生成NaBr和NaIO 11.下列实验现象预测正确的是 ( ) A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 B. 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 C. 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 D. 实验Ⅳ:滴入FeCl3后,可形成带电的胶体,该分散系导电能力增强 12.现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是( ) A.制取氨气时烧瓶中的固体常用CaO或CaCl2 B.将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满 C.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈 D.工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好 13.在如图所示的蓝色石蕊试纸上,X、Y、Z三处分别滴加浓硝酸、浓硫酸和新制的氯水,三处最后呈现的颜色分别是 ( ) A. 白、黑、白 B. 红、黑、红 C. 红、红、白 D. 红、黑、白 14.根据表中信息判断,下列选项正确的是 ( ) 序号 反应物 产物 ① KMnO4,H2O2,H2SO4 K2SO4、MnSO4……… ② Cl2、FeBr2 FeCl3、FeBr3 ③ MnO4-………… Cl2、Mn2+ A.第①组反应的其余产物为H2O B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1 : 2 C.第③组反应中生成1 mol Cl2,转移电子5 mol D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 15.化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中不属于这种情况的是 ( ) A. 常温下,过量的Fe与浓硝酸反应 B. 过量的Cu与浓硫酸反应 C. 过量的Zn与浓硫酸反应 D. 过量的H2与N2在催化剂存在下反应 16.关于化工生产原理的叙述中,不符合目前工业生产实际的是 ( ) A.硫酸工业中,三氧化硫在吸收塔内被水吸收制成浓硫酸 B.炼铁工业中,用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁 C.合成氨工业中,用铁触媒作催化剂,可提高单位时间氨的产量 D.氯碱工业中,电解槽的阴极区产生NaOH 17.在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( ) 方法 现象 结论 A 观察氯水颜色 氯水呈黄绿色 氯水中含Cl2 B 向饱和NaHCO3溶液中加入足量氯水 有无色气体产生 氯水中含HClO C 向红色纸条上滴加氯水 红色纸条褪色 氯水具有漂白性 D 向FeCl2溶液中滴加氯水 溶液变成棕黄色 氯水具有氧化性 18.X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是 A. A B. B C. C D. D 19.下列反应过程中的能量变化与图一致的是 ( ) A. CaCO3CaO+CO2↑ B. C+CO22CO C. 2Al+Fe2O32Fe+Al2O3 D. C+H2OCO+H2 20.不用其他试剂,用最简单的方法鉴别:①NaOH溶液②Mg(NO3)2溶液③FeC13溶液 ④K2SO4溶液,正确的鉴别顺序是 ( ) A. ①②③④ B. ③①②④ C. ④①②③ D. ③④②① 21.等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列图中表示其产生H2的总体积(V)与时间(t)的关系正确的是( ) A. B. C. D. 22.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是 ( ) A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 B. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO2 C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3 具有热不稳定性 D. 按如图装置充分反应后,锥形瓶内有 NO3-存在 23.据最近报道,中国生产的首艘国产航母“山东”号已经下水。为保护航母、延长服役寿命可采用两种电化学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确的是( ) A. 方法1叫外加电流的阴极保护法 B. 方法2叫牺牲阳极的阴极保护法 C. 方法1中金属块可能是锌、锡和铜 D. 方法2中舰体连接电源的负极 24.某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验: ①取少量溶液,加氢氧化钠溶液过程中无沉淀生成; ②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失; ③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.287 g。 下列说法中正确的是 ( ) A.该溶液中一定不含Ba2+、Mg2+、Al3+、SiO32-、Cl- B.该溶液中一定含有K+、AlO2-、CO32-、Cl- C.该溶液是否有K+需做焰色反应实验(透过蓝色钴玻璃片) D.可能含有Cl- 25.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程: 下列说法不正确的是 ( ) A.溶解烧渣选用足量硫酸,试剂X选用铁粉 B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O 26.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和NO2,②NO2和O2,③NO和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( ) A. V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V3>V1>V2 27.NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如下图,下列说法正确的是 ( ) A. 过程1中NH3断裂非极性键 B. NH3催化还原NO为吸热反应 C. 脱硝的总反应为:4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g) D. 过程中NO为氧化剂,Fe2+为还原剂 28.铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是 ( ) A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 C.铜极上的反应是2H++2e﹣═H2↑,O2+4e﹣+4H+═2H2O D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 29.无色的混合气体甲中可能含NO、CO2、NO2、NH3、N2中的几种。将100 mL气体甲经过下图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为 ( ) A. NH3、NO2、N2 B. NH3、NO、CO2 C. NH3、NO2、CO2 D. NO、CO2、N2 30.一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是 ( ) A. 左池的pH值降低 B. 右边为阴离子交换膜 C. 右池电极的反应式:2NO3﹣+10e﹣+12H+=N2↑+6H2O D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气 第II卷(非选择题,40分) 31.(5分)海水中溴含量约为65mg·L-1,从海水中提取溴的工艺流程如下: (1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_______。 (2)步骤Ⅱ通入热空气吹出Br2,利用了溴的__________。 A.氧化性 B.还原性 C.挥发性 D.腐蚀性 (3)步骤Ⅱ中涉及的离子反应如下,请在下面横线上填入适当的化学计量数:_____Br2+_____CO32-=_____ BrO3-+_____Br-+_____CO2↑ (4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。 (5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是__________。 A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯 32.(4分)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它是一种还原剂,能被常见的强氧化剂氧化,但在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题: (1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,可以服用维生素C可解毒。下列叙述不正确的是________(填序号)。 A.亚硝酸盐被还原 B.维生素C是还原剂 C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂 (2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。 A.加入稀盐酸,观察是否有气泡产生 B.加入AgNO3,观察是否有沉淀产生 C.在酸性条件下加入KI-淀粉溶液,观察溶液颜色(I2遇淀粉呈蓝色) (3)某同学把氯气通入到NaNO2溶液中,生成NaNO3和HCl,请写出反应的离子方程式:____________。 33.(10分) 某研究小组用如图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去). (1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 ,操作中不需要的仪器有 (填字母). a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚 (2)通入足量SO2时C中观察到的现象为 。 (3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生了氧化还原反应。 ①写出SO2与FeCl3溶液反应的离子方程式: ; ②请设计实验方案检验有Fe2+生成 ; ③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42−。该做法 (填“合理”或“不合理”),理由是 。 (4)D装置中倒置漏斗的作用是 。 (5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有 (填字母). a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液。 34.(11分)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下: 回答下列问题: (1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。 (2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。 (3)步骤③中选用足量的H2O2,理由是_________________。同时为了防止_________________,溶液要保持pH小于0.5。 (4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。 (5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。 35.(10分)Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。回答下列问题: (1) ①2O2(g)+N2(g)===N2O4(l) ΔH1 ②N2(g)+2H2(g)===N2H4(l) ΔH2 ③O2(g)+2H2(g)===2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1 048.9 kJ·mol-1 上述反应热效应之间的关系式为ΔH4= 。(用ΔH1、ΔH2、ΔH3表示) II.如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。 根据要求回答相关问题: (2) 甲装置中通入________气体的一极为正极。 (3)乙装置中石墨电极为_________极,其电极反应式为_______________;可以用__________________检验该反应产物,电解一段时间后,乙池中的溶液呈_______性。 (4)图中用丙装置模拟工业中的_________________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为___________g。 甘谷一中2019--2020学年高三级四检 化学参考答案 一.选择题(共60分) 1 2 3 4 5 6 7 8 9 10 A B C D D D C C A B 11 12 13 14 15 16 17 18 19 20 B D A B C A B D C B 21 22 23 24 25 26 27 28 29 30 D B D B D D C B B B 二.非选择题(共40分) 31.(5分,每空1分) (1)富集(或浓缩)溴元素 (2)C (3) 3 3 1 5 3 (4)SO2+Br2+2H2O=2HBr+H2SO4 (5)BD 32.(4分,最后1空2分) (1)D (2) B (3)NO2-+Cl2+H2O==NO3-+2H++2Cl- 33.(10分,每空1分) (1)浓盐酸; 抑制氯化铁水解; c、e; (2)溶液由棕黄色变为浅绿色; (3)①2Fe3++SO2+2H2O=SO42−+4H++2Fe2+; ②取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制氯水或过氧化氢,溶液变红;(或加入铁氰化钾,生成蓝色沉淀等,答案合理均可,但不能选择酸性高猛酸钾) ③不合理; 硝酸可以将溶解的SO2氧化为H2SO4,干扰试验; (4)使气体充分吸收,防止溶液倒吸; (5)b、c. 34.(11分) (1)碱煮水洗 (2)加快反应; 热水浴; C (3) 将Fe2+全部氧化为Fe3+;不引入杂质 (2分); 防止Fe3+水解 (4)加热浓缩、冷却结晶、过滤(洗涤)(2分) (5) NH4Fe(SO4)2∙12H2O (2分) 35.(10分) (1)ΔH4=2ΔH3-2ΔH2-ΔH1 (2分) (2) 空气 (3)阳 ; 2Cl--2e-=Cl2↑ ; 湿润的碘化钾淀粉试纸 (或用玻璃棒蘸取浓氨水或湿润的蓝色石蕊试纸或湿润的有色布条等); 碱 (4)粗铜的精炼 0.8 (2分) 查看更多