- 2021-07-02 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
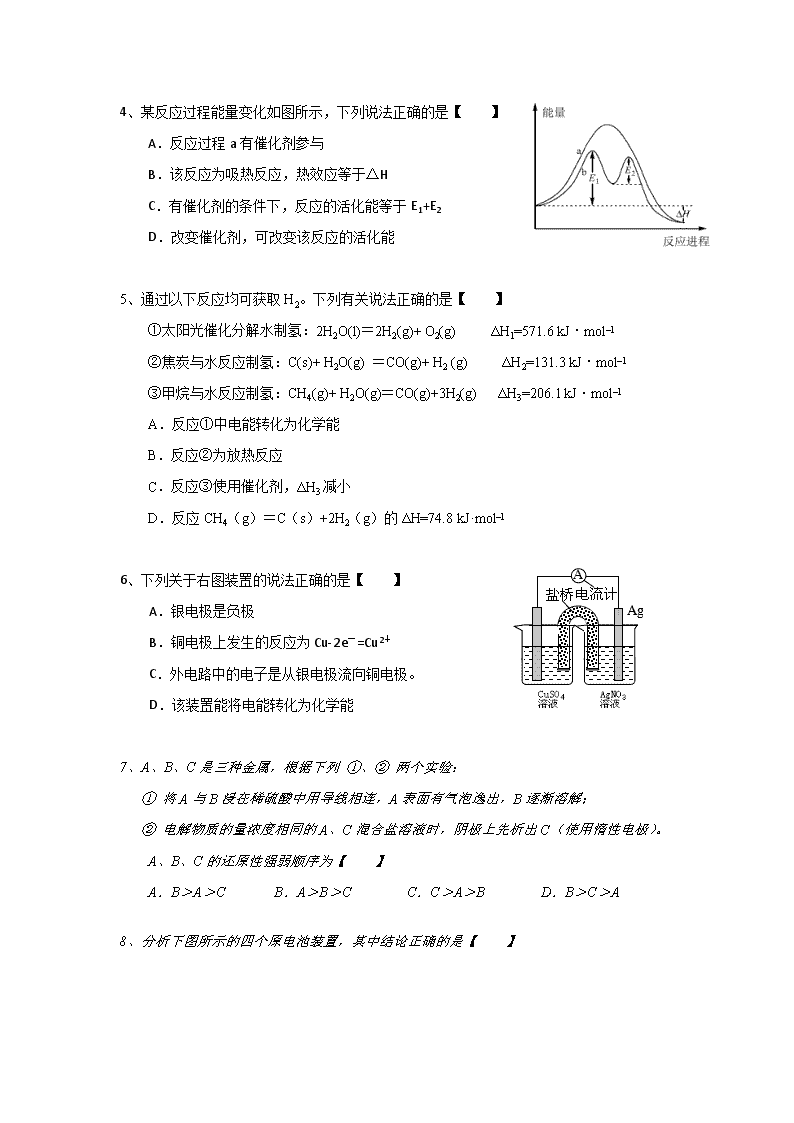
2018-2019学年福建省惠安惠南中学高二上学期期中考试化学试题 Word版
惠南中学2018年秋季期中考试卷 高二化学(理科) 命题者:陈晓彬 考试时间:90分钟 满分:100分 2018.11.6 可能用到的相对原子质量: H:1 C:12 O:16 Na:23 Cu:64 Ag:108 第Ⅰ卷(选择题 共48分) 一.选择题(共24小题,每小题2分,共48分,每小题只有一个正确选项) 1、2015年2月28日,央视原记者柴静及其团队制作的视频《穹顶之下》引起了人们对环 境保护的再思考,下列说法体现人与自然和谐相处的是【 】 A.将聚氯乙烯等塑料垃圾焚烧 B.推广矿物燃料脱硫技术以减少SO2等有害气体的排放 C.大力开采石油、煤、页岩气(主要成分为CH4)等化石燃料 D.电池使用后随意丢弃,无需处理 2、下列热化学方程式书写正确的是(△H的绝对值均正确)【 】 A.C2H5OH(l) +3O2(g) =2CO2(g) +3H2O(g) △H=-1367.0 kJ·mol-1(标准燃烧热) B.NaOH(aq)+HCl(aq)=NaCl(aq) +H2O(l) △H= +57.3 kJ·mol-1(中和热) C.S(s) +O2(g) SO2(g) △H= —269.8 kJ·mol-1 D.2NO2=O2+2NO △H=+116.2 kJ·mol-1 3、已知25 C、101 kPa下,下列反应: C(石墨)+O2(g) = CO2 (g) △H=—393.51 kJ·mol-1 C(金刚石)+ O2(g) =CO2(g) △H=—395.41 kJ·mol-1 可以得出的结论是【 】 A.金刚石比石墨稳定 B.1mol石墨所具有的能量比1mol金刚石低 C.金刚石转变成石墨是物理变化 D.石墨和金刚石都是碳的同位素 4、某反应过程能量变化如图所示,下列说法正确的是【 】 A.反应过程a有催化剂参与 B.该反应为吸热反应,热效应等于△H C.有催化剂的条件下,反应的活化能等于E1+E2 D.改变催化剂,可改变该反应的活化能 5、通过以下反应均可获取H2。下列有关说法正确的是【 】 ①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6 kJ·mol–1 ②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2 (g) ΔH2=131.3 kJ·mol–1 ③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=206.1 kJ·mol–1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8 kJ·mol–1 6、下列关于右图装置的说法正确的是【 】 A.银电极是负极 B.铜电极上发生的反应为Cu-2e-=Cu2+ C.外电路中的电子是从银电极流向铜电极。 D.该装置能将电能转化为化学能 7、A、B、C是三种金属,根据下列 ①、② 两个实验: ① 将A与B浸在稀硫酸中用导线相连,A表面有气泡逸出,B逐渐溶解; ② 电解物质的量浓度相同的A、C混合盐溶液时,阴极上先析出C(使用惰性电极)。 A、B、C的还原性强弱顺序为【 】 A.B>A>C B.A>B>C C.C>A>B D.B>C>A 8、分析下图所示的四个原电池装置,其中结论正确的是【 】 A.①②中Mg作负极,③④中Fe作负极 B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑ C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+ D.④中Cu作正极,电极反应式为2H++2e-===H2↑ 9、甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图。 下列有关叙述不正确的是【 】 A.H +从负极区通过交换膜移向正极区 B.电池总反应为2CH3OH+3O2===2CO2+4H2O C.负极的电极反应式为: CH3OH+ H2O-6e-=CO2↑+ 6H + D.图中b、c分别是O2、甲醇 10、高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为: 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是 A.放电时负极反应为:Zn-2e—+2OH-= Zn(OH)2 B.充电时阳极发生氧化反应,OH—向阴极附近 C.充电时每转移3mol电子,阴极有1.5molZn生成 D.放电时正极反应为:FeO42— + 3e— + 4H2O = Fe(OH)3 + 5OH— 11、用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是【 】 A.a端是直流电源的负极 B.通电使CuCl2发生电离 C.阳极上发生的反应:Cu2++2e– = Cu D.通电一段时间后,在阴极附近观察到黄绿色气体 12、在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,下列电解质中 不适宜加入的是【 】 A.KI B.KNO3 C.H2SO4 D.NaOH 13、下列图示中关于铜电极的连接错误的是【 】 14、某学生欲完成2HCl+2Ag=2AgCl+H2↑反应,设计了如图所示的四个实验,你认为可 行的实验是【 】 15.将含有0.4 mol Cu(NO3)2和0.4 mol KCl的水溶液1 L,用惰性电极电解一段时间后, 在一电极上析出19.2 g Cu;此时,在另一电极上放出气体的体积(标况)为【 】 A.3.36 L B.5.6 L C.6.72 L D.13.44 L 16、将右图所示实验装置的K闭合,下列判断正确 的是【 】 A.Cu电极上发生还原反应 B.电子沿Zn→a→b→Cu路径流动 C.盐桥中K+向移向ZnSO4溶液 D.片刻后可观察到滤纸b点变红色 17、右图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀醋酸,各加入生铁 块,放置一段时间。下列有关描述错误的是【 】 A.生铁块中的碳是原电池的正极 B.两试管中相同的电极反应式是:Fe-2e- = Fe2+ C.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 D.红墨水柱两边的液面变为左低右高 18、如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中, 下列分析正确的是【 】 A.K1闭合,铁棒上发生的反应为2H++2e=H2↑ B.K1闭合,石墨棒周围溶液pH逐渐升高 C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 D.K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol 气体 19.在2L密闭容器中,发生3A(g)+B(g) 2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是【 】 A.1.6 mol B.2.8 mol C.3.2 mol D.3.6 mol 20、以下说法中正确的是【 】 A.△H<0的反应均是自发反应 B.△S为负值的反应均不能自发进行 C.冰在室温下自动熔化成水,是熵增的重要结果 D.高锰酸钾加热分解是一个熵减小的过程 21、下列指定反应的离子方程式正确的是【 】 A.将铜插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+ C.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+ D.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 班级 座号 姓名 准考证号 流水号 密 封 线 内 不 得 答 题 惠南中学2018年秋季期中考试卷 高二化学(理科) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案 题号 21 22 23 24 答案 22、设NA为阿伏加德罗常数的数值,下列说法正确的是【 】 A.23 g Na与足量H2O反应完全后可生成NA个H2分子 B.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子 C.标准状况下,22.4 L N2和H2混合气体中含NA个原子 D.3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 23、短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。 已知Y、W的原子序数之和是Z的3倍,下列 说法正确的是【 】 A.原子半径:X查看更多