- 2021-07-02 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
甘肃省甘南藏族自治州合作第一中学2019-2020学年高一上学期9月月考化学试题
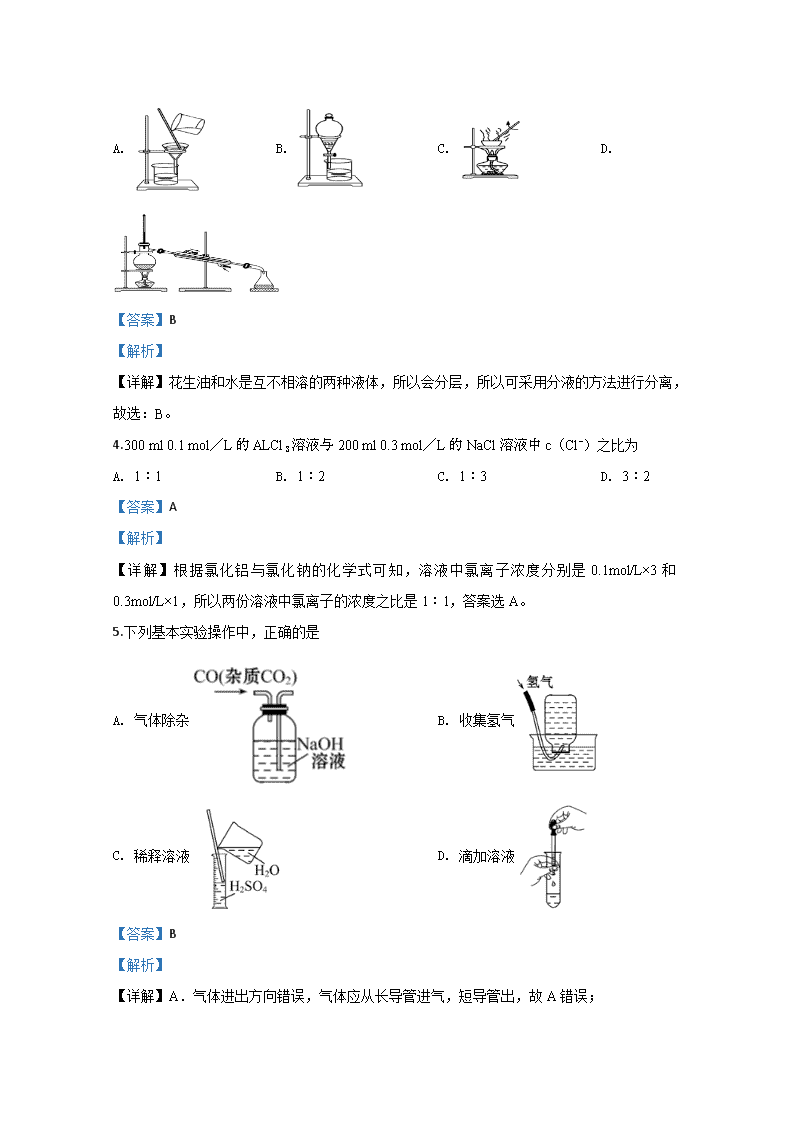
甘肃省甘南藏族自治州合作一中2019-2020学年高一上学期9月月考 化学试题 1.盛放浓硫酸的试剂瓶贴图中最合适的标志是( ) A. B. C. D. 【答案】D 【解析】 【详解】浓硫酸具有强烈的腐蚀性,所以属于腐蚀性药品,合理选项是D。 2.下列有关实验室一般事故预防和处理方法正确的是 A. 燃着的酒精灯打翻失火,应立即用水浇灭 B. 皮肤上沾有少量浓硫酸,应立即用大量水冲洗,再涂上NaHCO3溶液 C. 制取并用排水法收集氧气结束后,应立即停止加热 D 蒸发溶液时有液滴飞溅,应立即加水冷却 【答案】B 【解析】 【详解】A.酒精为液体,用水浇灭会使酒精扩散,火势更不容易控制,故A错误; B.皮肤上沾有少量浓硫酸,应立即用大量水冲洗,最后再涂上3%~5%的小苏打溶液,故B正确; C.采用排水法收集氧气的实验结束时,为防止水倒吸进入试管,引起试管炸裂,要先从水槽中撤出导气管,再熄灭酒精灯,故C错误; D.蒸发溶液时,发生液滴飞溅时,应用玻璃棒进行搅拌,而不应加水进行冷却,故D错误; 故答案为B。 3.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是 A. B. C. D. 【答案】B 【解析】 【详解】花生油和水是互不相溶的两种液体,所以会分层,所以可采用分液的方法进行分离,故选:B。 4.300 ml 0.1 mol/L的ALCl3溶液与200 ml 0.3 mol/L的NaCl溶液中c(Cl-)之比为 A. 1:1 B. 1:2 C. 1:3 D. 3:2 【答案】A 【解析】 【详解】根据氯化铝与氯化钠的化学式可知,溶液中氯离子浓度分别是0.1mol/L×3和0.3mol/L×1,所以两份溶液中氯离子的浓度之比是1︰1,答案选A。 5.下列基本实验操作中,正确的是 A. 气体除杂 B. 收集氢气 C. 稀释溶液 D. 滴加溶液 【答案】B 【解析】 【详解】A.气体进出方向错误,气体应从长导管进气,短导管出,故A错误; B.氢气难溶于水,可用排水法收集,故B正确; C.量筒只能用于量取液体的体积,不能在量筒中稀释溶液,且应将浓硫酸倒入水中进行稀释,故C错误; D.胶头滴管应垂直悬空,不能插入到试管中,防止胶头滴管放回试剂瓶时污染药品,故D错误; 故选:B。 6.下列各项操作错误是( ) A. 用酒精萃取溴水中溴单质的操作可选用分液漏斗,而后静置分液 B. 进行分液时,分液漏斗中下层液体从下口流出,上层液体则从上口倒出 C. 萃取、分液前需对分液漏斗检漏 D. 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下(或使塞上的凹槽对准漏斗上的小孔) 【答案】A 【解析】 【详解】A.酒精和水是互溶的,不能做萃取剂来萃取溴水中的溴单质,可以用四氯化碳来萃取,故A错误; B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,避免两种液体相互污染,故B正确; C.分液漏斗使用前要先检查是否漏液,故C正确; D.打开塞子(或使塞上的凹槽对准漏斗上的小孔)使漏斗内外压强相等,保证液体顺利流出,故D正确; 答案选A。 7.能够用来鉴别BaCl2 、NaCl 、Na2CO3三种物质的试剂是 A. AgNO3溶液 B. 稀盐酸 C. 稀硫酸 D. 稀硝酸 【答案】C 【解析】 【详解】A.BaCl2、NaCl、Na2CO3与AgNO3溶液反应都生成沉淀,无法鉴别,故A错误; B.稀盐酸和BaCl2、NaCl不反应,无法鉴别BaCl2、NaCl,故B错误; C.稀硫酸与BaCl2反应生成沉淀,稀硫酸与Na2CO3反应生成气体,稀硫酸与不NaCl反应,现象不同,可鉴别,故C正确; D.稀硝酸与BaCl2、NaCl不反应,无法鉴别BaCl2、NaCl,故D错误; 故答案为C。 8.下列物质中,摩尔质量最大的是( ) A. 10mL水 B. 0.8mol硫酸 C. 54g铝 D. 1g碳酸钙 【答案】D 【解析】 【详解】水的摩尔质量为18g/mol,硫酸的摩尔质量为98 g/mol,铝的摩尔质量为27 g/mol,碳酸钙的摩尔质量为100 g/mol,碳酸钙的摩尔质量最大, 故选:D。 9.在使用容量瓶配制溶液时,下列操作正确的是 A. 使用容量瓶前必须检查容量瓶是否漏水 B. 容量瓶用蒸馏水洗净后,再用待配溶液润洗 C. 称好的固体试样需用纸条小心地送入容量瓶中 D. 摇匀后发现凹液面下降,再加水至刻度线 【答案】A 【解析】 【详解】A.容量瓶带有瓶塞,所以使用前必须检查是否漏水,A正确; B.容量瓶用蒸馏水洗净后,再用待配溶液润洗,导致溶质的物质的量偏大,依据c=n÷V可知,溶液浓度偏高,B错误; C.容量瓶为精密仪器,不能用来溶解固体,C错误; D.摇匀后发现凹液面下降,再加水至刻度线,导致溶液体积偏大,依据c=n÷V可知,溶液浓度偏低,D错误; 答案选A。 【点睛】本题考查了一定物质的量浓度溶液的配制,明确配制原理和容量瓶使用方法及注意事项是解题的关键,选项B是解答的易错点。 10.常温常压下,用等质量CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是 A. B. C. D. 【答案】D 【解析】 【详解】,,气体体积与摩尔质量成反比,甲烷的摩尔质量最小,因此气体体积最大,故D正确。 综上所述,答案为D。 【点睛】依据阿伏伽德罗规律的推论可知,同问同压下,气体的体积之比等于气体的物质的量之比,通过上述等质量的四种气体,比较其物质的量大小顺序也可以做出解答。 11.用NA表示阿伏加德罗常数,下列叙述正确的是 A. 标准状况下,22.4 L H2O含有的分子数为NA B. 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA C. 通常状况下,NA个CO2分子占有的体积为22.4 L D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1 【答案】B 【解析】 【详解】A.标况下水为液体,22.4 L H2O的物质的量不是1mol,故A错误; B.1.06g碳酸钠的物质的量为=0.01mol,所含钠离子数目为0.02NA,故B正确; C.通常状况下,气体摩尔体积大于22.4L/mol,故NA个二氧化碳分子即1mol二氧化碳的体积大于22.4L,故C错误; D.溶液体积未知,无法确定溶液中所含微粒数目,故D错误; 故答案为B。 【点睛】在使用22.4L/mol进行计算时要注意看题目所给条件是否为标况,若为标况所给物质是否是气体。 12.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序是 ①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 A. ①④①②⑤③ B. ①②⑤④①③ C. ①②④⑤③ D. ④②⑤ 【答案】B 【解析】 【详解】由于泥沙不溶于水,则将粗盐溶于水,首先过滤得到滤液。又因为不能引入新杂质,则Ca2+用Na2CO3除去,Mg2+用NaOH除去,SO42-用BaCl2除去,因为所加除杂试剂都是过量,因此Na2CO3另一个作用是除去过量的BaCl2,即Na2CO3放在BaCl2的后面,然后过滤,向所得滤液中再加入盐酸除去过量的Na2CO3和NaOH即可,因此顺序可以是①②⑤④①③或①⑤②④①③或①⑤④②①③。答案选B。 13.选择下列一种方法分离物质,将分离方法的序号填在横线上. A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤 (1)从溴水中提取溴______ (2)分离饱和食盐水与沙子的混合物______ (3)分离水和汽油的混合物______ (4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体______. 【答案】 (1). A (2). F (3). D (4). E 【解析】 【详解】(1)溴更易溶于有机溶剂,则选萃取分液法从溴水中提取溴,所以选A; (2)沙子为不溶性杂质,在饱和食盐水中形成沉淀,可用过滤方法分离,所以选F; (3)水和汽油不互溶,二者会分层,可用分液的方法的分离,所以选D; (4)分离互溶的两种沸点差异较大的液体混合物可用蒸馏,所以选E。 14.(1)已知氨气的化学式是NH3,其摩尔质量为____;6.8g NH3的物质的量为___mol,其标准状况下的体积为___L,其含NH3分子的个数为___,含有氢原子的个数为_____。 (2)在①、②、③、④处的横线上填上适当的内容。______、__________、______、__________ (3)12.4 g Na2R含0.4 mol Na+,则Na2R的摩尔质量为________。 【答案】 (1). 17g/mol (2). 0.4mol (3). 8.96 (4). 2.408×1023(0.4NA) (5). 7.224×1023(1.2NA) (6). 2NA或1.204×1024 (7). 120 g (8). 2 (9). 8 (10). 62 g·mol-1 【解析】 【详解】(1)N的相对原子质量为14,H的相对原子质量为1,所以NH3摩尔质量为17g/mol;6.8g NH3的物质的量为;标况下的体积为0.4mol×22.4L/mol=8.96L;含NH3分子的个数为2.408×1023(或0.4NA),含氢原子物质的量为0.4mol×3=1.2mol,所以个数为7.224×1023(或1.2NA); (2)2molCO(NH2)2的分子数为2 NA或1.204×1024;其质量为2mol×60g/mol=120 g;含2molO,8molH; (3)12.4 g Na2R含0.4 mol Na+,则其物质的量为0.2mol,所以其摩尔质量为。 【点睛】学生注意掌握以物质的量为核心的公式换算。 15.如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。 (1)图中有两处明显的错误是:①_____________;②____________。 (2)A仪器的名称是______________,B仪器的名称是______________。 (3)实验时A中除加入少量自来水外,还需要加入少量的____,其作用是_______。 【答案】 (1). 冷却水下口进,上口出 (2). 温度计水银球应位于蒸馏瓶支管口处 (3). 蒸馏烧瓶 (4). 直型冷凝管 (5). 沸石/碎瓷片 (6). 防止暴沸 【解析】 【分析】 实验室用自来水制取蒸馏水用蒸馏的方法制备,蒸馏时用到蒸馏烧瓶、酒精灯、冷凝管、牛角管、锥形瓶等仪器,注意温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用。 【详解】(1)温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,故答案为:冷凝水方向;温度计位置错误; (2)由仪器的结构可知,A为蒸馏烧瓶,B为直型冷凝管,故答案为:蒸馏烧瓶;直型冷凝管; (3)为防止液体暴沸,应加碎瓷片,故答案为:加沸石(或碎瓷片);防止暴沸。 16.实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。 (1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。 (2)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.3 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.3 mol/L。 (3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_______mL(计算结果保留一位小数)。 【答案】 (1). AC (2). 烧杯、玻璃棒 (3). 6.0 (4). 小于 (5). 小于 (6). 13.6 【解析】 【详解】(1)配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀等,用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,所以用不到的图示仪器有平底烧瓶和分液漏斗,即AC;还需要的玻璃仪器为:烧杯、玻璃棒; (2)需要0.3mol/LNaOH溶液480mL,应选择500mL容量瓶,需要溶质的质量:0.3mol/L×0.5L×40g/mol=6.0g;定容时仰视刻度线,导致溶液体积偏大,依据可知溶液浓度偏低;若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的物质的量减少,则所得溶液浓度小于0.3 mol/L; (3)质量分数为98%、密度为1.84 g/cm3的浓硫酸的物质的量浓度为c=mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×1.0mol/L,解得:x≈13.6。 【点睛】已知某溶液的质量分数ω和密度ρ,则其物质的量浓度c=;配制一定物质的量浓度的溶液时,若溶质为固体,则计算称量相应质量的溶质,若溶质为液体,则计算量取相应体积的溶质。查看更多