- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年广东省实验中学高二上学期期末考试化学理试题(Word版)
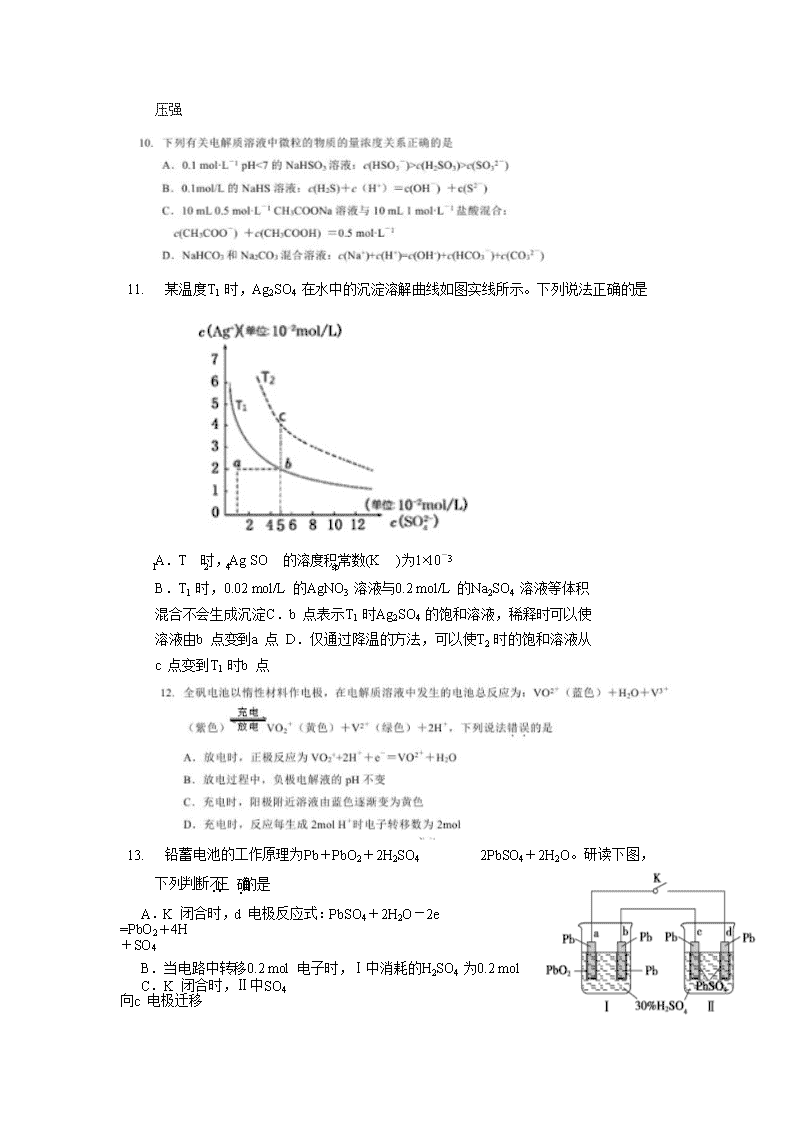
2017-2018学年广东省实验中学高二上学期期末考试 理 科 化 学 命题:林加明 审定:韩世瑞 校对:林加明 本试卷分选择题和非选择题两部分,共 6 页,满分 100 分,考试用时 60 分钟。 注意:选择题答案必须用 2B 铅笔在答题卡对应题号答题框内填涂,非选择题需在问卷指定位置作答。 可能用到的相对原子质量 H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 Fe 56 Cu 64 第Ⅰ卷(选择题共 52 分) 一、选择题(本题包括 13 小题,每小题只.有.一.个.选.项.符合题意,每小题 4 分,共 52 分) 1. 下列说法中正确的是 A.在船体上镶嵌铜块,可以减缓船体被海水腐蚀的速率 B.铁钉在氯化钠溶液中生锈,属于吸氧腐蚀 C.粗铜精炼时,电解液中的 c(Cu2+)保持不变 D.白铁(镀锌)表面破损后,铁腐蚀更快 2. 下列依据热化学方程式得出的结论正确的是 热化学方程式 结 论 A 2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ/mol H2 的燃烧热为 483.6kJ/mol B OH- (aq)+H+ (aq)=H2O(l) ΔH=-57.3 kJ/mol 含 1mol NaOH 的稀溶液与浓 H2SO4 完全中和,放出的热量小于 57.3kJ C 2C(s)+2O2(g)=2CO2(g) ΔH=-a kJ/mol 2C(s)+O2(g)=2CO(g) ΔH=-b kJ/mol b <a D C (石墨,s)=C (金刚石,s) ΔH=+1.5 kJ/mol 金刚石比石墨稳定 3. 某温度下,在恒容的密闭容器中进行可逆反应:X(g)+Y(g) 述正确的是 Z(g)+W(s) △ H>0,下列叙 A.加入少量 W,逆反应速率增大 B.升高温度,平衡逆向移动 C.当容器中气体压强不变时,反应达到平衡 D.通入稀有气体,平衡向正反应方向移动 4. 下列有关说法正确的是 A.为了加快产生 H2 速率,可向稀硫酸中滴加少量 Cu(NO3)2 溶液与锌反应 B.为处理锅炉水垢中的 CaSO4,可先用饱和 Na2CO3 溶液浸泡,再加入盐酸溶解 C.可用电解熔融 AlCl3 的方法获得金属铝 D.将 FeCl3 溶液加热蒸干并灼烧,最终可得到无水 FeCl3 5. 若要配制 1 mol·L-1 的稀硫酸标准溶液,并用其滴定某未知浓度的 NaOH 溶液。 下列有关说法错.误.的是 A.实验中用到的滴定管和容量瓶在使用前都需要检漏 B.如果实验需用 85 mL 的稀硫酸标准溶液,配制时应选用 100 mL 容量瓶 C.用甲基橙作指示剂,滴定终点时,溶液颜色从红色变为橙色 D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的 NaOH 溶液的浓度将偏大 6. 用石墨电极电解 CuSO4 溶液一段时间后,向所得溶液中加入 0.1molCu2(OH)2CO3 后,恰好使溶液 恢复到电解前的浓度,则电解过程中转移的电子的物质的量 A.0.6mol B.0.2mol C.0.4mol D.0.5mol 7. 室温下,向 10mL 0.1 mol·L﹣1NaOH 溶液中加入 0.1mol·L﹣1 的一元酸 HA,测得溶液 pH 的变化曲 线如图所示,下列说法正确的是 A.a 点所示溶液中 c(Na+)>c(A-)>c(HA)>c(OH-) B.a、b 两点所示溶液中水的电离程度 a<b C.pH=7 时,c(Na+)=c(A-)+c(HA) D.b 点所示溶液中 c(A-)>c(HA) A.图甲表示用 0.10 mol·L-1 NaOH 溶液滴定 20.00 mL 0.10 mol·L-1 醋酸溶液的滴定曲线 B.由乙可知:对于恒温恒容条件下的反应 2NO2(g) N2O4(g),A 点为平衡状态 C.由丙可知:同温度、同浓度的 NaA 溶液与 NaB 溶液相比,其 pH 前者小于后者 D.图丁表示反应 2SO2+O2 2SO3,t1 时刻减小了 压强 11. 某温度 T1 时,Ag2SO4 在水中的沉淀溶解曲线如图实线所示。下列说法正确的是 1 2 4 sp A.T 时,Ag SO 的溶度积常数(K )为 1×10-3 B.T1 时,0.02 mol/L 的 AgNO3 溶液与 0.2 mol/L 的 Na2SO4 溶液等体积混合不会生成沉淀 C.b 点表示 T1 时 Ag2SO4 的饱和溶液,稀释时可以使溶液由 b 点变到 a 点 D.仅通过降温的方法,可以使 T2 时的饱和溶液从 c 点变到 T1 时 b 点 13. 铅蓄电池的工作原理为 Pb+PbO2+2H2SO4 2PbSO4+2H2O。研读下图,下列判断不.正. 确.的是 A.K 闭合时,d 电极反应式:PbSO4+2H2O-2e =PbO2+4H +SO4 B.当电路中转移 0.2 mol 电子时,Ⅰ中消耗的 H2SO4 为 0.2 mol C.K 闭合时,Ⅱ中 SO4 向 c 电极迁移 D.K 闭合一段时间后,Ⅱ可单独作为原电池,d 电极为正极 第 II 卷(非选择题共 48 分) ① 由图可知:p1、p2、p3 的大小关系为 ,理由是 。 ② A、B 点生成氨气的速率大小关系为 VA VB (填“>”、“=”或“<”)。B、C 点,合成氨反应 的化学平衡常数大小关系为 KB Kc (填“>”=”或“<”),C 点,N2 的转化率为 。 (计算结果保留小数点后 1 位) (3) 下列措施能用勒夏特列原理解释是 (填序号)。 a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨 c.生产中需要升高温度至 500°C 左右 d.需要使用过量的 N2,提高 H2 转化率 16. (12 分)二甲醚(CH3OCH3)被称为 21 世纪的新型燃料,它清洁、高效、具有优良的环保性能,二 甲醚是种无色气体,具有轻微的醚香味,二甲醚可作燃料电池的燃料。 (1) 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。请写出该电池 中负极上的 电极反应式是: 。 (2) 用(1)中的燃料电池为电源,以石墨为电极电解 500mLNaCl 溶液,装置如图甲所示。 ① 请写出电解过程中总反应的离子方程式 。 ② 当燃料电池消耗 2.8LO2 (标准状况下)时,计算此时:NaCl 溶液中 C(OH-)= mol/L (假设溶液的体积不变,气体全部从溶液中逸出)。 ③ 电解之后,要使溶液恢复原状,应该向溶液中加入物质 (填名称)。 (3) 用(1)中的燃料电池为电源,用离子交换膜控制电解液中 c(OH-)制备纳米 Cu2O,其装置如图乙所 示。 图甲 图乙 ① 上述装置中 D 电极应连接二甲醚燃料电池的 (填“正极”或“负极”),该电解池中离子交换 膜为 离子交换膜(填“阴”或“阳”)。 ② 该电解池的阳极反应式为 。 17. (13 分)某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料 来制备 NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有 Ni,还含有 Al(31%)、Fe(1.3%) 的单质及氧化物,其他不溶杂质(3.3%)。 部分阳离子以氢氧化物形式沉淀时的 pH 如下表所示: 沉淀物 开始沉淀时的 pH 完全沉淀时的 pH Al(OH)3 3.8 5.2 Fe(OH)3 2.7 3.2 Fe(OH)2 7.6 9.7 Ni(OH)2 7.1 9.2 (1) 加入 H2O2 时发生反应的离子方程式 。 (2) 操作 b 为调节溶液的 pH,你认为 pH 的调控范围是 。 (3) 产品晶体中混有少量绿矾(FeSO4·7H2O),其原因可能是 (写出一点即可) 。 为了测定产品的纯度,某同学称取 50 克该产品晶体配成 100mL 溶液,取 20mL 该溶液于锥形瓶 中,然后用 0.1mol/L 的酸性 KMnO4 标准液滴定,直到 为 止,重复以上操作两次,消耗酸性 KMnO4 溶液体积的平均值为 10mL(Ni2+不被氧化),则该产 品晶体的纯度是 。(结果保留 3 位有效数字)(FeSO4 • 7H2O 的摩尔质量为 278g/mol) (4) NiSO4•7H2O 可用于制备镍氢电池(NiMH),NiMH 中的 M 表示储氢金属或合金。该电池在充电过 程中总反应的化学方程式是 Ni(OH)2+MNiOOH+MH,则 NiMH 电池放电过程中正极的电极 反应式为 。 广东实验中学 2017—2018 学年(上)期末考试 高二级化学 参考答案 第Ⅰ部分 选择题(共 52 分) 一、选择题(本题包括 13 小题,每小题 4 分,共 52 分。每小题只有一个选项符合题意) 题号 1 2 3 4 5 6 7 答案 B C C B C A D 题号 8 9 10 11 12 13 答案 D C B B D C 第 II 部分 非选择题(共 48 分) 14. (9 分)(1)HCO3 +H2O H2CO3+OH (2 分) (2)10-5mol/L(2 分) (3) AlCl3 饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq) +3Cl—(aq) +6H2O(l),通入 HCl 气体使溶液中 c(Cl—)增大,平衡向析出固体的方向移动从而析出 AlCl3 晶体。(3 分) (4) 6(2 分) 15. (14 分)每空 2 分 (1)a+b/2-3c/2 kJ/mol (2)①p1>p2>p3 相同温度下,p1 到 p3 氨的体积分数降低,说明平衡左移,压强减小 ②vA查看更多
相关文章
- 当前文档收益归属上传用户