- 2021-07-02 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021年高考化学一轮复习第八单元 化学反应与能量测试题
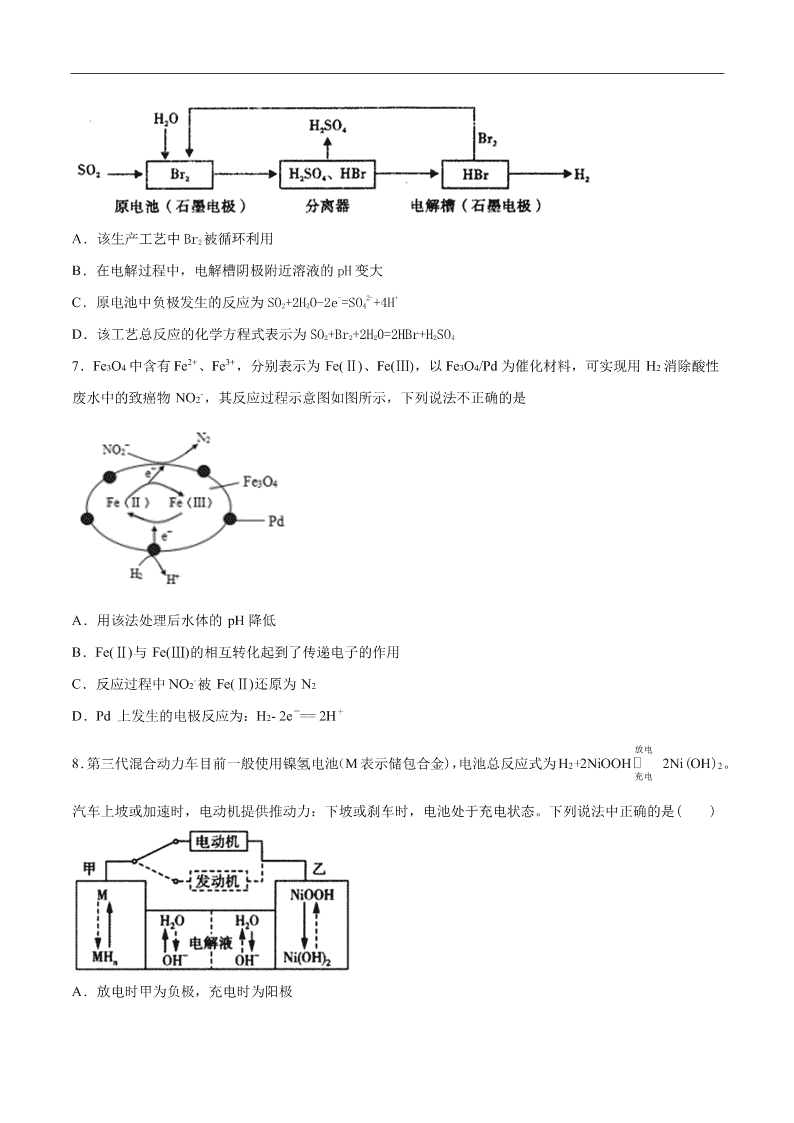
2020-2021 年高考化学一轮复习第八单元 化学反应与能量测试题 1.已知分解 1molH2O2 放出热最 98kJ,在含少量 I-的溶液中,H2O2 分解的机理为: 反应Ⅰ:H2O2(aq)+I-(aq)→H2O(l)+IO-(aq) 慢反应 ΔH1 反应Ⅱ:H2O2(aq)+IO-(aq)→H2O(l)+O2(g)+I-(aq) 快反应 ΔH2 下列有关该反应的说法正确的是( ) A.H2O2 分解产生 O2 的速率反应Ⅱ决定 B.I-和 IO-在反应过程中充当催化剂 C.ΔH1+ΔH2=−196 kJ·mol−1 D.反应Ⅰ活化能 Ea1 与反应Ⅱ活化能 Ea2 数值上相差 98kJ/mol 2.某金属有机多孔材料( MOFA )在常温常压下具有超高的 CO2 吸附能力,并能高效催化 CO2 和 的 反应,其工作原理如图所示。下列说法错误的是 A.该过程中 N2 没有参与化学反应 B.CO2 和 反应的过程中有极性共价键形成 C.该方法的广泛使用有助于减少 CO2 的排放 D.可通过升温进一步提高催化效率 3.为落实“五水共治”,某工厂拟综合处理含 + 4NH 废水和工业废气(主要含 N2、CO2、SO2、NO、CO,不考 虑其他成分),设计了如下流程: 已知:1 mol CO 和 1 mol CH3OH 分别完全燃烧生成 CO2(g)和 H2O(l),放出的热量为 283.0kJ 和 726.5kJ。下 列说法错误的是 A.固体 1 中主要含有 Ca(OH)2、CaCO3、CaSO3 B.气体 X 在流程中体现还原性 C.相同质量的 CO 和 CH3OH 完全燃烧,后者放出的热量多 D.处理含 + 4NH 废水时,发生反应的离子方程式为: + - 2NO =N2↑+2H2O 4.据文献报道:Fe(CO)5 催化某反应的一种反应机理如下图所示。下列叙述错误的是 A.OH-参与了该催化循环 B.该反应可产生清洁燃料 H2 C.该反应可消耗温室气体 CO2 D.该催化循环中 Fe 的成键数目发生变化 5.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、 - 3NO 等 共存物的存在会影响水体修复效果,定义单位时间内 ZVI 释放电子的物质的量为 nt,其中用于有效腐蚀的 电子的物质的量 ne。下列说法错误的是 A.反应①②③④均在正极发生 B.④的电极反应式为 +10H++8e-= +3H2O C.单位时间内,三氯乙烯脱去 amolCl 时 ne=amol D.增大单位体积水体中小微粒 ZVI 的投入量,可使 nt 增大 6.以 SO2 为原料,通过下列工艺可制备化工原料 H2SO4 和清洁能源 H2。下列说法中不正确的是 A.该生产工艺中 Br2 被循环利用 B.在电解过程中,电解槽阴极附近溶液的 pH 变大 C.原电池中负极发生的反应为 SO2+2H2O-2e-=SO4 2-+4H+ D.该工艺总反应的化学方程式表示为 SO2+Br2+2H20=2HBr+H2SO4 7.Fe3O4 中含有 Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以 Fe3O4/Pd 为催化材料,可实现用 H2 消除酸性 废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是 A.用该法处理后水体的 pH 降低 B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用 C.反应过程中 NO2-被 Fe(Ⅱ)还原为 N2 D.Pd 上发生的电极反应为:H2- 2e-== 2H+ 8.第三代混合动力车目前一般使用镍氢电池(M表示储包合金),电池总反应式为 H2+2NiOOH 放电 充电 2Ni(OH)2。 汽车上坡或加速时,电动机提供推动力:下坡或刹车时,电池处于充电状态。下列说法中正确的是( ) A.放电时甲为负极,充电时为阳极 B.汽车上坡时发生图中虚线所示的过程 C.汽车下坡电流的方向为:甲电极→发动机→乙电极 D.汽车下坡时,甲电极周围溶液的 pH 减小 9.电-Fenton 法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的 H2O2 与 Fe2+ 发生 Fenton 反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法正确的是 A.电源的 A 极为正极 B.与电源 B 相连电极的电极反应式为 H2O+e-=H++·OH C.Fenton 反应为:H2O2+Fe2+=Fe(OH)2++·OH D.每消耗 22.4LO2(标准状况),整个电解池中理论上可产生的·OH 为 2mol 10.如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲 醇厂进行联合生产。其主要生产工艺如下:(FeTiO3 中 Ti 为+4 价) 下列叙述正确的是( ) A.该流程中只有“电解”、“氯化”涉及氧化还原反应 B.“合成”反应中氧化剂与还原剂的物质的量之比为 1:1 C.“氯化”时反应方程式为 7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO(条件省略) D.上述流程中“Mg,Ar"可用“Mg,CO2”代替 11.以 PbO 为原料回收铅的过程如下: Ⅰ.将 PbO 溶解在 HCl 和 NaCl 的混合溶液中,得到含 Na2PbC14 的溶液; Ⅱ.电解 Na2PbCl4 溶液后生成 Pb,原理如图所示。 下列判断不正确的是 A.阳极区的溶质主要是 H2SO4 B.电极Ⅱ的电极反应式为 PbCl42—+2e—=Pb+4Cl— C.当有 2. 07 g Pb 生成时,通过阳离子交换膜的阳离子为 0.04 mol D.电解过程中为了实现物质的循环利用,可向阴极区补充 PbO 12.2019 年 6 月 6 日,工信部正式向四大运营商颁发了 5G 商用牌照,揭示了我国 5G 元年的起点。通信用 磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电 池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为 M1-xFexPO4+e-+Li+=LiM1-xFexPO4, 其原理如图所示,下列说法正确的是( ) A.放电时,电流由石墨电极流向磷酸铁锂电极 B.充电时,Li+移向磷酸铁锂电极 C.放电时,负极反应式为 LiC6-e-=Li++6C D.电池总反应为 M1-xFexPO4+LiC6 LiM1-xFexPO4+6C 13.某小组同学用下图所示装置制取氨气 ,并探究其性质。 (1)上图试管中发生反应的化学方程式是____________________ 。 (2)请将上图方框中的收集装置补充完整__________________。 (3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。 (4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的 A、B 处,可观察到的现象是 ___________________。 (5)将上图反应后试管中固体溶于水得到溶液 a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶 液 a 含有 + 4NH 。 (6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2 在催化剂表面合成氨的微观历程及能最变化的示 意图如下 ,用 )分别表示 N2 、H2 、NH3 已知工业合成氨:N2(气)+ 3 H2(气) 2NH3 ( 气)是一个放热..反应下列说法正确的是 ___。 a.使用催化剂,可以加快合成氨的反应速率 b.②→③过程,是吸热过程且只有 H - H 键的断裂 c.③→④过程,N 原 子和 H 原子形成了含有极性键的 NH3 d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 14.用零价铁(Fe)去除水体中的硝酸盐(NO3 -)已成为环境修复研究的热点之一。 (1)Fe 还原水体中 NO3 -的反应原理如图 1 所示。 ①作负极的物质化学式为___________。 ②正极的电极反应式是_________________________________________。 (2)将足量铁粉投入水体中,经 24 小时测定 NO3 -的去除率和 pH,结果如下: 初始 pH pH=2.5 pH=4.5 NO3 -的去除率 接近 100% <50% 24 小时 pH 接近中性 接近中性 铁的最终物质形态 pH=4.5 时,NO3 -的去除率低。其原因是_____________________________________。 (3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高 NO3 -的去除 率。对 Fe2+的作用提出两种假设: Ⅰ.Fe2+直接还原 NO3 -; Ⅱ.Fe2+破坏 FeO(OH)氧化层。 ①做对比实验,结果如图 2 所示,可得到的结论是____________________。 ②同位素示踪法证实 Fe2+能与 FeO(OH)反应生成 Fe3O4,该反应的离子方程式为_________,解释加入 Fe2+ 提高 NO3 -去除率的原因:_____________________________________。 15.汽车尾气中含有 CO、NO 等有害气体。 (1)依据下图计算可知该反应生成 1 mol NO 的能量变化为________________kJ,属于_________反应(填 “吸热”、或“放热”)。 (2)通过 NO 传感器可监测汽车排放尾气中 NO 含量,其工作原理如图所示。据此回答: ①NiO 电极为___________ (填“正极”或“负极”)。 ②Pt 电极上发生的电极反应式为_________________________。 ③当电路中有 2 mol 电子发生转移时,NO 被消耗________________g。 (3)一种新型催化剂能使 NO 和 CO 发生反应:2NO+2CO⇌2CO2+N2。已知 增大催化剂的比表面积可 提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实 验,部分条件已经填在下表中。 实验编 号 T℃ NO 初始浓度 (mol/L) CO 初始浓度 (mol/L) 催化剂的比表面积 (m2/g) I 280 1.20×10-3 5.80×10-3 82 II 280 1.20×10-3 b 124 III 350 a 5.80×10-3 82 ①请将表中数据补充完整:a________________;b________________。 ②能验证温度对化学反应速率影响规律的实验是_________________(填实验编号)。 ③实验Ⅰ和实验Ⅱ中,NO 的物质的量浓度 c(NO)随时间 t 的变化曲线如图所示, 其中表示实验Ⅱ的是曲 线 _____________________ (填“甲”或“乙”)。 16.氯胺是氯气遇到氨气反应生成的一类化合物,主要包括一氯胺、二氯胺和三氯胺( 2N H C l 、 2N H C l 和 3N C l ) (1) 是作饮用水的二级消毒剂,水解生成一种具有强烈杀菌作用的物质。 中氯的化合价是 ________。 (2)已知生成 反应的热化学方程式和部分化学键的键能如下: 322NH(g)Cl(g)NHCl(g)HCl(g) 11.3kJ / molH 化学键 NH N C l H Cl Cl Cl 键能 1/ k J m o l 391.3 x 431.8 243.0 表中的 X=_______。 (3)在密闭容器中反应 322NH(g)+Cl(g)NHCl(g)+HCl(g) 达到平衡,通过热力学定律计算,不同温度 下理论上 的体积分数随 3 2 n NH n Cl 的变化如下图所示。 ①a、b、c 三点对应平衡常数的大小关系是(分别用 aK 、 bK 、 cK 表示)_______;b 点时,该反应的平衡常 数为________; ②在氨氯比一定时,提高 3NH 的转化率的方法是______(任写一种); ③若产物都是气体,实验测得 的体积分数始终比理论值低,原因可能是_______。 (4)垃圾渗滤液中含有大量的氨氮物质(用 表示)和氯化物,将其加入到如图所示的电解池(电极为惰性材 料)进行电解除去 。该净化过程分两步:第一步电解产生一种常见的氧化剂,第二步氧化剂氧化氨氮物 质生成 2N 。 ①写出电解时 A 极的电极反应式:_______; ②写出第二步反应的化学方程式:_______。 参考答案 1.C【解析】A. H2O2 分解产生 O2 的速率由慢反应决定即由反应Ⅰ决定,故 A 错误; B. I-是在反应过程中充当催化剂,IO-仅是催化剂在反应中的中间产物,故 B 错误; C. 分解 1molH2O2 放出热最 98kJ,根据盖斯定律得到 ΔH1+ΔH2= −196 kJ·mol−1,故 C 正确; D. 反应Ⅰ是慢反应,只能说活化能 Ea1 比反应Ⅱ活化能 Ea2 数值大,但大多少不能算出具体,故 D 错误。 综上所述,答案为 C。 2.D【解析】A.由工作原理示意图可知,氮气未参与反应,A 正确; B.反应过程中形成碳氧共价键,为极性共价键,B 正确; C.该过程中反应吸收了二氧化碳,有助于减少二氧化碳的排放,C 正确; D.升温可能会降低催化剂的活性,降低催化效率,D 错误; 答案选 D。 3.B【解析】由流程图可知,工业废气中 CO2、SO2 可被石灰乳吸收,生成固体 1 为 CaCO3、CaSO3,气体 1 是不能被过量石灰乳吸收的 N2、NO、CO,气体 1 通入气体 X,用氢氧化钠溶液处理后到的 NaNO2,X 可 为空气或氧气,目的是将一氧化氮氧化为二氧化氮,一氧化氮氧化为二氧化氮与氢氧化钠溶液反应生成 NaNO2,NaNO2 与含有 NH4+的溶液反应生成无污染气体的氮气,则气体 2 含有 CO、N2,用捕获剂捕获 CO 气体,催化剂作用下,一氧化碳和氢气共热反应生成甲醇。 A. 工业废气中 CO2、SO2 可被石灰乳吸收,生成 CaCO3、CaSO3,因氢氧化钙过量,则固体 1 为主要含有 Ca(OH)2、CaCO3、CaSO3,故 A 正确; B. 由分析可知,气体 1 中通入的气体 X 为空气或氧气,目的是将一氧化氮氧化为二氧化氮,一氧化氮氧化 为二氧化氮与氢氧化钠溶液反应生成 NaNO2,故 B 错误; C. 相同质量的 CO 和 CH3OH 完全燃烧放出的热量分别为 m 28 283 kJ 和 m 32 726.5 kJ,则后者放出的热量 多,故 C 正确; D.由分析可知,NaNO2 与废水中 NH4+发生氧化还原反应生成无污染的氮气和水,反应的离子方程式为 NH4++NO2-=N2↑+2H2O,故 D 正确; 故选 B。 4.C【解析】A.从反应机理图中可知,OH-有进入的箭头也有出去的箭头,说明 OH-参与了该催化循环, 故 A 项正确; B.从反应机理图中可知,该反应的反应物为 CO 和 H2O,产物为 H2 和 CO2,Fe(CO)5 作为整个反应的催化 剂,而 OH-仅仅在个别步骤中辅助催化剂完成反应,说明该反应方程式为 2522CO+HOFe(CO)CO+H ,故 有清洁燃料 H2 生成,故 B 项正确; C.由 B 项分析可知,该反应不是消耗温室气体 CO2,反而是生成了温室气体 CO2,故 C 项不正确; D.从反应机理图中可知,Fe 的成键数目和成键微粒在该循环过程中均发生了变化,故 D 项正确; 答案选 C。 5.C【解析】A.由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所 以应在正极发生,A 项正确; B.由示意图及元素 N 的化合价变化可写出如下转化 NO3-+8e-→NH4+,由于生成物中有 NH4+,所以只能用 H+和 H2O 来配平该反应而不能用 H2O 和 OH-来配平,所以④的电极反应式为 - 3NO +10H++8e-= + 4NH +3H2O, B 项正确; C.三氯乙烯 C2HCl3 中 C 原子化合价为+1 价,乙烯中 C 原子化合价为-2 价,1 mol C2HCl3 转化为 1 mol C2H4 时,得到 6 mol 电子,脱去 3 mol 氯原子,所以脱去 a mol Cl 时 ne=2a mol,C 项错误; D.增大单位体积水体中小微粒 ZVI 的投入量,可以增大小微粒 ZVI 和正极的接触面积,加快 ZVI 释放电 子的速率,可使 nt 增大,D 项正确; 故选 C。 6.D【解析】A 项,分析流程:SO2、Br2 和 H2O 反应生成 HBr 和 H2SO4,然后分离 HBr 和 H2SO4,最后电 解 HBr 溶液得到 Br2 和 H2,结合流程可得,该生产工艺中 Br2 被循环利用,故 A 正确;B 项,电解 HBr 溶 液,阴极 H+得电子生成 H2,消耗 H+,在电解过程中,电解槽阴极附近溶液的 pH 变大,故 B 正确;C 项, 原电池中负极发生失电子氧化反应,电极反应式为:SO2+2H2O-2e-=SO42-+4H+,故 C 正确;D 项,该工艺是 以 SO2 为原料,制备 H2SO4 和 H2,总反应为:SO2+2H2O=H2SO4+H2,故 D 正确。 7.A【解析】A.电源负极虽然产生 +H ,但是正极会消耗更多的 ,因此总体来看溶液酸性在减弱,pH 上升,A 项错误; B. Fe(Ⅱ)与 Fe(Ⅲ)在反应中不停相互转化,起到了传递电子的作用,B 项正确; C. - 2NO 被还原为氮气,而 2+Fe 本身被氧化为 3+Fe ,C 项正确; D.钯即负极,氢气在负极失电子变成 +H ,D 项正确; 答案选 A。 8.C【解析】镍氢电池总反应 H2+2NiOOH 放 电 充 电 2Ni(OH)2,放电过程(原电池原理:化学能转化为电能) 乙中 NiOOH 得电子发生还原反应作正极:NiOOH+e¯+ H2O= Ni(OH)2+ OH¯。甲中 H2(以 MHn 形式)发 生氧化反应作负极:H2- 2e¯+ 2OH¯=2H2O。充电过程(电解池原理:电能转化为化学能)乙作阳极,Ni(OH)2 失电子发生氧化,甲作阴极,水中的氢离子得电子发生还原反应。据此解答。 A. 根据分析,放电时甲电极 H2(以 MHn 形式)失去电子发生氧化反应作负极,充电时甲电极 2H2O+2e¯= H2↑+2OH¯,发生还原反应作阴极,A 项错误; B. 汽车上坡或加速时,电动机提供推动力,发生原电池原理,发生图中实线所示的过程。下坡或刹车时, 电池处于充电状态,发生电解池原理,发生虚线所示过程,B 说法错误; C. 汽车下坡电池处于充电状态,甲作阴极乙作阳极,电流从电源的正极流向阳极,阴极流向电源负极,不 经过内电路,故电流方向为:甲电极→发动机→乙电极, C 项正确; D. 汽车下坡时电池处于充电状态,甲电极为阴极:2H2O+2e¯= H2↑+2OH¯,周围溶液碱性增强,pH 增大, D 项错误; 答案选 C。 9.C【解析】左侧电极附近 Fe3+→Fe2+,发生了还原反应,该极为电解池的阴极,与之相连电源的 A 极为 负极,A 错误;与电源 B 相连电极为电解池的阳极,失电子发生氧化反应,B 错误;双氧水能够把 Fe2+氧 化为 Fe(OH)2+,C 正确;每消耗 1 mol O2,转移 4 mol 电子,根据 H2O2+Fe2+=Fe(OH)2++·OH 反应看出转移 1 mol 电子,生成 1mol OH,所以应当生成 4 mol OH;D 错误;正确选项 C。 10.C【解析】A.由氢气合成甲醇的过程中也涉及到氧化还原反应,A 项错误; B.根据 23CO+2H CH OH 可以看出,氧化剂和还原剂的物质的量之比为 1:2,B 项错误; C.根据工艺图不难看出“氯化”即氯气、钛铁矿和焦炭反应得到四氯化钛、一氧化碳和氯化铁的过程,C 项 正确; D.二氧化碳和镁会反应,因此不能用二氧化碳来作保护气,D 项错误; 答案选 C。 11.C【解析】电解 Na2PbCl4 溶液后生成 Pb,原理如图所示,电极Ⅱ周围 PbCl42-得电子转化为 Pb,则电极 Ⅱ为阴极,阴极的电极反应是发生还原反应,电极反应方程式为 PbCl42—+2e—=Pb+4Cl—;电极Ⅰ为阳极, 根据阴离子放电顺序,阳极发生的电极反应:2H2O-4e−=4H++O2↑,以此解题。 A. 根据分析,电极Ⅰ为阳极,根据阴离子放电顺序,阳极发生的电极反应:2H2O-4e−=4H++O2↑,阳极区 的溶质主要是 H2SO4,故 A 正确; B. 电极Ⅱ周围 PbCl42-得电子转化为 Pb,则电极Ⅱ为阴极,阴极的电极反应是发生还原反应,电极Ⅱ的电极 反应式为 PbCl42—+2e—=Pb+4Cl—,故 B 正确; C. 当有 2. 07 g Pb 生成时,即生成 Pb 的物质的量为= 2.07g 207g/mol =0.01mol,根据电极反应式为 PbCl42—+2e—=Pb+4Cl—,转移电子的物质的量为 0.02mol,电解液中的阳离子为氢离子,则通过阳离子交换 膜的阳离子为 0.02 mol,故 C 错误; D. 阴极电解一段时间后溶液为 HCl 和 NaCl 的混合溶液,根据题意“将 PbO 粗品溶解在 HCl 和 NaCl 的混合 溶液中,得到含 Na2PbCl4 的电解液”,继续向阴极区加 PbO 粗品可恢复其浓度且实现物质的循环利用,故 D 正确; 答案选 C。 12.C【解析】根据电池装置图知,石墨为负极,反应式为 LiC6-e-=Li++6C,磷酸铁锂为正极,反应式为 M1-xFexPO4+xLi++xe-=LiM1-xFexPO4,充电时,阴极、阳极反应式与负极、正极反应式正好相反,据此分析 解答。 A.放电时,电子由负极石墨电极流向正极磷酸铁锂电极,则电流由正极磷酸铁锂电极流向负极石墨电极, A 错误; B.放电时,Li+移向正极磷酸铁锂电极,充电时 Li+移向负极石墨电极,B 错误; C.放电时,石墨电极为负极,负极反应式为 LiC6-e-=Li++6C,C 正确; D.根据电池结构可知,该电池的总反应方程式为:M1-xFexPO4+LiC6 LiM1-xFexPO4+6C,D 错误; 故合理选项是 C。 13.(1) 2 4 2 3 2Ca(OH) +2NH ClΔCaCl +2NH +2H O (2) (3)氨气极易溶于水,需用防倒吸装置(4) A、B 两端呈白雾,玻璃管中央会产生白烟(5)向 a 溶液中加入强碱 NaOH 溶液后微热,并用湿润的红色石 蕊试纸检验生成的气体,试纸变蓝说明原溶液含有 + 4NH (6)ac 【解析】 (1)上图试管中发生的是实验室制备氨气的反应,其化学方程式为: 24232Ca(OH)+2NHCl ΔCaCl+2NH+2HO ,故答案为: 。 (2)由于氨气的密度比空气的小,故需用向下排空气法,采用上图装置收集则需短进长出,故上图方框中补 充完整的收集装置如下: ,故答案为: (3)由于氨气极易溶于水,故尾气吸收时需防倒吸,故下图设计的尾气处理装置不合理,需接一个倒扣的漏 斗,故其理由是氨气极易溶于水,需用防倒吸装置,故答案为:氨气极易溶于水,需用防倒吸装置; (4) 由于浓氨水和浓盐酸都有很强的挥发性,挥发出来的 NH3 和 HCl 在玻璃管的中央发生反应: NH3+HCl=NH4Cl,产生 NH4Cl 固体小颗粒,故形成白烟,可观察到的现象是 A、B 两端呈白雾,玻璃管中 央会产生白烟,故答案为:A、B 两端呈白雾,玻璃管中央会产生白烟; (5)将上图反应后试管中固体可能含有过量的 NH4Cl,实验室检验 + 4NH 的方法为:向 a 溶液中加入强碱 NaOH 溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有 ,故答案为:向 a 溶液中加入强碱 NaOH 溶液后微热,并用湿润的红色石蕊试纸检验生成的气体,试纸变蓝说明原溶液含有 ; (6) a.使用催化剂,降低反应所需要的活化能,可以加快合成氨的反应速率,a 正确; b.断裂化学键均需吸收能量,故②→③过程,是吸热过程,但包括 H - H 键和 N≡N 键的断裂,b 错误; c.由图中可知,不同非金属原子之间形成的共价键是极性共价键,故③→④过程,N 原 子和 H 原子形成 了含有极性键的 NH3,c 正确; d.合成氨反应是放热反应,故反应物断键吸收能量小于生成物形成新键释放的能量,d 错误; 故答案为:ac。 14.(1)①Fe②NO3 -+8e-+10H+=NH4 ++3H2O(2)FeO(OH)不导电,阻碍电子转移(3)①本实验条件下,Fe2+ 不能直接还原 NO3 -;在 Fe 和 Fe2+共同作用下能提高 NO3 -的去除率②Fe2++2FeO(OH)=Fe3O4+2H+;Fe2+将不导电 的 FeO(OH)转化为可导电的 Fe3O4,利于电子转移 【解析】(1)①原电池中负极材料失电子,根据图 1,铁失电子,所以作负极的物质化学式为 Fe; ②根据示意图,正极是 NO3 -得电子生成 NH4 +,正极的电极反应式是 NO3 -+8e-+10H+=NH4 ++3H2O; (2)根据图示,pH=4.5 时,NO3-的去除率低的原因是:pH=4.5 生成了较多的 FeO(OH), FeO(OH)不 导电,阻碍电子转移,所以 NO3 -的去除率低; (3)①根据图 2 可知,只加入 Fe2+的水中 NO3 -的去除率为 0,加入 Fe2+、Fe 的水中 NO3 -的去除率最高,可得 到的结论是本实验条件下,Fe2+不能直接还原 NO3 -;在 Fe 和 Fe2+共同作用下能提高 NO3 -的去除率; ②根据得失电子守恒,Fe2+与 FeO(OH)反应生成 Fe3O4 的离子方程式是 Fe2++2FeO(OH)=Fe3O4+2H+;加入 Fe2+ 提高 NO3-去除率的原因是:Fe2+将不导电的 FeO(OH)转化为可导电的 Fe3O4,利于电子转移,所以加入 Fe2+ 提高 NO3 -去除率。 15.(1)90;吸热(2)①负极②O2+4e-=2O2-③30(3)①1.20×10-3;5.80×10-3②Ⅰ和Ⅲ③乙 【解析】 (1)1molN2 和 1molO2 的化学键断裂形成 N 原子和 O 原子吸收总能量=946kJ+498kJ=1444kJ,N 原子 和 O 原子形成 2molNO 放出总能量=2×632kJ=1264kJ,所以该反应生成 1molNO 吸收 1 4 4 4 - 1 2 6 4 kJ2 =90kJ 能量,故答案为:90;吸热; (2)①由图可知,NO 在 NiO 电极失电子变为 NO2,NiO 为负极,故答案为:负极; ②由图可知,O2 在 Pt 电极得电子变为 O2-,电极反应式为:O2+4e-=2O2-,故答案为:O2+4e-=2O2-; ③负极电极反应为式为:2NO+2O2--4e-=2NO2,因此,当电路中有 2 mol 电子发生转移时,NO 被消耗 1mol, 质量为 1mol×30g/mol=30g,故答案为:30; (3)①因Ⅰ、Ⅱ催化剂的比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对 速率的影响,Ⅰ、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,故 答案为:1.20×10-3;5.80×10-3; ②能验证温度对化学反应速率影响规律的实验应控制其它条件相同,温度不同,符合条件的是实验Ⅰ和实 验Ⅲ,故答案为:Ⅰ和Ⅲ; ③因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的催化剂的比表面积较大,反应速 率大,则Ⅱ先达到化学平衡,则表示实验Ⅱ的是曲线乙,故答案为:乙。 16.(1)+1 价(2)191.2(3)①Kc<Ka=Kb;0.91②及时移除产物 NH2Cl 和 HCl③有副反应产物,如 NHCl2、 NCl3、N2 等(4)①2Cl--2e-=Cl2↑②第 3Cl2+2NH3=N2+6HCl 或 3Cl2+8NH3=N2+6NH4Cl 【解析】 (1) 2N H C l 是作饮用水的二级消毒剂,水解生成一种具有强烈杀菌作用的物质,说明该物质是次 氯酸,二氯胺与水反应生成一水合氨和次氯酸, 中氯的化合价是+1 价。故答案为:+1 价; (2)根据 NH3(g)+Cl2(g) NH2Cl(g)+HCl(g)△H=+11.3kJ·mol-1,△H=反应物键能总和-生成物键能总和 =(243.0+391.3×3)-(391.3×2+x+431.8)kJ·mol-1=+11.3kJ·mol-1,解得 x=191.2kJ·mol-1。故答案为:191.2; (3)①由图可知,a 点、b 点温度相同,则 Ka=Kb,该反应是吸热反应,升高温度,平衡正向移动,相同 3 2 n NH n Cl 下,平衡时 NH2Cl 的体积分数越大,说明 T1>T2,c 点温度小于 a、b 点温度,则 Kc<Ka=Kb;a 点、b 点 温度相同,则平衡常数也是相等,当 3 2 n N H n C l =0.4,平衡时 NH2Cl 的体积分数为 0.2,设氨气的物质的量为 0.4amol,氯气物质的量为 amol: 322NHg+ClgNH ClgHClg n(mol)0.4aa00 n(mol)xxxx n(mol)0.4axaxxx + 起始 转化 平衡 平衡时 NH2Cl 的体积分数为 0.2= x 0.4a x a x x x ,解得 x=0.28a,K= 2 32 cc 0.28a0.28a cc0.4a-0.28aa-0.28a NHClHCl NHCl ≈0.91,故答案为:Kc<Ka=Kb;0.91; ②提高 NH3 的转化率,即使平衡正向移动,该反应是吸热反应,可以升温来提高氨气转化率,或者及时移 除产物 NH2Cl 和 HCl,故答案为:及时移除产物 NH2Cl 和 HCl; ③若产物都是气体,实验测得 NH2Cl 的体积分数始终比理论值低,有可能有副反应产物,如 NHCl2、NCl3、 N2 等,故答案为:有副反应产物,如 NHCl2、NCl3、N2 等。 (4)①根据图示知道:A 电极是电解池的阳极,该电极上发生失电子的氧化反应,可以得到氧化剂,根据离 子的放电顺序,即氯离子失电子产生氯气的过程,电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑; ②第二步氧化剂氯气氧化氨氮物质即氨气生成 N2 的过程,发生的反应为:3Cl2+2NH3=N2+6HCl,故答案为: 3Cl2+2NH3=N2+6HCl 或 3Cl2+8NH3=N2+6NH4Cl。查看更多