【化学】陕西省榆林市2020届高三高考模拟第三次测试
陕西省榆林市2020届高三高考模拟第三次测试
可能用到的相对原子质量:H-1 C-12 O-16 S-32 K-39 Mn-55
第I卷(选择题)
7.化学与生产、生活、社会密切相关。下列有关说法中正确的是( )
A.“玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅
B.新冠肺炎防疫期间,可用酒精消毒,酒精浓度越大消毒效果越好
C.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
D.汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
8.二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
A.二羟甲戊酸是乙酸的同系物 B.能使酸性高锰酸钾溶液褪色
C.能发生加成反应和酯化反应 D.1 mol二羟甲戊酸能跟3 mol NaOH反应
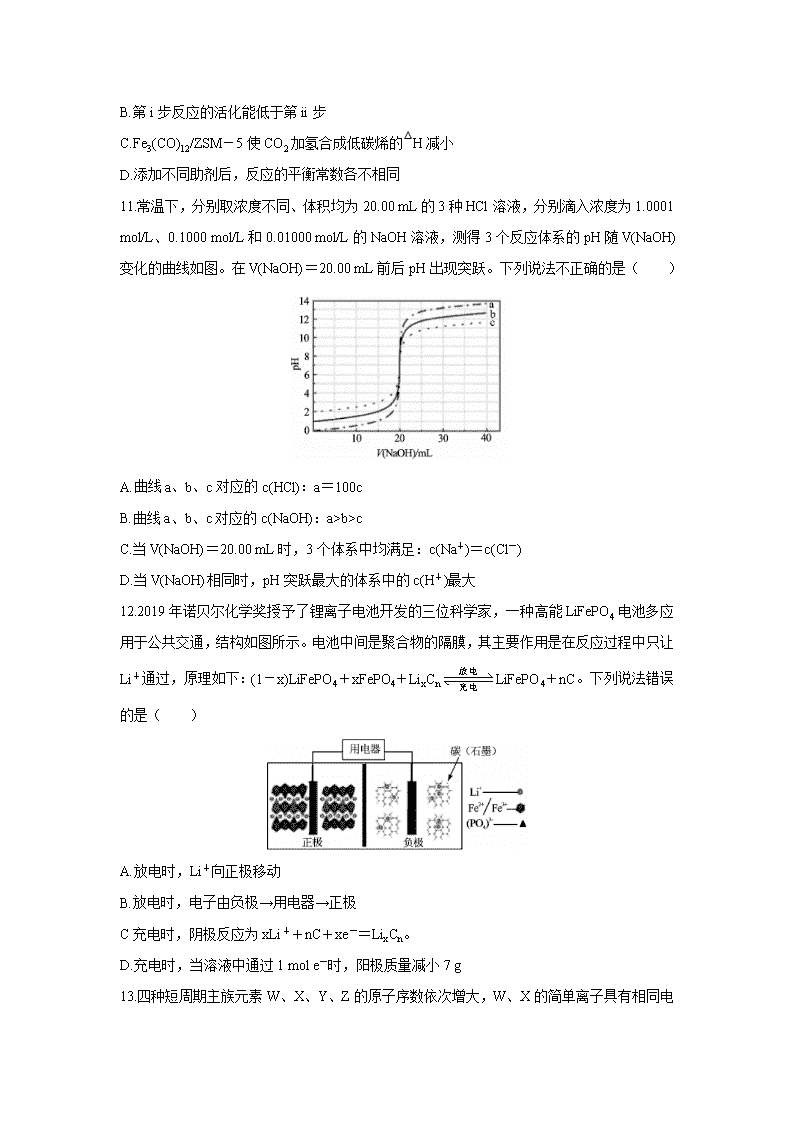
9.石蜡是石油减压分馏的产品,某实验小组利用如图的实验探究石蜡油(液态石蜡)分解的部分产物。下列说法正确的是( )
A.石蜡油属于油脂 B.该实验证明石蜡油分解产物只有乙烯
C.B中发生氧化反应,所以溶液褪色 D.碎瓷片的作用是防止暴沸
10.中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图
下列说法正确的是( )
A.第i步反应为CO2+H2=CO+H2O
B.第i步反应的活化能低于第ii步
C.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯的△H减小
D.添加不同助剂后,反应的平衡常数各不相同
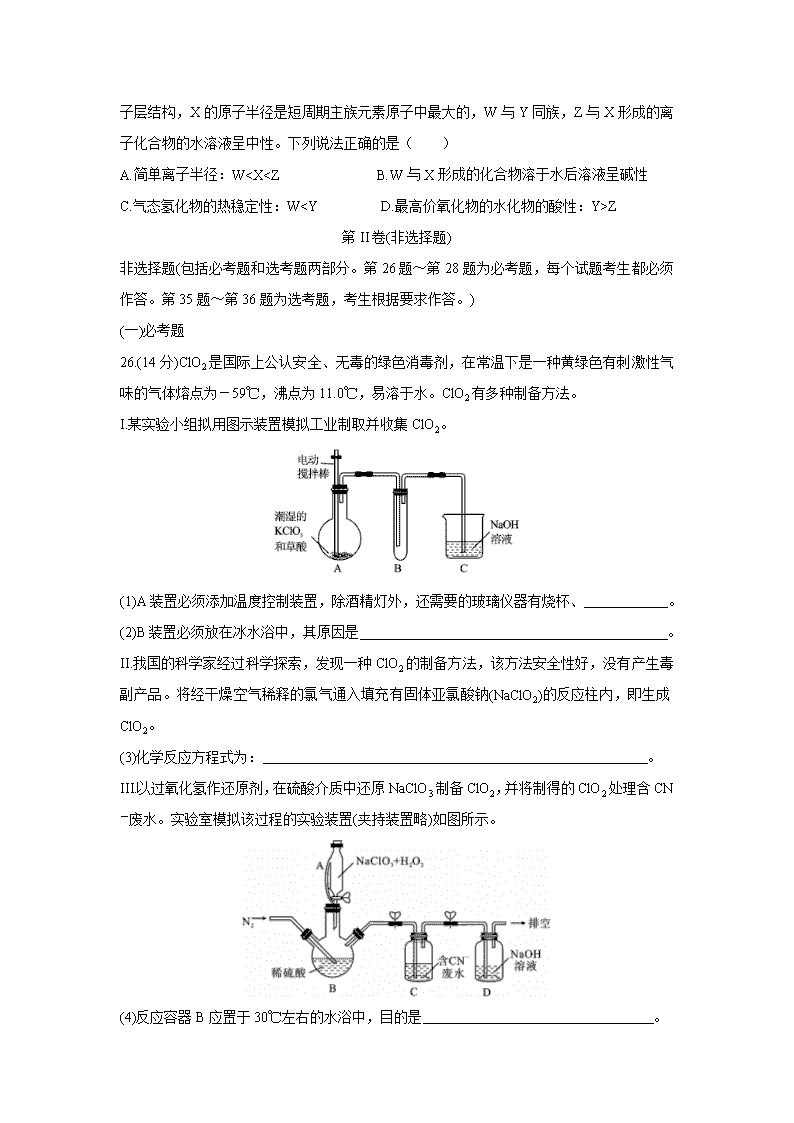
11.常温下,分别取浓度不同、体积均为20.00 mL的3种HCl溶液,分别滴入浓度为1.0001 mol/L、0.1000 mol/L和0.01000 mol/L的NaOH溶液,测得3个反应体系的pH随V(NaOH)变化的曲线如图。在V(NaOH)=20.00 mL前后pH出现突跃。下列说法不正确的是( )
A.曲线a、b、c对应的c(HCl):a=100c
B.曲线a、b、c对应的c(NaOH):a>b>c
C.当V(NaOH)=20.00 mL时,3个体系中均满足:c(Na+)=c(Cl-)
D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
12.2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家,一种高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC。下列说法错误的是( )
A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C充电时,阴极反应为xLi++nC+xe-=LixCn。
D.充电时,当溶液中通过1 mol e-时,阳极质量减小7 g
13.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:W
Z
第II卷(非选择题)
非选择题(包括必考题和选考题两部分。第26题~第28题为必考题,每个试题考生都必须作答。第35题~第36题为选考题,考生根据要求作答。)
(一)必考题
26.(14分)ClO2是国际上公认安全、无毒的绿色消毒剂,在常温下是一种黄绿色有刺激性气味的气体熔点为-59℃,沸点为11.0℃,易溶于水。ClO2有多种制备方法。
I.某实验小组拟用图示装置模拟工业制取并收集ClO2。
(1)A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
II.我国的科学家经过科学探索,发现一种ClO2的制备方法,该方法安全性好,没有产生毒副产品。将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内,即生成ClO2。
(3)化学反应方程式为: 。
III.以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。
(4)反应容器B应置于30℃左右的水浴中,目的是 。
(5)通入氮气的目的除了有利于将ClO2排出,还有 。
(6)ClO2处理含CN-废水的离子方程式为 。装置D的作用是 。
27.(15分)I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:
2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为 。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为 kJ/mol。
II.对于反应CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0-5分钟内的速率v(H2O(g))= 。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为 。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为,则反应的平衡常数K= 。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO)和p(H2)相等。
400K时p(H2)随时间变化关系的曲线是 ,
500K时p(CO)随时间变化关系的曲线是 。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正) v(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是 。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v(逆)(CO)=2v(正)(H2) d.混合气体的密度不再发生改变
28.(14分)一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:
(1)步骤①混合研磨成细粉的主要目的是 ;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,则反应的离子方程式为 。
(2)步骤③所得酸性滤液可能含有Fe2+,检验Fe2+的方法是 ;除去Fe2+的方法是 。步骤④是破坏Fe(OH)3胶体并使沉淀颗粒长大,便于过滤分离。步骤⑤所得滤渣为 (填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为 。
(4)硫化铵水解的离子方程式为:S2-+NH4++H2OHS-+NH3·H2O,如何判断溶液的酸碱性 。
(5)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液V mL,滴定反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+,产品中Mn2+的质量分数为ω(Mn2+)= 。
(二)选考题。请考生从给出的2道化学题中任选一题作答。如果多做,则按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为 。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有 。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为 mol。
(3)黄血盐中N原子的杂化方式为 ;C、N、O的第一电离能由大到小的排序为 ,与CN-互为等电子体的分子是 ,离子是 。
(4)Fe、Na、K的晶体结构如图所示。
①钠的熔点比钾更高,原因是 。
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是
g/cm3。
36.[化学——选修5:有机化学基础](15分)
磷酸氯喹()是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹()和磷酸在一定条件下制得。氯喹的合成路线如下:
(1)有机物A的名称是 ,E中含氧官能团的名称是 。
(2)反应①、②的反应类型分别是 、 。
(3)写出的方程式 。
(4)F的结构简式是 。
(5)反应③的另一种产物为 。
(6)M是H的一种同分异构体,写出满足下列条件的M的结构简式(不考虑立体异构,只需写出2种) 。
①分子结构中含有苯环(无其他环),且苯环上有三个取代基;
②能使溴水褪色;
③核磁共振氢谱有4组峰,峰面积之比为2:1:1:1。
(7)设计由甲苯为起始原料制备的合成路线(无机试剂任选) 。
【参考答案】
7.C 8.B 9.C 10.A 11.D 12.D 13.B
26.(每空2分,共14分)(1)温度计;
(2)ClO2的沸点为11.0℃,易挥发,应充分冷却以减少挥发
(3)2NaClO2+Cl22NaCl+2ClO2
(4)提高化学反应速率,同时防止H2O2受热分解(或答:高于30 ℃会导致H2O2分解,低于30 ℃会导致反应速率较低)
(5)稀释ClO2,防止其发生爆炸
(6)2CN- +2ClO22CO2+N2+2Cl-
吸收ClO2等气体,防止污染大气
27.(15分)(1)CO(g)+3H2(g)=CH4(g)+2H2O(l) ΔH= -250.4kJ·mol-1(2分)
(2)320.2(2分)
(3)0.032mol·L-1·min-1 (2分) 降低温度(1分)
(4) 或者1.32(2分)
(5) b(1分) d(1分)
(6) >(2分) c d(2分)
28.(14分)(1)提高硫酸浸取时的浸取率(1分)
3MnO2 +2FeS2+12H+3Mn2++2Fe3++4S↓+6H2O(2分)
(2)取少量滤液于试管中,加入高锰酸钾溶液,紫色褪去(2分);加入H2O2或MnO2(2分) Fe(OH)3(1分)
(3)(NH4)2Sx+12NH3↑+H2S↑+xS↓(2分)
(4)比较SH-与NH4+水解常数的相对大小(2分)
(5)×100%(2分)
35.(共15分)⑴ 3d(1分)
⑵ 配位键 (2分) 1 (2分) ⑶ sp (2分) N>O>C (2分) N2 C22-(各1分)
⑷ ①Na的半径小,形成的金属键键能大,熔点高 (2分)
② (2分)
36.(共15分)(1)间氯硝基苯或3-氯硝基苯或间硝基氯苯(1分) 羟基、酯基(各1分)
(2)取代反应 还原反应(各1分)
(3) (2分)
(4)(2分)
(5)CH3CH2OH(1分)
(6)
(2分)
(7)
(3分)