- 2021-07-02 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】吉林省东辽五中2019-2020学年高二上学期9月月考试题(解析版)
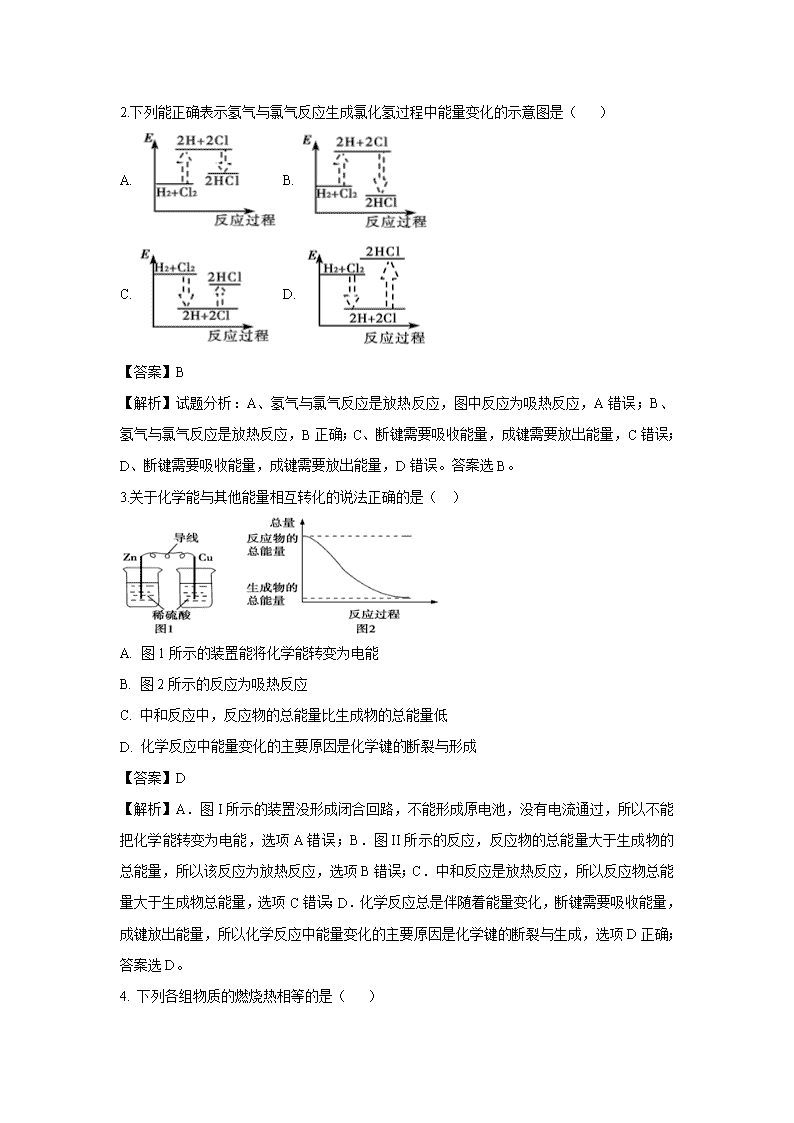
吉林省东辽五中2019-2020学年高二上学期9月月考试题 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4.考试结束后,请将本试题卷和答题卡一并上交。 相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 Mn 55 Ba 137 一、选择题(每小题3分,共48分,每小题只有一个选项符合题意) 1.下列说法正确的是( ) A. 吸热反应不加热就不会发生 B. 放热反应在常温下一定很容易发生 C. 需要加热才能发生的反应一定是吸热反应 D. 反应是放热还是吸热取决于反应物和生成物所具有的总能量的相对大小 【答案】D 【解析】 【分析】反应吸热还是放热与反应条件无关,决定于反应物和生成物能量的相对高低,据此分析。 【详解】反应吸热还是放热与反应条件无关,决定于反应物和生成物能量的相对高低, A、有的吸热反应,如氯化铵与氢氧化钡反应,不需要加热即能发生,故A错误; B、放热反应在常温下不一定很容易发生,有些放热反应需要加热或高温的反应条件才能发生,故B错误; C、需要加热才能发生的反应不一定是吸热反应,如燃烧都是放热反应,但需加热到可燃物的着火点才能发生,故C错误; D、反应是吸热还是放热与反应条件无关,决定于反应物和生成物能量的相对高低,所以D选项是正确的。 故选D。 2.下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是( ) A. B. C. D. 【答案】B 【解析】试题分析:A、氢气与氯气反应是放热反应,图中反应为吸热反应,A错误;B、氢气与氯气反应是放热反应,B正确;C、断键需要吸收能量,成键需要放出能量,C错误;D、断键需要吸收能量,成键需要放出能量,D错误。答案选B。 3.关于化学能与其他能量相互转化的说法正确的是( ) A. 图1所示的装置能将化学能转变为电能 B. 图2所示的反应为吸热反应 C. 中和反应中,反应物的总能量比生成物的总能量低 D. 化学反应中能量变化的主要原因是化学键的断裂与形成 【答案】D 【解析】A.图I所示的装置没形成闭合回路,不能形成原电池,没有电流通过,所以不能把化学能转变为电能,选项A错误;B.图II所示的反应,反应物的总能量大于生成物的总能量,所以该反应为放热反应,选项B错误;C.中和反应是放热反应,所以反应物总能量大于生成物总能量,选项C错误;D.化学反应总是伴随着能量变化,断键需要吸收能量,成键放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,选项D正确;答案选D。 4. 下列各组物质的燃烧热相等的是( ) A. C和CO B. 红磷和白磷 C. 3molC2H2(乙炔)和1molC6H6(苯) D. 1gH2和2gH2 【答案】D 【解析】试题分析:燃烧热:25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,A、C和CO是不同物质,燃烧热不同,错误;B、红磷和白磷结构不同,燃烧热不同,错误;C、乙炔和苯结构不同,具有的能量不同,则燃烧热不同,错误;D、都是氢气,燃烧热相同,正确。 5.在下列各说法中,正确的是( ) A. ΔH>0表示放热反应,ΔH<0表示吸热反应 B. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 C. 热化学方程式中的化学计量数只表示物质的量,可以是分数 D. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 【答案】C 【解析】A.ΔH >0表示吸热反应,ΔH <0表示放热反应,选项A错误; B.1mol 物质完全燃烧产生稳定的化合物时放出的热叫燃烧热。1mol H2 与0.5mol O2反应得到的水可能是气态也可能是液态,放出的能量并不相同,选项B错误;C.热化学方程式中的化学计量数表示物质的量的关系,可以是分数,选项C正确;D.酸和碱发生中和反应生成1mol的水时放出的热叫做中和热。1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时产生2mol的水,选项D错误;答案选C。 6.下列物质间的反应,其能量变化符合如图的是( ) A. 由Zn和稀H2SO4制氢气 B. 灼热的炭粉与二氧化碳 C. Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D. 碳酸钙的分解 【答案】A 【解析】 【分析】从图上分析,反应物能量高于生成物,正反应是放热反应。 【详解】A.活泼金属与酸的反应是放热反应,A正确; B.灼热的碳和二氧化碳的反应,是以C作为还原剂的反应,反应吸热,B错误;C.Ba(OH)2•8H2O与NH4Cl晶体混合反应是吸热反应,C错误; D.碳酸钙分解属于分解反应,是吸热反应,D错误; 故选A。 7.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF—F 、S—F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为( ) A. -1780kJ·mol-1 B. -1220 kJ·mol-1 C. -450 kJ·mol-1 D. +430 kJ·mol-1 【答案】B 【解析】根据反应热=反应物的键能总和﹣生成物的键能总和分析,反应热=280+3×160﹣6×330=﹣1220 kJ/mol,选B。 8.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量。下列热化学方程式书写正确的是( ) A. 2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1 B. CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 C. CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 D. CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1 【答案】B 【解析】 【分析】实验测得101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,因此其热化学方程式应写为H2(g)+0.5O2(g)=== H2O(l) ΔH=-285.8 kJ·mol-1;1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量,因此其热化学方程式应写为CH4(g)+2O2(g) === CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1。 【详解】A. 根据题意,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,因此该热化学方程式应写为:H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1,A项错误; B. 根据题意,1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量,因此其热化学方程式CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1书写正确,B项正确; C. 根据题意,1 mol CH4完全燃烧生成液态水和CO2气体,放出890.3 kJ的热量,而此热化学方程式CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1中的产物水的状态为水蒸气,与题意不符,C项错误; D. 燃烧反应均为放热反应,因此该热化学方程式CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1中反应热的符号错误,D项错误; 答案应选B。 9.25℃、101 kPa时,强酸与强碱稀溶液发生中和反应的中和热为57.3 kJ·mol-1,下列热化学方程式书写正确的是( ) A. 1/2Ba(OH)2(aq)+1/2H2SO4(aq)1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 B. 1/2KOH(aq)+H2SO4(aq)1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 C. 2NaOH(aq)+H2SO4(aq)Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1 D. KOH(aq)+1/2H2SO4(浓)1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 【答案】B 【解析】 【分析】在稀溶液中,稀的酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热。 【详解】A、BaSO4是难溶电解质,形成时要放出热量,故A错误;B、在稀溶液中,酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热,故B正确;C、该反应生成2mol水,故C错误;D、浓硫酸稀释时要放热,故D错误。故选B。 10.下列说法正确的是( ) A. 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度 B. 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 D. 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-a kJ/mol II: 且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol 【答案】A 【解析】A、测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度,A正确;B、在一定条件下,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量是燃烧热,碳的稳定氧化物是二氧化碳,B错误;C、需要加热的反应不一定是吸热反应,例如碳燃烧;常温下能发生的反应也不一定是放热反应,例如氢氧化钡和铵盐反应,C错误;D、反应热等于断键吸收的能量和形成化学键所放出的能量差值,则根据方程式可知b+c-2x=-a,因此断开1molH-Cl键所需的能量为,D错误,答案选A。 11.已知25 ℃、101 kPa条件下: ①4Al(s)+3O2(g)===2Al2O3(s) ΔH=−2 834.9 kJ·mol−1 ②4Al(s)+2O3(g)===2Al2O3(s) ΔH=−3 119.1 kJ·mol−1 由此得出的正确结论是( ) A. 等质量的O2比O3能量低,由O2变O3为吸热反应 B. 等质量的O2比O3能量高,由O2变O3为放热反应 C. O3比O2稳定,由O2变O3吸热反应 D. O2比O3稳定,由O2变O3为放热反应 【答案】A 【解析】将两个热化学方程式叠加处理得:3O2(g)=2O3(g) ΔH=+284.2 kJ·mol-1,所以O2变为O3的反应是吸热反应,O2的能量低,O2更稳定。 12.分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( ) “嫦娥一号”火箭燃料 液氢(H2) ①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) ΔH=-482.6 kJ·mol-1 奥运会“祥云”火炬燃料 丙烷(C3H8) ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2013.8 kJ·mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2221.5 kJ·mol-1 A. 571.6 kJ·mol-1 , 2221.5 kJ·mol-1 B. 241.3 kJ·mol-1, 2013.8 kJ·mol-1 C. 285.8 kJ·mol-1, 2013.8 kJ·mol-1 D. 285.8 kJ·mol-1, 2221.5 kJ·mol-1 【答案】D 【解析】 【分析】燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,据此判断。 【详解】1mol氢气燃烧生成液态水时放出的热量是氢气的燃烧热,所以根据热化学方程式2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1可知,氢气的燃烧热为571.6kJ·mol-1/2=285.8 kJ·mol-1;1mol丙烷完全燃烧生成CO2气体和液态水时放出的热量是丙烷的燃烧热,所以根据热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1可知,丙烷的燃烧热为2221.5 kJ·mol-1,答案选D。 13.下列各组热化学方程式的前者△H大于后者的是( ) ①S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 ②2H2(g)+O2(g)═2H2O(g)△H3 2H2(g)+O2(g)═2H2O(l)△H4 ③CaCO3(s)═CaO(s)+CO2(g)△H5 CaO(s)+H2O(l)═Ca(OH)2(s)△H6. A. 只有①③ B. 只有①② C. 只有②③ D. ①②③ 【答案】D 【解析】试题分析:①都为放热反应,△H<0,由于S(s)→S(g)吸热,则前者放出的热量少,则△H1>△H2,故①正确;②都为放热反应,△H<0,由于2H2O(l)→2H2O(g)吸热,则前者放出的热量少,则△H3>△H4,故②正确;③前者为吸热反应,△H5>0,后者为放热反应,△H6<0,则△H5>△H6,故③正确,故选D。 14.在一定条件下,CO和CH4燃烧的热化学方程式分别为 2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 由1 mol CO(g)和3 mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( ) A. 2912 kJ B. 2953 kJ C. 3236 kJ D. 3867 kJ 【答案】B 【解析】试题分析:根据所给的热化学方程式可知,1molCO气体完全燃烧生成二氧化碳放出的能量是566/2kJ=283kJ,3mol甲烷完全燃烧放出的能量是890kJ/mol×3mol=2670kJ,则释放的总能量是283+2670=2953kJ,答案选B。 15.现有三个热化学方程式: (1)CH3COOH(l)+2O2(g)=2CO2 (g)+2H2O(l) ΔH1=-870.3 kJ/mol (2)C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol (3)H2(g)+1/2 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol 则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( ) A. -488.3 kJ/mol B. +488.3 kJ/mol C. -2228.9 kJ/mol D. +191 kJ/mol 【答案】A 【解析】已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-8703 kJ/mol ②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol ③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ/mol 则根据盖斯定律可知②×2+③×2-①即得到反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为-488.3 kJ/mol,答案选A。 16.下列有关热化学方程式的叙述中,正确的是( ) A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1 B. 已知热化学方程式:SO2(g)+O2(g)SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1 D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定 【答案】D 【解析】 【详解】A.中和热是酸碱发生中和反应产生1mol液态水时放出的热量;表示中和热的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.4kJ·mol-1, A错误; B.该反应是可逆反应,不能进行到底,所以在容器中充入2molSO2 和1molO 2 反应物不能完全反应,最终放出的热量小于196.64kJ,B错误; C.燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量;水在气态时不稳定,只有生成液态水时稳定,C错误; D.石墨转化为金刚石为吸热,说明石墨能量低,金刚石能量高,石墨比金刚石稳定,D正确;正确选项D。 17.(1)乙醇常被用做饮料的添加剂,在一定的条件下能被氧化为乙醛,乙醇___(“能”或“不能”)使酸性KMnO4 溶液褪色;已知常温下,2.3g乙醇和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35kJ热量,则该反应的热化学方程式为___。 (2)已知: 化学键 Si—Cl H—H H—Cl Si—Si 键能/kJ·mol-1 360 436 431 176 且硅晶体中每个硅原子和其他4个硅原子形成4个共价键,工业上制取高纯硅的反应方程式为:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。 (3)已知水的比热容为4.18×10-3kJ·g-1·C-1。10g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500 g H2O的温度由18℃升至62.4℃,则硫黄的燃烧热为____,热化学方程式为____。 【答案】(1). 能 (2). C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol−1 (3). +236 (4). 297kJ·mol−1 (5). S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol−1 【解析】 【分析】(1)乙醇具有还原性;2.3g乙醇和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35kJ热量,则1mol乙醇完全燃烧放出的热量为68.35 kJ×=1367kJ; (2)焓变=反应物的总键能-生成物的总键能; (3)S的燃烧热是1molS完全燃烧生成二氧化硫气体放出的热量; 【详解】(1)乙醇具有还原性,能够被酸性KMnO4氧化,能使酸性KMnO4溶液褪色;2.3 g乙醇的物质的量为=0.05mol,和一定量的氧气混合后点燃,恰好完全燃烧,放出68.35 kJ热量,则1mol乙醇完全燃烧放出的热量为68.35 kJ×=1367kJ,反应的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1367 kJ·mol−1; (2)硅晶体中每个硅原子和其他4个硅原子形成4个共价键,则1mol硅含有2mol Si—Si;ΔH=反应物总键能-生成物总键能,则SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236kJ/mol; (3)10g硫磺燃烧共放出热量为:Q=m·c(t2-t1)=500g×4.18×10-3 kJ·(g·℃)-1×(62.4-18)℃=92.8 kJ,则1mol(32g)硫磺燃烧放出的热量为:92.8kJ×=297 kJ,所以硫磺的燃烧热为297kJ·mol-1,热化学方程式为S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol−1。 18.某实验小组用0.50mol·L-1 氢氧化钠溶液和0.50mol·L-1硫酸溶液进行中和热的测定。 (1)倒入NaOH溶液的正确操作是_______________(从下列选出)。 A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入 (2)使硫酸与NaOH溶液混合均匀正确操作是_________(从下列选出)。 A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动 (3)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。请填写下表中的空白:近似认为0.50 mol·L-1 氢氧化钠溶液和0.50 mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。 起始温度t1/℃ 终止温度 t2/℃ 温度差平均值 (t2-t1)/℃ H2SO4 NaOH 平均值 1 26.2 26.0 26.1 30.1 __________ 2 27.0 274 27.2 33.3 3 25.9 25.9 25.9 29.8 4 26.4 26.2 26.3 30.4 (4)计算中和热△H=______________(取小数点后一位)。 (5)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是____________________。 (6)研究浓度对反应速率的影响,用酸性kMnO4和H2C2O4反应,请写出该反应的离子方程式:____。 【答案】(1). B (2). D (3). 4.0 (4). -53.5kJ·mol-1 (5). Ba(OH)2和硫酸反应除生成水外,还有硫酸钡生成,该反应中的生成热会影响反应的反应热 (6). 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 【解析】 【详解】(1)玻璃棒缓慢倒入或分多次把NaOH溶液倒人盛有盐酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,应一次迅速倒入;正确选项B。 (2)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动;正确选项D。 (3)4次的温度差分别为:4℃、6.1℃、3.9℃、4.1℃ ,第二组数据无效,温度差平均值=(4.0+3.9+4.1)/3=4.0℃;正确答案:4.0。 (4)近似认为0.5mol/L的NaOH溶液和0.5mol/L的硫酸溶液的密度都是1g/cm3,所以50mL的NaOH溶液和30mL硫酸溶液混合后溶液质量=50+30=80g;又因为比热容c=4.18 J/(g·℃),反应的起始温度与终止温度差为4℃,所以反应放热=4.18×80×4=1337.6J,而n(OH-)=0.5×50/1000=0.025mol,n(H+)=0.5×2×30/1000=0.03mol,OH-少量,所以1molH+与1molOH-反应放热=1337.6/0.025=53504J=53.504KJ;所以ΔH=-53.5KJ/mol;正确答案:-53.5kJ·mol-1。 (5)Ba(OH)2和硫酸反应除生成水外,还有硫酸钡生成,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液;正确答案:Ba(OH)2和硫酸反应除生成水外,还有硫酸钡生成,该反应中的生成热会影响反应的反应热。 (6)酸性KMnO4具有强氧化性,H2C2O4具有还原性,H2C2O4被氧化为二氧化碳气体,MnO4-被还原为Mn2+,根据电子守恒及电荷守恒,该反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;正确答案:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。 19.(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a__238.6(填“>”、“<”或“=”)。 (2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:____。 (3)反应mA(g)+nB(g)pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。 该反应ΔH=___(用含E1、E2式子表示);在反应体系中加入催化剂,E1__,E2__,(填增大、减小、不变)。 【答案】(1). < (2). 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol (3). ΔH=-(E2-E1)kJ/mol (4). 减小 (5). 减小 【解析】 【分析】(1)CH3OH(l)的燃烧热是1mol甲醇燃烧生成CO2(g)和H2O(l)放出的热。 (2)1mol Cl2参与反应时释放出145kJ热量,则2mol Cl2与2mol H2O(g)反应放热290 kJ; (3)焓变=反应物的总键能-生成物的总键能;催化剂降低活化能; 【详解】(1)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,液态水为稳定的氧化物,1mol甲醇燃烧生成CO2(g)和H2O(l)放热238.6kJ,所以1mol甲醇燃烧生成CO2(g)和H2O(g),放出的热量小于燃烧热,故a<238.6; (2)有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g) ΔH=-290kJ·mol−1; (3)由图象可知该反应是一个能量降低的反应,所以属于放热反应;ΔH=反应物的总键能-生成物的总键能,所以ΔH=E1-E2= -(E2-E1)kJ/mol;加入催化剂改变了反应的途径,降低反应的活化能,所以E1和E2都减小。 20.(1)已知拆开1mol H—H键、1mol N—H键、1molN≡N键需要的能量分别是436 kJ、391 kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。 (2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题: ①该反应的ΔH___0(填“大于”“小于”或“等于”); ②反应物的总键能为__; ③写出该反应的热化学方程式____。 (3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题: ①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2 ③O2(g)+2H2(g)=2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ/mol 上述反应热效应之间的关系式为ΔH4=___,联氨和N2O4可作为火箭推进剂的主要原因为____。 【答案】(1). N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1 (2). 大于 (3). akJ·mol-1 (4). A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ·mol-1 (5). 2ΔH3-2ΔH2-ΔH1 (6). 反应放热量大、产生大量气体、无污染 【解析】 【分析】(1)焓变=反应物的总键能-生成物的总键能; (2)①根据图示,反应物总能量小于生成物总能量; ②反应物的总键能是断开1mol A2(g)和1mol B2(g)吸收的总能量; ③焓变=反应物的总键能-生成物的总键能; (3)根据盖斯定律,反应热只与反应体系的始态、终态有关,与反应历程无关。 【详解】(1)N2与H2反应生成NH3的化学方程式为N2(g)+3H2(g)=2NH3(g),该反应的ΔH=反应物的键能总和-生成物的键能总和= 946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol;N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol。 (2)①1mol A2(g)和1mol B2(g)具有的总能量小于2molAB(g)具有的总能量,反应A2(g)+B2(g)=2AB(g)为吸热反应,ΔH大于0。 ②根据图象,反应物的总键能为akJ/mol。 ③根据图象,该反应的ΔH=+(a-b)kJ/mol,该反应的热化学方程式为:A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ/mol。 (3)根据盖斯定律,将③×2-①-②×2得2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),则ΔH4=2ΔH3-ΔH1-2ΔH2。根据反应④知,联氨和N2O4作为火箭推进剂,反应放热量大、产生大量气体、无污染。 21.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g)CH3OH(g) ΔH1 ②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2 ③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3 (1)回答下列问题:已知反应①中相关的化学键键能数据如下: 化学键 H—H C—O C≡O H—O C—H E/(kJ·mol-1) 436 343 1 076 465 413 由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。 (2)已知在常温常压下: ①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1 ②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1 写出表示甲醇燃烧热的热化学方程式_________________。 (3)已知常温时红磷比白磷稳定,已知: ①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1 ②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2 比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。 (4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ•,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。 【答案】(1). -99 (2). +41 (3). CH3OH(l)+O2(g)===CO2(g)+2H2O ΔH=-725.8 kJ·mol-1 (4). < (5). > 【解析】(1)反应热=反应物总键能-生成物总键能,故△H1=1076kJ·mol-1+2×436kJ·mol-1-(3×413+343+465)kJ·mol-1=-99kJ·mol-1;根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58kJ·mol-1-(-99kJ·mol-1)=+41kJ·mol-1,故答案为:-99 ;+41 ; (2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ/mol,②H2O(g)=H2O(l) △H3=-44.0kJ/mol,由盖斯定律①+②×4,得:2CH3OH(l)+3O2(g)=2CO2 (g)+4H2O(l) △H=(-1275.6kJ/mol)+(-44.0kJ/mol)×4=-1451.6kJ/mol,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+ O2(g)=CO2(g)+2H2O ΔH=-725.8 kJ/mol,故答案为:CH3OH(l)+ O2(g)=CO2(g)+2H2O ΔH=-725.8 kJ/mol; (3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,故答案为:<; (4)浓硫酸溶于水放热,放出的热量大于57.3kJ;故答案为:>。查看更多