- 2021-07-02 发布 |
- 37.5 KB |
- 5页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学 期末君之讲稿(十三)影响化学平衡的因素学案(无答案)新人教版
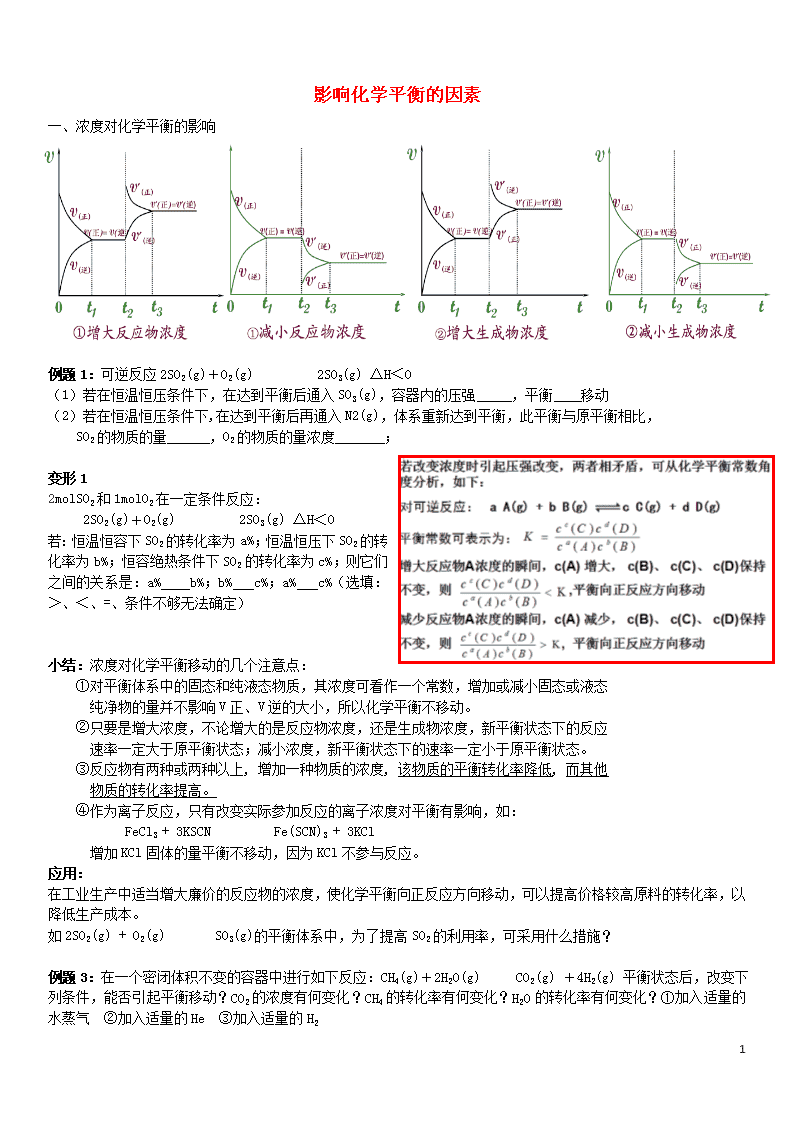
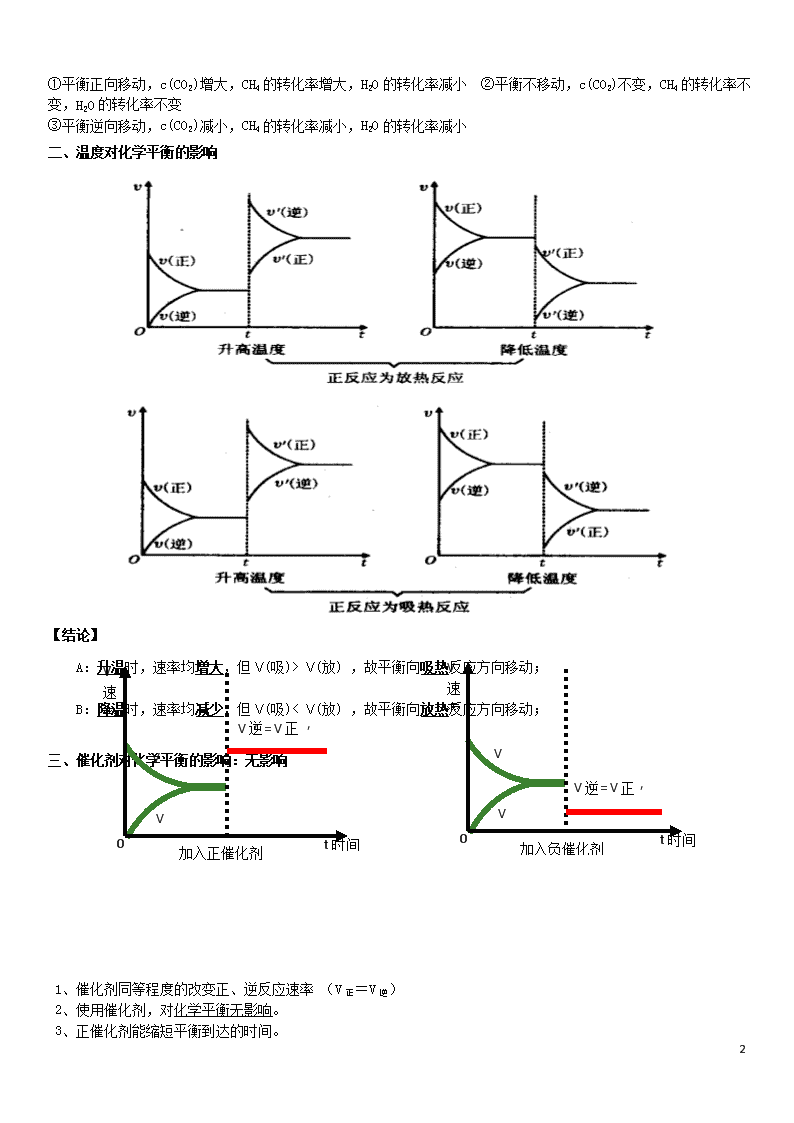
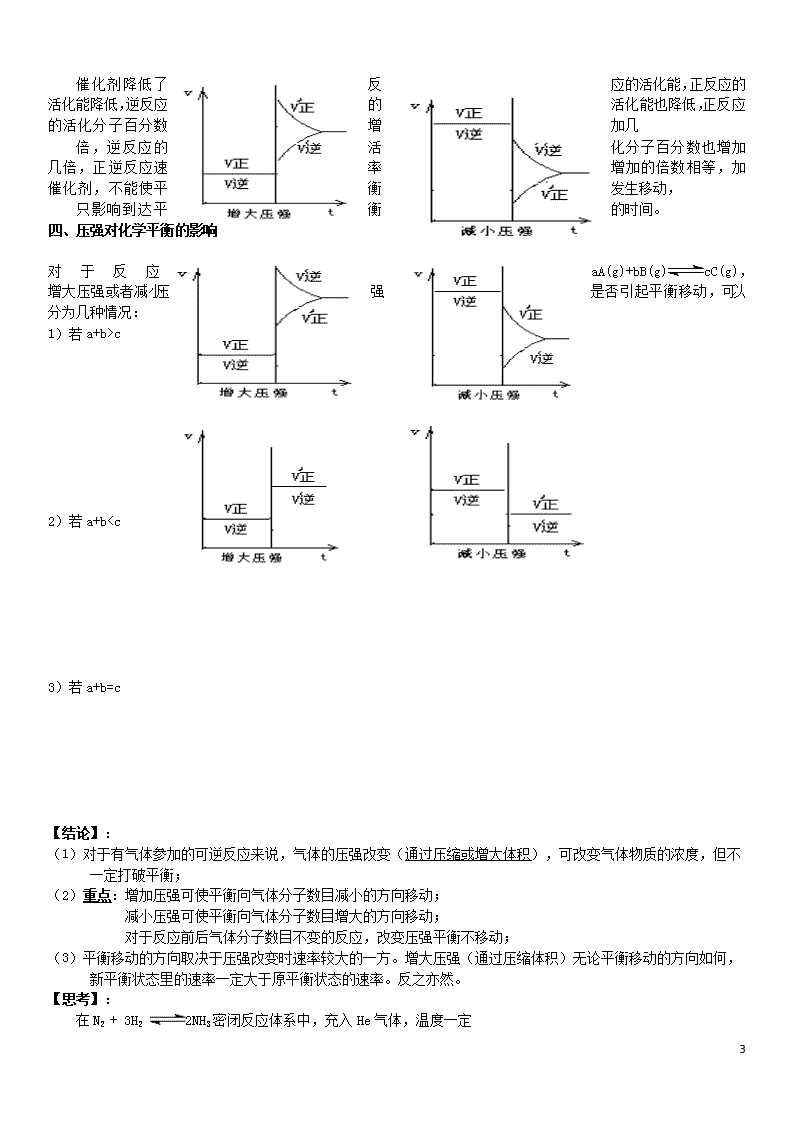
影响化学平衡的因素 一、浓度对化学平衡的影响 例题1:可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0 (1) 若在恒温恒压条件下,在达到平衡后通入SO3(g),容器内的压强 ,平衡 移动 (2) 若在恒温恒压条件下,在达到平衡后再通入N2(g),体系重新达到平衡,此平衡与原平衡相比, SO2的物质的量 ,O2的物质的量浓度 ; 变形1 2molSO2和1molO2在一定条件反应: 2SO2(g)+O2(g) 2SO3(g) △H<0 若:恒温恒容下SO2的转化率为a%;恒温恒压下SO2的转化率为b%;恒容绝热条件下SO2的转化率为c%;则它们之间的关系是:a% b%;b% c%;a% c%(选填:>、<、=、条件不够无法确定) 小结:浓度对化学平衡移动的几个注意点: ①对平衡体系中的固态和纯液态物质,其浓度可看作一个常数,增加或减小固态或液态 纯净物的量并不影响V正、V逆的大小,所以化学平衡不移动。 ②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应 速率一定大于原平衡状态;减小浓度,新平衡状态下的速率一定小于原平衡状态。 ③反应物有两种或两种以上, 增加一种物质的浓度, 该物质的平衡转化率降低, 而其他 物质的转化率提高。 ④作为离子反应,只有改变实际参加反应的离子浓度对平衡有影响,如: FeCl3 + 3KSCN Fe(SCN)3 + 3KCl 增加KCl固体的量平衡不移动,因为KCl不参与反应。 应用: 在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本。 如2SO2(g) + O2(g) SO3(g)的平衡体系中,为了提高SO2的利用率,可采用什么措施? 例题3:在一个密闭体积不变的容器中进行如下反应:CH4(g)+2H2O(g) CO2(g) +4H2(g) 平衡状态后,改变下列条件,能否引起平衡移动?CO2的浓度有何变化?CH4的转化率有何变化?H2O的转化率有何变化?①加入适量的水蒸气 ②加入适量的He ③加入适量的H2 5 ①平衡正向移动,c(CO2)增大,CH4的转化率增大,H2O的转化率减小 ②平衡不移动,c(CO2)不变,CH4的转化率不变,H2O的转化率不变 ③平衡逆向移动,c(CO2)减小,CH4的转化率减小,H2O的转化率减小 二、 温度对化学平衡的影响 【结论】 A:升温时,速率均增大,但Ѵ(吸)> Ѵ(放) ,故平衡向吸热反应方向移动; B:降温时,速率均减少,但Ѵ(吸)< Ѵ(放) ,故平衡向放热反应方向移动; 三、催化剂对化学平衡的影响:无影响 t时间 加入负催化剂 V速率 V正 V逆 0 V逆= V正 ′ ′ t时间 加入正催化剂 V速率 V正 V逆 0 V逆= V正 ′ ′ 1、催化剂同等程度的改变正、逆反应速率 (V正=V逆) 2、使用催化剂,对化学平衡无影响。 3、正催化剂能缩短平衡到达的时间。 5 催化剂降低了反应的活化能,正反应的活化能降低,逆反应的活化能也降低,正反应的活化分子百分数增加几 倍,逆反应的活化分子百分数也增加几倍,正逆反应速率增加的倍数相等,加催化剂,不能使平衡发生移动, 只影响到达平衡的时间。 四、压强对化学平衡的影响 对于反应aA(g)+bB(g) cC(g),增大压强或者减小压强是否引起平衡移动,可以分为几种情况: 1)若a+b>c 2)若a+b查看更多