- 2021-07-02 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省师大附中高二上学期期中考试化学试题(实验班) Word版
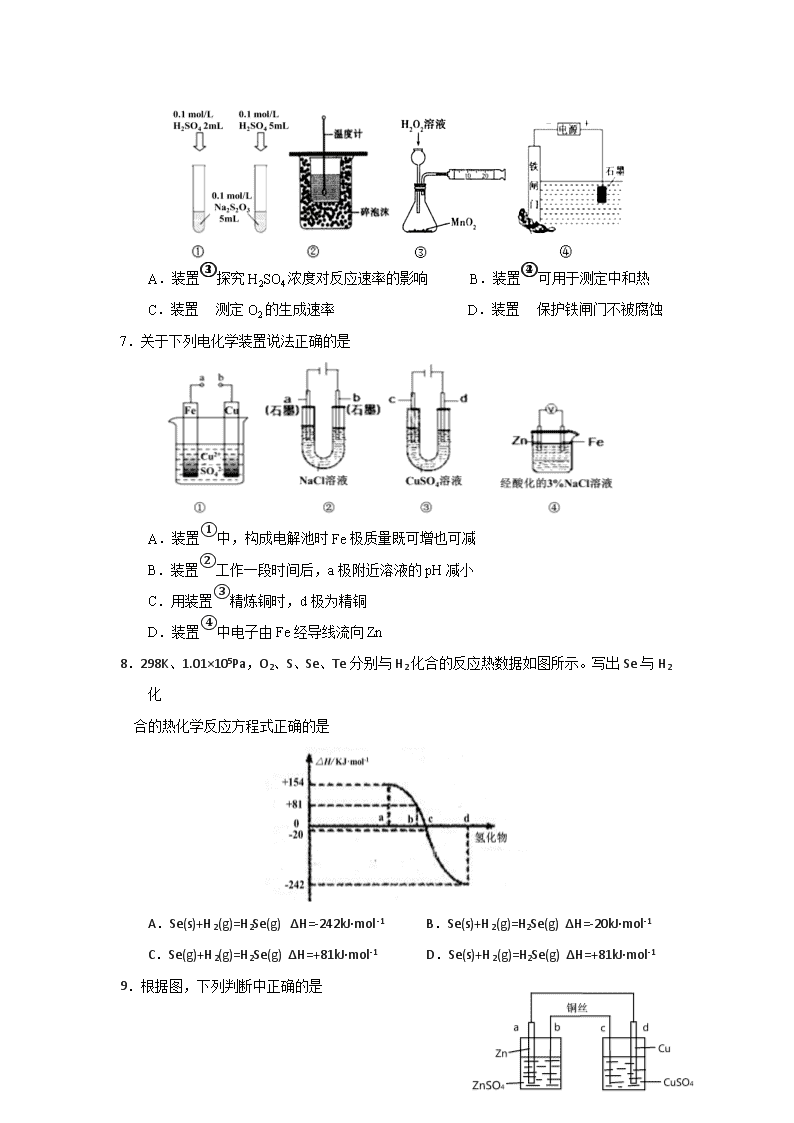
福建师大附中2018-2019学年第一学期期中考试卷 高二化学(实验班) 时间:90分钟 满分:100分 试卷说明: (1) 本卷两大部分,共23题,解答写在答卷的指定位置上,考试结束后,只交答卷。 (2) 考试过程中不得使用计算器或具有计算功能的电子设备。 (3) 可能用到的相对原子质量:Li-7 H-1 O-16 Cu-64 C-12 N-14 第Ⅰ卷(选择题,共45分) 一、单项选择题(只有一个正确选项,1-9每小题2分,10-18每小题3分,共45分) 1.已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应中,在任何温度下都不自发进行的是 A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0 C.N2(g)+3H2(g)=2NH3(g ) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0 2.对于平衡CO2(g) CO2(aq) △H= -19.75 kJ • mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是 A.升温增压 B.降温减压 C.升温减压 D.降温增压 3.下列对钢铁制品采取的措施不能防止钢铁腐蚀的是 A.保持表面干燥 B.表面镀锌 C.表面形成烤蓝 D.表面镶嵌铜块 4.用铁片与稀硫酸反应制取氢气时,下列措施几乎不影响氢气产生速率的是 A.加少量醋酸钠固体 B.不用稀硫酸,改用98%浓硫酸 C.滴加少量CuSO4溶液 D.加少量硫酸钠固体 5.一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是 A.混合气体的密度不再变化 B.反应容器中Y的质量分数不变 C.体系压强不再变化 D.2v逆(X)=v正(Y) 6. 下列装置或操作能达到目的是 A.装置①探究H2SO4浓度对反应速率的影响 B.装置②可用于测定中和热 C.装置③测定O2的生成速率 D.装置④保护铁闸门不被腐蚀 7.关于下列电化学装置说法正确的是 A.装置①中,构成电解池时Fe极质量既可增也可减 B.装置②工作一段时间后,a极附近溶液的pH减小 C.用装置③精炼铜时,d极为精铜 D.装置④中电子由Fe经导线流向Zn 8.298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化 合的热化学反应方程式正确的是 A.Se(s)+H2(g)=H2Se(g) ΔH=-242kJ·mol-1 B.Se(s)+H2(g)=H2Se(g) ΔH=-20kJ·mol-1 C.Se(g)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1 D.Se(s)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1 9.根据图,下列判断中正确的是 A.电路中电子的流动方向:a−d−CuSO4(aq) −c−b B.该原电池原理:Zn+CuSO4 ═ ZnSO4+Cu C.c电极质量减少量等于d电极质量增加量 D.d电极反应:Cu2++2e− = Cu,反应后CuSO4溶液浓度下降 10. 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如右,该电池工作时反应为: 4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是 A.电极a 为电池正极 B.图中选择性透过膜为阴离子透过性膜 C.电池工作过程中,电极a附近区域pH减小 D.VB2极发生的电极反应为: 2VB2 +22OH——22e- = V2O5 + 2B2O3 + 11H2O 11. 一定条件下对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、 c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是 A.c1∶c2=1∶3 B.平衡时Y和Z的生成速率之比为2∶3 C.X、Y的转化率之比为1:3 D.c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1 12.对于可逆反应:2A(g)+B(g) 2C(g) △H< 0,下列图像正确的是 13.下列有关图像,其中说法正确的是 A.由图Ⅰ知,反应在 T1、T3 处达到平衡 B.由图Ⅰ知,该反应的△H<0 C.由图Ⅱ知,t3时采取降低反应温度的措施 D.由图Ⅱ知,反应在 t6时,NH3 体积分数最大 14.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。第一阶段:将粗镍与 CO 反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是 A.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ B.增大c(CO),平衡正向移动,反应的平衡常数增大 C.第二阶段,Ni(CO)4分解率较低 D.增加Ni的含量,CO的转化率增大 15.清华大学王晓琳教授首创三室电解法制备LiOH,其工作原理如图所示,下列说法正确的是 A.X电极连接电源负极 B.N为阳离子交换膜 C.Y电极反应式为O2+2H2O+4e− ═ 4OH− D.制备2.4 g LiOH产生的H2在标准状况下为2.24 L 16.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响, 得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是 A.达到平衡,AB3的物质的量大小为:c>b>a B.若T2>T1,则正反应一定是放热反应 C.达到平衡时A2的转化率大小为:b>a>c D.若T2>T1,达到平衡时b、d点的反应速率为vd > vb 17.在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数 据如下表,下列说法不正确的是 实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol n(X) n(Y) n(M) ① 700 0.10 0.10 0.09 ② 800 0.20 0.20 0.10 ③ 900 0.10 0.15 a A.正反应为放热反应 B.实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速 率v(N)= 0.01mol/(L•min) C.实验②中,该反应的平衡常数K=1.0 D.实验③中,达到平衡时,a大于0.06 18.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应: X(g)+3Y(g)2Z(g) ΔH=-192kJ·mol-1。向M、N中都通入amolX和bmolY的混合气体, 初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变。下列说法一定正确 的是 A.平衡时,X的体积分数: M查看更多