2017-2018学年湖北省荆州中学高二下学期第三次半月考化学试题 Word版
2017-2018学年湖北省荆州中学高二下学期第三次半月考化学试卷
可能用到的相对原子质量:H−1 C−12 N−14 O−16 Na−23 Mg−24 Al−27 S−32 Cl− 35.5 K−39 Fe−56 Ba−137
一、选择题 (每小题3分,共48分,每小题只有一个选项符合题意)
1.SiCl4的分子结构与CCl4类似,对其做出如下推断:①SiCl4晶体是分子晶体;②常温常压SiCl4不是气体;③SiCl4分子是由极性键构成的非极性分子;④SiCl4熔点高于CCl4。其中正确的是( )
A.只有① B.只有①② C.只有②③ D.①②③④
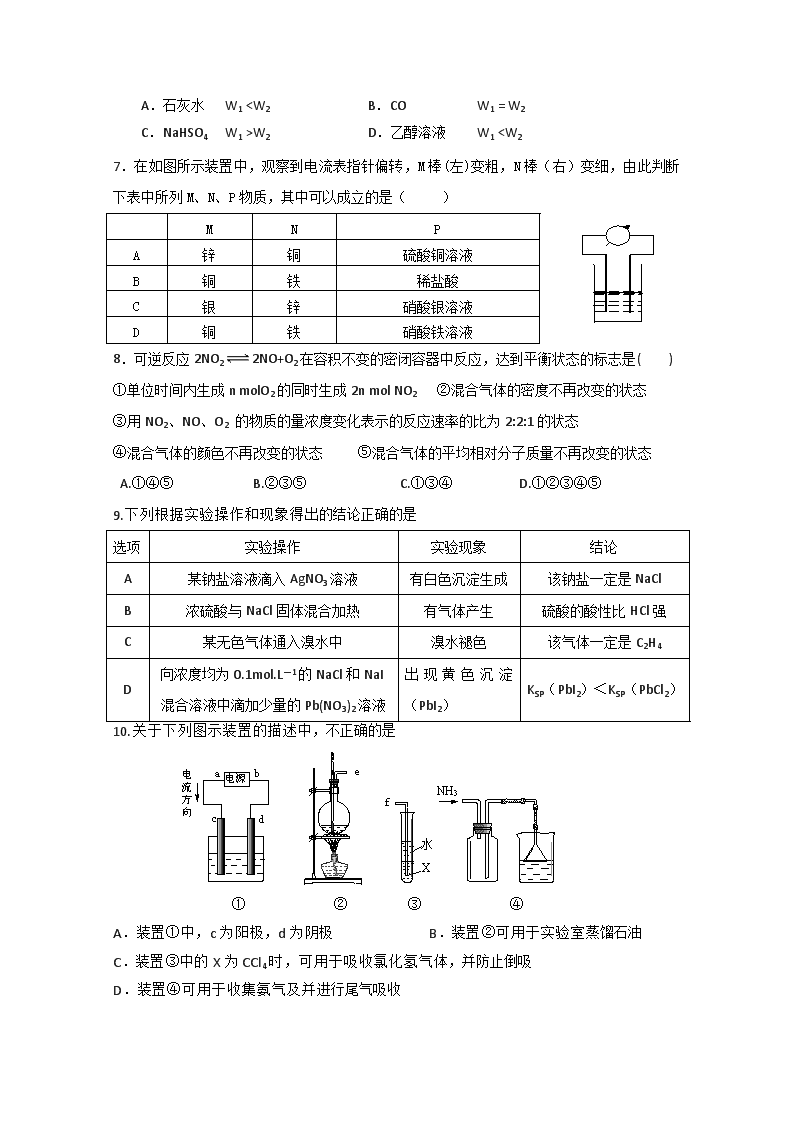
2.碳有三种同素异形体:金刚石、石墨、足球烯(C60),其中足球烯是分子晶体。据此推测下列叙述正确的是( )
A.金刚石、石墨、足球烯和氧气反应最终产物不同
B.足球烯与石墨晶体类型相同
C.石墨、足球烯均作为生产耐高温润滑剂的原料
D.足球烯在苯中的溶解度比在乙醇中的溶解度大
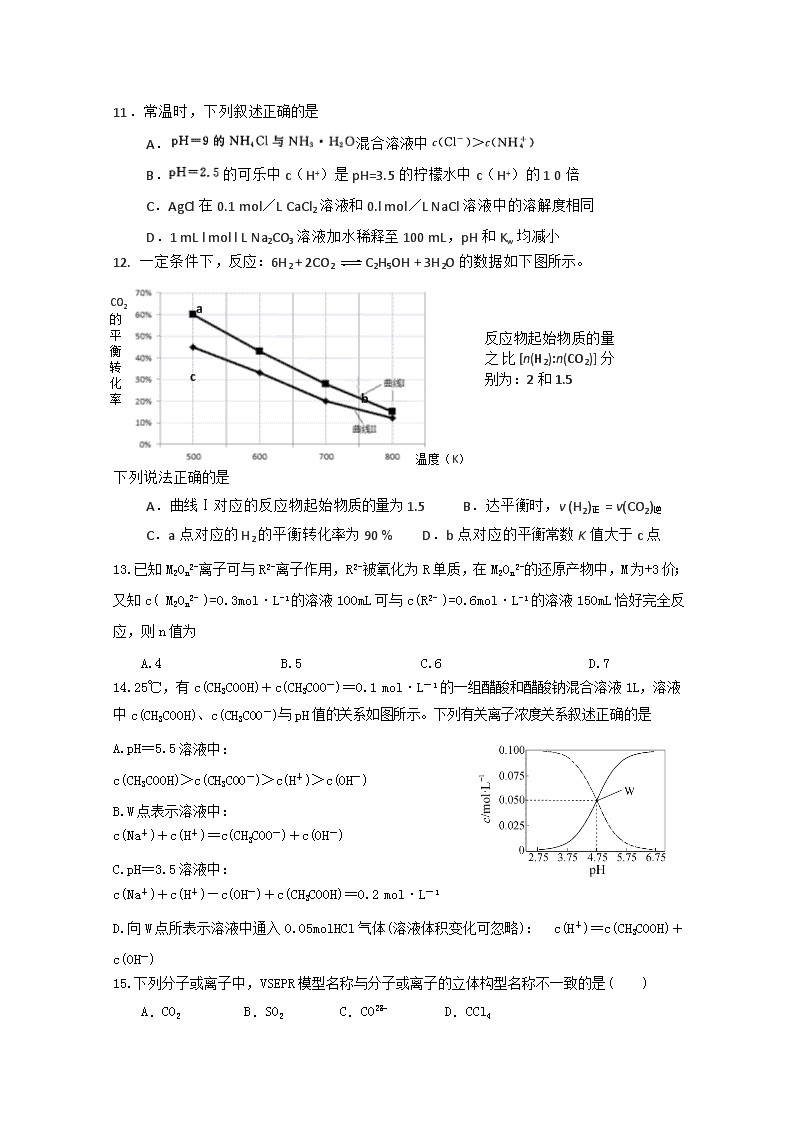
3.下列物质的熔点均按由高到低的排列,其原因是由于键能由大到小排列的是 ( )
A.铝、钠、干冰 B.金刚石、碳化硅、晶体硅
C.碘化氢、溴化氢、氯化氢 D.二氧化硅、二氧化碳、一氧化碳
4.天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )
A.CH4·14H2O B.CH4·8H2O
C.CH4·(23/3)H2O D.CH4·6H2O
5.下列说法正确的是 ( )
A.124g P4含有的P-P键的个数为6NA B.12g石墨中含有的C-C键的个数为2NA
C.12g金刚石中含有的C-C键的个数为1.5NA D.60gSiO2中含Si-O键的个数为2NA
6.将W1 g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥、称得其质量为W2 g。实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是 ( )
A.石灰水 W1
W2 D.乙醇溶液 W1 ”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置 。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是 。
③硅和锗单质分别与H2反应时,反应较难进行的是________(填“Si”或“Ge”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因________________。冶炼金属镓通常采用的方法是________________。
②为判断是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________。
18.过渡金属元素铁能形成多种配合物,如[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
(1与铁元素同周期同族相邻的元素的基态原子的价电子排布式为________。
(2尿素(H2NCONH2)分子中C、N原子的杂化方式分别是________、________。
(3)已知,每一个配体在与中心原子形成配位键时只提供一个孤电子对,配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________。 Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。
19.第二周期元素在元素家族中占据十分重要的地位。
(1)第二周期非金属元素第一电离能由大到小的顺序为 ,写出氮原子的价层电子排布图:________ 。
(2)第二周期非金属元素均可与氢元素形成多种分子或分子的聚合物,如CH4、NH3、H2O、H2O2、HF、(HF)n(n=2~6),其中分子结构为三角锥形的是________,前5
种物质中沸点由高到低的顺序为______________________,(HF)n能形成的原因是________________________________________________________________________。
(3)硼能形成一元含氧酸H3BO3,该酸能溶于水且能促进水的电离,此过程中得到一种硼原子最外层电子数目达到8电子稳定结构的新离子,试写出相应的电离方程式:
________________________________________________。
(4)石墨嵌入化合物有许多独特的性质,某钾(·)的石墨嵌入化合物平面投影如图Z35所示,则化合物中碳原子的杂化类型是______________,该层化合物的化学式为__________。
图Z35
20.研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为__________,所得溶液呈酸性,则所得溶液中c(SO32-) c(H2SO3) (填“>”或“<”)。
(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。
①乙电极上发生的是________反应(填“氧化”或“还原”); ②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)CO2(g)+H2(g) △H,得到如下数据:
实验m]
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
H2O
CO
CO
H2
I
650
2
4
2.4
1.6
5
II
900
1
2
1.6
0.4
3
III
900
2
1
a
b
t
①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为:
21.有A、B、C、D、E、F六种前四周期的元素。A是是前十号元素中原子核外未成对电子数最多的元素,B原子核外有1个未成对电子,B+比C原子少1个电子层,C原子得1个电子填入3p轨道后,3p轨道呈全充满状态。D原子的2p轨道有2个未成对电子,E的最高化合价和最低化合价的代数和为4,与D原子序数相差8。F位于周期表第12纵行且是六种元素中原子序数最大的。
请回答下列问题:
(1)C元素的电负性________(填“>”“<”或“=”)E元素的电负性。
(2)D的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)E2C2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在E2C2分子中E原子的杂化类型是________,E2C2是________(填“极性”或“非极性”)分子。
(4)F的价电子排布式为________,该元素位于周期表中的________族。
(5)D和E两种元素组成的一种极性分子为 ,一种非极性分子为 。
(6)据报道,美国科学家卡尔·克里斯特于1998年11月2日合成了一种名为“A5”的物质,由于其极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“A5”实际上是带正电荷的分子碎片,其结构是对称的,5个A排列成V形。如果5个A结合后都达到8个电子结构,且含有2个共价三键,则“A5”分子碎片所带电荷是________。
参考答案
一、 选择题
DDBBA DCADB BCDBB B
17. (1) ① >
② 第四周期第IVA族 作半导体材料。
③ Ge
(2) ① 两种元素的原子核外最外层电子数均为3 电解法
② NaOH HCl
18. (1)3d74s2 (2)sp2 sp3 (3) 5 分子
19.(1) F>N>O>C>B
(2)NH3 H2O2>H2O>HF>NH3 >CH4 HF分子之间可通过氢键缔合在一起
(3) H3BO3+H2O [B(OH)4]-+H+
(4)sp2杂化 KC12
20.(1) SO2+NH3+H2O===NH4++HSO3-
(2)还原 NO-2e-+O2-===NO2
(3)① < ②正向 ③ 0.4 >
21. (1)> (2)小 (3)sp3 极性 (4)3d104s2 ⅡB
(5) SO2 SO3 (6) +1