- 2021-07-02 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江苏省启东中学高一3月月考化学试题(创新班)
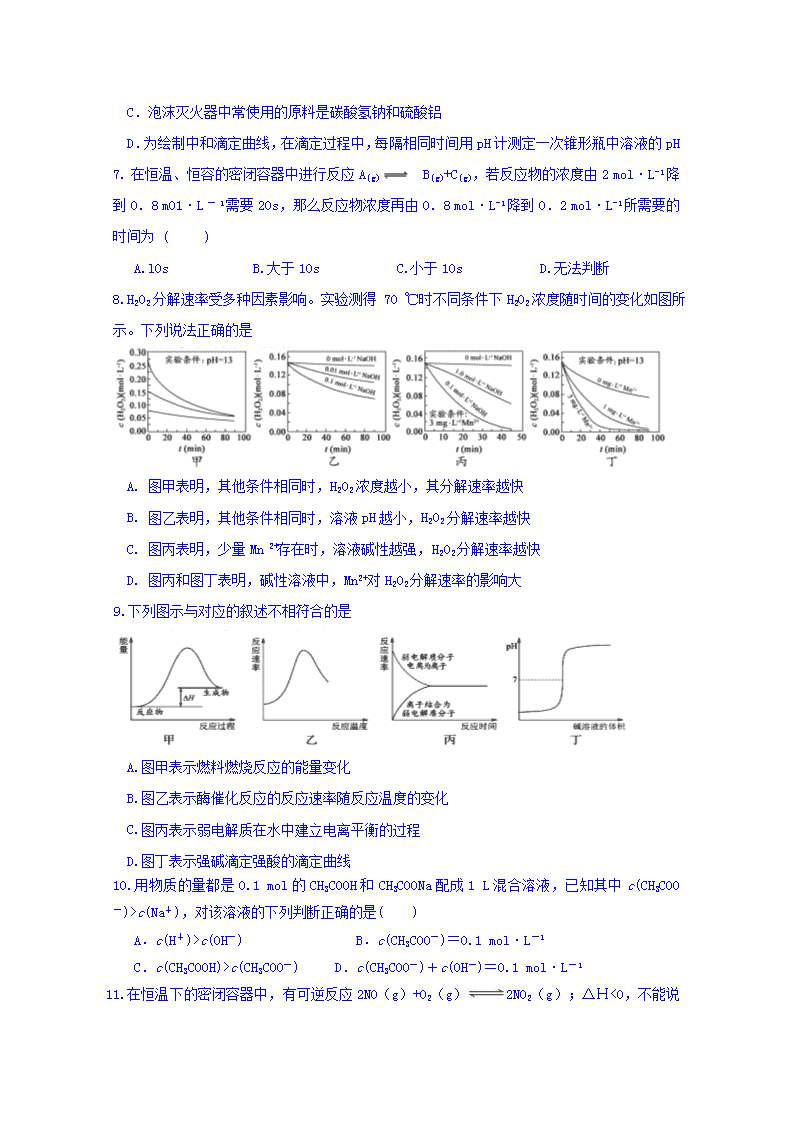
2018-2019学年江苏省启东中学高一3月月考化学试题(创新班) 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Ca 40 Mn 55 Fe 56 Co 59 Cu 64 Br 80 Ba 137 第一卷(选择题,共50分) 注意:本试题分第一卷和第二卷两部分,第一卷为选择题,第二卷为非选择题。考试时间为100分钟,满分为100分。 单项选择题(本题包括号15小题,每小题2分,共30分。每小题只有一个选项符合题意) 1. 盐类水解在工农业生产和日常生活中有着广泛的应用,有关应用或说法与盐类水解无关的是 A.用热的纯碱溶液洗涤餐具上的油污 B.生活中常用明矾净水 C.用稀硫酸或浓氨水除去铜器表面的铜绿 D.长期使用硫铵化肥的土壤,易变酸性,可施用适量的熟石灰 2.下列各组元素,按照原子半径依次减小、第一电离能依次增大的顺序排列的是 A、K、Na、Li B、Al、Mg、Na C、N、O、C D、P、S、Cl 3.下列变化需要吸收能量的是 A.1s22s22p63s1→1s22s22p6 B.3s23p5→3s23p6 C.2px22py12pz1→2px12py12pz2 D.2H→H—H 4.生活中的下列现象与原子核外电子发生跃迁有关的是 A、钢铁长期使用后生锈 B、节日里燃放的焰火 C、金属导线可以导电 D、卫生丸久置后消失 5. 下列有关物质性质或应用的说法正确的是 A.医疗上,常用碳酸钠治疗胃酸过多 B.在海轮外壳上安装锌块以减缓船体腐蚀 C.液氨汽化放出大量的热,可用作制冷剂 D.明矾具有强氧化性,常用于自来水的杀菌消毒 6.下列说法正确的是 A.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2 B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 C.泡沫灭火器中常使用的原料是碳酸氢钠和硫酸铝 D.为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH 7. 在恒温、恒容的密闭容器中进行反应A(g) B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8 m01·L一1需要20s,那么反应物浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为 ( ) A.l0s B.大于10s C.小于10s D.无法判断 8.H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是 A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 C. 图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快 D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 9.下列图示与对应的叙述不相符合的是 A.图甲表示燃料燃烧反应的能量变化 B.图乙表示酶催化反应的反应速率随反应温度的变化 C.图丙表示弱电解质在水中建立电离平衡的过程 D.图丁表示强碱滴定强酸的滴定曲线 10.用物质的量都是0.1 mol的CH3COOH和CH3COONa配成1 L混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是( ) A.c(H+)>c(OH-) B.c(CH3COO-)=0.1 mol·L-1 C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.1 mol·L-1 11.在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g)2NO2 (g);ΔΗ<0,不能说明已达到平衡状态的是 A.正反应生成NO2的速率和逆反应生成O2的速率相等 B.混合气体颜色深浅保持不变 C.反应器中压强不随时间变化而变化 D.混合气体平均分子量保持不变 12. 在一定条件下,Na2CO3溶液中存在CO+H2OHCO+OH-平衡。下列说法不正确的是 A.稀释溶液,增大 B.通入CO2,溶液pH减小 C.升高温度,平衡常数增大 D.加入NaOH固体,减小 13. 在其它条件一定时,图中曲线表示反应2NO(g)+ O2(g) 2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是( ) A.A或E B.B点 C.C点 D.D点 14.下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是 A.用装置甲制取氯气 B.用装置乙除去氯气中少量氯化氢 C.用装置丙分离二氧化锰和氯化锰溶液 D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O 15. 常温下,下列各组离子在指定溶液中能大量共存的是 A.常温时,在c(H+)=的溶液:Na+、Al3+、Cl-、S2- B.由水电离的c(H+)=10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- C.c(OH-)/c(H+)=10-12的溶液中:NH4+、Al3+、NO3-、Cl- D.加入金属铝能放出大量H2的溶液:NH4+、K+、HCO3-、CH3COO- 不定项选择题:本题包括5小题,每小题4分,共计20 分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题的0分;若正确答案包括两个选项,只选一个且正确的的2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 16. 下列有关说法正确的是 A.氨水稀释后,溶液中的值减小 B. 0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH增大 C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 D.298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH<0 17.铜锌原电池(如图)工作时,下列叙述正确的是 A.正极反应为:Zn-2e-=Zn2+ B.电池反应为:Zn+Cu2+=Zn2+ +Cu C.在外电路中,电子从正极流向负极 D.盐桥中的K+移向ZnSO4溶液 18. 下列说法正确的是 A. 反应N2 (g) +3H2 (g) 2NH3 (g)的ΔH < 0,ΔS >0 B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1 D. 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 19. 一定条件下存在反应:2SO2(g)+ O2 (g)2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 2 mol SO3 2 mol SO2 1 mol O2 2mol SO3 I绝热恒容 III恒温恒压 II恒温恒容 A.容器I、III中平衡常数相同 B.容器II、III中正反应速率相同 C.容器II、III中的反应达平衡时, SO3的体积分数:II > III D.容器I中SO2的转化率与容器II中SO3的转化率之和小于1 20.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是 A.0.1 mol·L-1CH3COONa溶液和0.1 mol·L-1 HCl溶液等体积混合: c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) B.0.1 mol·L-1 NH4Cl溶液和0.1 mol·L-1 氨水等体积混合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) C.0.1 mol·L-1 Na2CO3溶液和0.1 mol·L-1 NaHCO3溶液等体积混合: c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3) D.0.1 mol·L-1 Na2C2O4溶液和0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸): 2c(C2O42-) + c(HC2O4-) + c(OH-) = c(Na+) + c(H+) 非选择题(共50分) 21.已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答: (1)写出下列元素的元素符号和电子排布式: X____________________ Y___________________ Z____________________ W___________________ (2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为 。E在催化剂存在的条件下可用于还原汽车尾气中的______,以减少对大气的污染。 22.反应Fe(s)+CO2(g)FeO(s)+CO(g) ΔH=a kJ/mol1, 平衡常数为K; 温度/℃ 500 700 900 K 1.00 1.47 2.40 (1)若500℃时进行上述反应,CO2起始浓度为2 mol/L,CO的平衡浓度为________。 (2)上述反应中的a________0(填“大于”“小于”或“等于”)。 (3)700℃上述反应达到平衡,要使得该平衡向右移动,其他条件不变时,可以采取的措施有________(填序号)。 A.缩小反应器体积 B.通入CO2 C.升高温度到900℃ D.使用合适的催化剂 23. (1) 通过NOx传感器可监测NOx的含量,其工作原理示意图如下: ①Pt电极上发生的是 (填“氧化”或“还原”)反应。 ②写出NiO电极的电极反应式: 。 (2)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图: 请回答: ①甲烷燃料电池负极反应式是 。 ②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________ g。 24.三氯化铁是合成草酸铁的重要原料。 利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示: 溶解 萃取、分液 反应 工业FeCl3 …… Fe2(C2O4)3·5H2O 溶液X 异丙醚 水层 草酸溶液 分液 醚层 (1)抑制FeCl3水解,溶液X为 。 (2)述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。 (3)得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。 0 0 甲 乙 (4)为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器 (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。 a.盛放KMnO4的滴定管水洗后未用标准液润洗 b.滴定管滴定前尖嘴部分有气泡,滴定后消失 c.滴定前仰视读数,滴定后俯视读数 25.氢氧化镁用于制药工业,还是重要的绿色阻燃剂。 I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。 ⑴该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:___________。 Ⅱ、已知:Mg (s)+2H2O(g)=Mg(OH)2(s)+H2(g) △H1=-441kJ·mol-1 H2O(g)=H2(g)+O2(g) △H2=+242kJ·mol-1 Mg(s)+O2(g)=MgO(s) △H3=-602kJ·mol-1 ⑵氢氧化镁分解的热化学方程式是___________。 ⑶氢氧化镁可以作为阻燃剂的原因_________。(写一条即可) EDTA浸泡,分离 ② 保险粉 (即Na2S2O4)① Mg(OH)2 Fe(OH)3 Mg(OH)2 Fe(OH)2 阻燃剂:Mg(OH)2 溶液 Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。 ⑷步骤②中分离操作的名称是__________。 ⑸步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。 每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是 mol。 ⑹已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释。 。 26. 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。 (1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2 在一定条件下反应获得。相关热化学方程式如下: 2Ca3(PO4)2(s)+10C(s)=== 6CaO(s)+P4(s)+10CO(g) △H1 =+3359.26 kJ·mol-1 CaO(s)+SiO2(s)=== CaSiO3(s) △H2 =-89. 61 kJ·mol-1 2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=== 6CaSiO3(s)+P4(s)+10CO(g) △H3 则△H3 = kJ·mol-1。 (2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示: 11P 4+60CuSO4+96H2O=== 20Cu3P+24H3PO4+60H2SO4 60molCuSO4能氧化白磷的物质的量是 。 (3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。 ①为获得尽可能纯的NaH2PO4,pH应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系 。 ②Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。 高一创新班化学月考试卷答案 1C 2A 3A 4B 5B 6C 7B 8D 9A 10A 11A 12A 13C 14C 15C 16D 17B 18BC 19CD 20AC 24.⑴①(浓)盐酸 ②FeCl3在异丙醚中的溶解度大于其在水中的溶解度 取少量溶液,向其中滴加少量KSCN溶液,若溶液变红,则含有Fe3+。(或其他合理方法) ③除去杂质、减少草酸铁晶体的溶解损耗 ④甲 c ⑵向滤渣中加入足量HCl,充分反应后过滤、洗涤、干燥得铜粉;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+ 将FeCl3·6H2O在HCl的气氛中加热脱水 (除第⑴④第一空1分外,其余每空2分,共15分) 25⑴Mg(OH)2+2H+=Mg2++2H2O (1分) ⑵Mg(OH)2(s)=MgO(s)+H2O(g) △H=+81kJ·mol-1 (2分) ⑶氢氧化镁分解要吸收大量的热(其他合理答案也参照给分,1分) ⑷过滤 (1分) ⑸0.6 (1分) ⑹Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2 Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使平衡朝右移动而溶解 (2分) 26. (1)2821. 6 (2)3 mol (3)①4 ~5. 5(介于此区间内的任意值或区间均可) c(HPO42-)>c(H2PO4-) ②3Ca2++2HPO42-=== Ca3(PO4)2↓+2H+查看更多